信号肽筛选优化提高耐热α-环糊精酶在枯草芽胞杆菌中的表达
2022-05-24陈龙军林陈强贾宪波陈济琛
陈龙军,林陈强,贾宪波,方 宇,张 慧,陈济琛
(福建省农业科学院土壤肥料研究所,福建 福州 350003)
0 引言
【研究意义】环糊精是由6个以上葡萄糖通过α-1,4-糖苷键连结形成的环状低分子寡聚糖,根据组成的葡萄糖单体个数的不同(6~8个),分别称为α-、β-、γ-环糊精[1-2]。由于环糊精分子具有特殊的外表亲水、内里疏水的中空圆筒结构,能与许多客体分子形成包络物,进而改变客体分子的溶解度、稳定性等物理化学性质,因此在农药、食品、医药、化妆品和环保等领域具有广泛的应用[3-5]。通常环糊精是由环糊精葡萄糖基转移酶(EC 2.4.1.19,简称CGTase)通过催化淀粉等底物的环化而形成。环糊精酶属于α-淀粉酶家族,催化产生α-、β-、γ-环糊精的混合物,根据主要产物的不同,可分为α-、β-、γ-环糊精酶。另外环糊精酶除了催化环化反应外,还能催化耦合、水解、歧化等反应,是一种多功能复合酶[6-8]。鉴于环糊精的巨大应用价值,生产环糊精所必需的环糊精酶逐渐成为当今研究的热点。【前人研究进展】传统环糊精酶主要通过天然菌株的发酵获取,但由于天然菌株本身不稳定、产量低、发酵产物复杂不利于分离等困难,导致环糊精酶生产成本居高不下,进一步限制了环糊精的规模化应用。为了提高环糊精酶的产量,降低其生产成本,通过基因工程和蛋白质工程等技术,实现环糊精酶的异源高效表达,构建适用于工业化生产的菌株被认为是最有效的途径之一。枯草芽胞杆菌(Bacillus subtilis)作为传统的工业生产菌株,遗传背景清晰,无明显密码子偏好性,分泌能力强,易于培养,基因操作简单,发酵工艺成熟,被认为是理想的外源蛋白质的分泌表达宿主菌[9-10]。张佳瑜等[11]将来源于软化芽胞杆菌的α-环糊精葡萄糖基转移酶在枯草杆菌中进行表达,发酵优化后α-环糊精酶活力达到4.9 U·mL-1,表达量是野生软化芽胞杆菌表达量的9.8倍。外源蛋白质在枯草芽胞杆菌中的分泌表达依赖于信号肽的引导,主要有两个途径:Sec途径和Tat途径。对于同一种外源蛋白质,不同信号肽的引导分泌效率相差较大,两者之间存在适配性[12]。枯草芽胞杆菌信号肽由N端正电荷区(1~5个带正电氨基酸)、H段疏水区(7~15疏水性氨基酸)及C端信号肽酶识别区(3~7个亲水性氨基酸)组成。研究表明信号肽N端正电荷数、H端疏水性会影响目的蛋白在枯草芽胞杆菌中的分泌途径(Sec、Tat途径),从而影响目的蛋白的分泌效率。因此针对特定的蛋白质需要选择合适的信号肽,优化信号肽N端正电荷数对外源蛋白高效表达具有重要影响。【本研究切入点】目前大多数研究集中在通过菌株发酵条件优化、菌种诱变选育和不同外源表达系统来提高外源蛋白表达效率[13-14],有关信号肽及信号肽序列优化来提高外源蛋白表达仍鲜见报道。【拟解决的关键问题】本实验室在前期工作中从Geobacillus caldoxylosilyticus.CHB1中分离获得一个新型α-环糊精酶,其最适反应温度达到60 ℃,具有较好的热稳定性。该环糊精酶已在E. coli、芽胞杆菌及毕赤酵母中实现了克隆表达[15-17]。为了探索α-环糊精酶在枯草芽胞杆菌中的高效表达条件,本研究以来源于芽胞杆菌的173种信号肽为文库,筛选适合于α-环糊精酶高效表达的信号肽。在此基础上,对筛选获得的信号肽N端氨基酸进行突变,通过优化信号肽N端正电荷数,进一步实现α-环糊精酶在枯草芽胞杆菌中的高效分泌表达。
1 材料与方法
1.1 试验材料
1.1.1 菌种和质粒 枯草芽胞杆菌环糊精酶表达载体pBE-aprE-CGT及重组Bacillus subtilisRIK1285 /pBE-aprE-CGT由本实验室构建保存;Bacillus subtilisSecretory Protein Expression System(SP DNA mixture 173种分泌信号肽文库)、the In-Fusion HD Cloning System及E.coliHST08 Premium Competent Cells购自大连宝生物工程(TaKaRa)有限公司。
1.1.2 试剂与仪器 限制性内切酶、TaqDNA聚合酶、DNA Mark、Protein Mark、T4 DNA连接酶、DNA切胶回收试剂盒和质粒快速提取试剂盒(TaKaRa公司);PCR引物合成、测序等由上海生工生物工程股份有限公司完成,其余试剂均为国产或进口分析纯。3-18K超高速冷冻离心机(Sigma公司),PCR仪(基因有限公司),Micro Pulser电穿孔仪(美国 Bio-Rad公司),Multiskan FC酶标仪(美国Thermo公司)。
1.1.3 培养基 LB培养基(种子培养基):胰蛋白胨1%,酵母粉0.5%,NaCl 1%,Amp 终质量浓度100 μg·mL-1。TB(发酵培养基):甘油0.5%,蛋白胨1.2%,酵母粉2.4%,K2HPO41.64%,KH2PO40.23%。
1.2 试验方法
1.2.1 基因克隆和聚丙烯酰胺凝胶电泳 常规的分子克隆技术及蛋白表达产物的SDS-PAGE分析参照文献[16]。
1.2.2 环糊精酶信号肽表达载体文库的构建 以环糊精酶表达载体pBE-aprE-CGT为模板,在信号肽aprE上下游分别设计反向引物(M1:5′-CGCGTCCC TCTCCTT TTGCTTAAGT TCAGAGTAG-3′; E1: 5′-GGCCGGTGCACATATGGAGCTCGGTACCCTCG AG-3′),采用 PrimeSTAR Max DNA Polymerase对该表达载体进行线性化扩增。PCR 反应条件:98 ℃10 s,62 ℃ 15 s,72 ℃ 30 s;循环 30 次;72 ℃ 10 min。扩增产物用切胶回收试剂盒进行线性载体pBE-CGT长片段回收,备用。
将线性载体pBE-CGT与SP DNA mixture按比例混合,用5X In-Fusion HD Enzyme Premix进行同源重组,重组产物转化受态细胞E.coliHST08,经100 μg·mL-1氨苄青霉素抗性LB平板过夜培养,收集克隆子进行混合培养,提取混合质粒,构建环糊精酶信号肽表达载体库pBE-SP-CGT。
1.2.3 重组枯草芽胞杆菌的构建 采用电转化方法,冰浴融化感受态细胞Bacillus subtilisRIK1285 取100 μL与3 μL重组质粒pBE-SP-CGT混匀,设置电转化参数(电击参数 1 500 V、25 μF、200 Ω),将pBE-SP-CGT载体导入感受态Bacillus subtilisRIK1285中,于10 μg·mL-1卡那霉素抗性LB平板培养至转化子出现(24~48 h),获得重组Bacillus subtilisRIK1285/pBE-SP-CGT。
1.2.4 重组枯草芽胞杆菌的筛选表达与信号肽鉴定 种子液培养:挑取重组枯草芽胞杆菌Bacillus subtilis单克隆于LB 培养基生长18 h;发酵培养:按1%接种量将种子发酵液接种至50 mL发酵培养基,在37 ℃摇床培养24 h,进行诱导表达,于12 000 r·min-1离心2 min除菌体,收集上清液和菌体,测定α-环糊精酶活性。以重组Bacillus subtilisRIK1285 / pBE-aprECGT为对照,筛选α-环糊精酶活性高于对照的重组克隆子,提取该克隆子质粒,送上海生工生物工程股份有限公司进行测序,鉴定相应信号肽序列。
1.2.5 信号肽定点饱和突变 以筛选获得表达效果最好的信号肽表达载体(pBE-citH-CGT)为模板,采用QuikChange Lightning Site-Directed Mutagenesis Kit,结合信号肽citH信号肽碱基序列及拟突变氨基酸位点设计19种氨基酸突变引物,如表1(Gly2,带下划线碱基序列为突变的氨基酸碱基密码子)所示。以表1引物进行PCR扩增(95 ℃ 2 min;95 ℃20 s,60 ℃ 10 s,68 ℃ 4 min,20 个循环;68 ℃5 min),获得包含突变信号肽的线性表达载体片段。该片段经DpnI酶处理后,转化大肠杆菌DH5α,于含 100 μg·mL-1氨苄青霉素抗性 LB 平板过夜培养,筛选转化子测序鉴定突变结果,完成突变的19个信号肽突变表达载体转化枯草芽胞杆菌Bacillus subtilisRIK1285进行环糊精酶表达,测定各突变子的环糊精酶表达活性。同理分别对N3、T4进行饱和突变(具体序列省略)。

表1 citH信号肽第二位Gly饱和突变引物Table 1 Primers for saturated mutation of G2
1.2.6 α-CGTase酶活性测定 测定 α-环糊精葡萄糖基转移酶活力的方法参照甲基橙褪色法[18],具体操作如下:取0.9 mL预先用50 mmol·L-1磷酸钠缓冲液(pH 6.0)配制的3%(m/V)可溶性淀粉溶液于试管中,置于60 ℃水浴锅内预热2 min,然后加入粗酶液或适当稀释的纯酶液0.1 mL,反应10 min,立即加入1.0 mL 1 mol·L-1的盐酸终止反应,再加入1.0 mL(pH6.0)的0.1 mmol·L-1的甲基橙溶液,混匀后于16 ℃下保温20 min,用酶标仪测定波长505 nm处的吸光度并根据空白计算褪色程度(ΔA),最后根据α-环糊精标准曲线计算出α-环糊精的浓度。酶活性单位定义为:60 ℃,pH6.0下,每分钟催化产生1 μmol相应环糊精所需的酶量即为一个酶活力单位(U)。
1.3 α-CGTase的酶学性质分析
1.3.1 温度 对 重 组 CGTase α-环化 活 性 的 影响 在pH6.0 条件下,将纯酶液依次在 30 、40 、50 、60 、65 、70 ℃、80 ℃ 温度下测定酶 α-环化活力大小,考察温度对酶α-环化活性的影响,最适温度下的酶活力定义为100%,计算相对酶α-环化活力。
1.3.2 温度对重组α-CGTase热稳定性的影响 在pH6.0 条件下,将纯酶液分别置于 40 、50 、60、70 、80 ℃ 的水浴中处理 30 、60 、90、120 min,结束后将酶液置于冰浴中冷却,然后按照酶α-环化活力测定方法测定其酶活力,考察温度对酶稳定性的影响,未经处理条件下的酶α-环化活力定义为100%,计算残余酶α-环化活力。
1.3.3 pH 对重组 CGTase α-环化活性的影响 在 60 ℃下,将纯酶液分别于pH为3.0、4.0、5.0、5.5、6.0、6.5、7.0、8.0、9.0、10.0缓冲液中,测定不同pH下的酶活力大小,考察pH对酶α-环化活性的影响,最适pH下的酶活力定义为100%,计算相对酶活力。
1.3.4 不同金属离子对重组CGTase α-环化活性的影响 在反应体系中分别加10 mmol·L-1不同的金属离子和抑制剂,测定其酶α-环化活力,考察不同金属离子和抑制剂对酶α-环化活性的影响,以反应体系中不加入金属离子和抑制剂作为对照,定义其酶活力100%,计算相对酶活力。
1.4 数据处理
数据采用Origin pro 8处理并进行方差分析。
2 结果与分析
2.1 信号肽表达载体库构建
重组蛋白的分泌水平受信号肽种类的影响十分显著。SP DNA mixture包含能编码173种Bacillus subtilis分泌信号肽的DNA片段,本文运用同源重组的方法将线性载体pBE-CGT与SP DNA mixture进行同源整合获得α-环糊精酶信号肽表达载体库pBE-SP-CGT;并电转化Bacillus subtilisRIK1285进行α-环糊精酶活性筛选,共筛选365个阳性转化子,以Bacillus subtilisRIK1285/pBE-aprE-CGT表达菌株为对照,筛选获得9条表达活性高于对照组的信号肽(citH、ybdG、amyE、nprE、bpr、bglS、bglC、sacB、yweA),结果如图 1所示,其中尤以信号肽citH表达效果最好,胞外α-环糊精酶活性达(9.6±0.29) U·mL-1,是对照组[(5.3±0.22) U·mL-1]的 1.8倍,显著高于对照组。α-环糊精酶主要以胞外形式进行分泌表达,胞外发酵上清蛋白电泳如图2所示,与对照相比,在66.4~97.2 kDa有1条约75 kDa蛋白,与目标蛋白大小一致,不同信号肽表达环糊精酶蛋白亮度差异不明显(表达量不高)。筛选获得的9条信号肽氨基酸序列如表2所示。

表2 信号肽氨基酸序列表Table 2 Amino acid sequence of signal peptide

图1 不同信号肽对目的蛋白的影响Fig. 1 Effects of signal peptides on target protein production

图2 不同信号肽SDS-PAGE 电泳结果Fig. 2 SDS-PAGE analysis on signal peptides
2.2 citH信号肽优化对α-环糊精酶分泌表达的影响
2.2.1 citH信号肽Gly2、Asn3、Thr4饱和突变对α-环糊精酶分泌表达的影响 以空载体pBE及pBE-citHCGT表达载体为对照,对信号肽citH的N端氨基酸序列中Gly2、Asn3、Thr4分别进行饱和突变,各突变体胞内、胞外α-环糊精酶活性变化如图3、4、5所示。由图3可看出,当Gly2突变为G2A、G2K、G2L、G2V、G2R,胞外α-环糊精酶活性均高于对照,尤其是G2R显著高于citH,使胞外α-环糊精酶活性由(9.6±0.29) U·mL-1提高到(10.7±0.27) U·mL-1,增加了11.5%。由图4可知,当Asn3突变为N3M、N3A、N3K、N3V、N3G、N3R时,信号肽更有利于α-环糊精酶的分泌表达,特别是N3K突变子显著高于citH,使胞外 α-环糊精酶活性由(9.6±0.29 )U·mL-1提高到(11.5±0.28) U·mL-1,增加了19.8%。同理对Thr4进行饱和突变(图5),T4M、T4A、T4K、T4C、T4L、T4G、T4R 等7个突变信号肽表达效果均优于对照,其中T4L显著增加,使胞外α-环糊精酶活性由(9.6±0.29) U·mL-1提高到(11.8±0.21)U·mL-1,增加了22.9%。
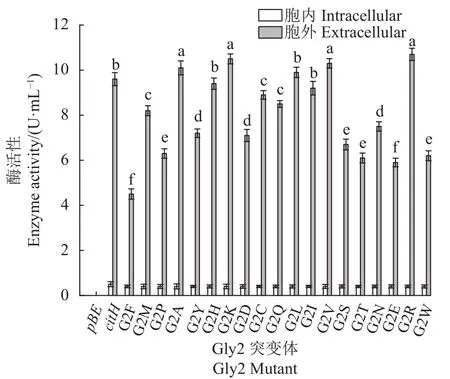
图3 citH信号肽Gly2饱和突变对α-环糊精酶分泌表达的影响Fig. 3 Effect of Gly2 saturation mutation of citH on α-CGTase activity

图4 citH信号肽Asn3饱和突变对α-环糊精酶分泌表达的影响Fig. 4 Effect of Asn3 saturation mutation of citH on α-CGTase activity

图5 citH信号肽Thr4饱和突变对α-环糊精酶分泌表达的影响Fig. 5 Effect of Thr4 saturation mutation of citH on α-CGTase activity
2.2.2 citH信号肽多点突变对α-环糊精酶分泌表达的影响 以空载体pBE及pBE-citH-CGT表达载体为对照,G2R、N3K、T4L突变信号肽为基础,对信号肽citH的N端氨基酸序列进行组合突变,构建多点突变信号肽G2R-N3K-CGT、G2R-T4L-CGT、N3K-T4LCGT、G2R-N3K-T4L-CGT,各突变子分泌α-环糊精酶的能力如图6所示。双点、三点复合突变信号肽,分泌α-环糊精酶的能力均高于单点突变信号肽,呈显著上升趋势;尤其是三点突变G2R-N3K-T4L-CGT,分泌α-环糊精酶的能力最强,显著高于pBE-citHCGT,其胞外α-环糊精酶活性由(9.6±0.29) U·mL-1增加到 (14.2±0.11) U·mL-1,提高了 47.9%。各突变信号肽表达环糊精酶胞外蛋白电泳分析如图7所示,经过3次突变后,G2R-N3K-T4L-CGT突变子蛋白条带亮度略有提高,但不明显。
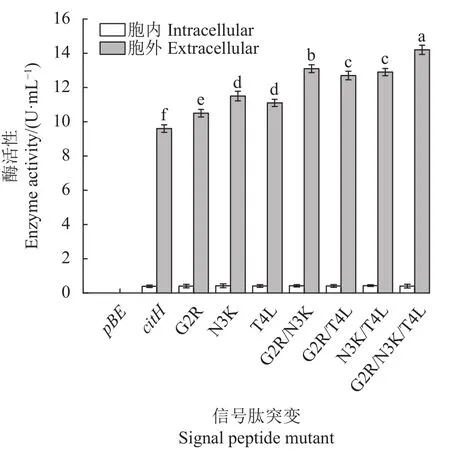
图6 citH信号肽多重突变对α-环糊精酶分泌表达的影响Fig. 6 Effect of multiple mutation of citH on α-CGTase activity

图7 不同信号肽的SDS-PAGE 电泳图分析Fig. 7 SDS-PAGE analysis on signal peptide mutant
2.3 重组α-环糊精酶的酶学性质
2.3.1 pH对重组α-环糊精酶活性的影响 由图8可知,α-环糊精酶最适反应pH6.0,在pH3.0~6.0随pH升高,相对酶活性呈上升趋势,当pH大于6.0后,随pH增加,酶活性逐渐降低。

图8 pH对α-环糊精酶活力的影响Fig. 8 pH dependence of α-CGTase activity
2.3.2 温度对重组α-环糊精酶活性的影响 由图9可知,α-环糊精酶活力为30~80 ℃,呈先上升后下降的趋势,当反应温度为60 ℃时,α-环糊精酶活力最高,因此,该酶最适反应温度为60 ℃。
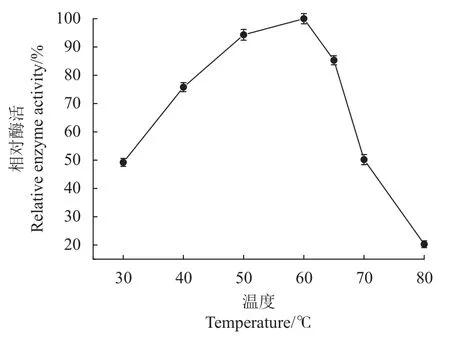
图9 温度对α-环糊精酶活力的影响Fig. 9 Temperature dependence of α-CGTase activity
2.3.3 α-环糊精酶的热稳定性 α-环糊精酶在不同温度下保温不同时间,酶活力变化如图10所示。当保温温度低于50 ℃时,经过90 min保温,α-环糊精酶相对酶活力仍能达到70 %以上,尤其是在40 ℃条件下保温120 min,相对酶活力高达97.5 %,具有较好的热稳定性。当保温温度高于50 ℃时,随着保温时间延长,相对酶活力呈明显下降趋势,温度越高,酶活力下降越明显。

图10 不同温度下α-环糊精酶的热稳定性Fig. 10 Thermal stability of α-CGTase activity
2.3.4 不同金属离子及抑制剂对重组α-环糊精酶活性的影响 不同金属离子及抑制剂对α-环糊精酶活性的影响如图11所示。Mg2+、Ca2+对α-环糊精酶活性具有显著促进作用,10 mmol·L-1的 Mg2+、Ca2+使 α-环糊精酶活性达到117.9 %及121.9 %。而Cu2+、Mn2+、Na+、Zn2+、Al3+、EDTA、Trition、SDS 对 α-环糊精酶活性具有不同程度的抑制作用,其中Na+及SDS抑制作用显著,α-环糊精酶活性降至初始值的72.1%及33.5%。此外Fe2+、Li+、K+对α-环糊精酶活性的影响不显著。

图11 不同金属离子及抑制剂对α-环糊精酶活力的影响Fig. 11 Effect of metal ions and inhibitors on α-CGTase activity
3 讨论
枯草芽胞杆菌(Bacillus subtilis)是一种公认的符合食品安全标准的基因工程菌,在生物工程研究及食品工业中应用潜力巨大。枯草芽胞杆菌含有173种信号肽,大量研究表明,外源蛋白的表达与特定信号肽之间存在着明显的适配性;信号肽的结构特征、基因转录及翻译水平的高低对蛋白分泌表达效率具有重要影响[19]。因此针对外源蛋白基因,建立信号肽库,筛选与目标蛋白匹配度最高的信号肽,已经成为提高外源蛋白分泌的有效手段。袁林等[20]对来源于枯草芽胞杆菌的9 种信号肽进行筛选,获得引导PFA高效分泌表达的信号肽YfkN。与α-淀粉酶PFA的自身信号肽相比,表达量提高了约10倍。Guan C等[21]通过筛选来源于枯草芽胞杆菌的19种信号肽,获得分泌表达氨基肽酶效率更优的信号肽YncM,是氨基肽酶自身信号肽胞外表达效率的1.2倍。Zhang W等[22]通过筛选来源于枯草芽胞杆菌的138种信号肽(114个Sec和24个Tat途径信号肽),获得分泌碱性木聚糖酶效率较优的信号肽PhoB。本研究以枯草芽胞杆菌173种信号肽为对象,筛选获得了与α-环糊精酶分泌表达匹配度较优信号肽9条,其中citH信号肽引导分泌α-环糊精酶活性是初始aprE信号肽的1.8倍,达到(9.6±0.29)U·mL-1。
有研究表明,外源蛋白的分泌表达并不完全决定于信号肽,其还与启动子强弱、蛋白酶分泌量、信号肽mRNA的稳定性差异、蛋白质跨膜过程涉及的分子伴侣及异位复合物的有效性、发酵诱导条件等有关[23-24]。祝发明等[25]通过定点突变使AmyX蛋白信号肽N端正电荷增加,H端疏水性降低,最终使β-半乳糖苷酶分泌效率提高了2.3倍。Caspers等[26]对来自枯草芽胞杆菌的信号肽Amy E的N端4个氨基酸进行突变,改变信号肽N端带电荷数,研究突变信号肽对来源于Fusarium solanipisi的角质酶在枯草芽胞杆菌中分泌表达的影响,结果表明信号肽带正电荷氨基酸数量与其分泌表达效率并无正相关性。袁林等[20]通过对信号肽Yfk N的N端中非正电荷氨基酸Ile3和Gln4进行饱和突变,获得引导分泌效率更优的突变体I3G/Q4R,亦表明信号肽Yfk N的N端带正电荷数量与其引导PFA的分泌效率并无正相关性。本研究通过对信号肽citH信号肽的N端中非正电荷氨基酸Gly、Asn3、Thr4进行饱和突变,考察N端信号肽正电荷数变化对酶蛋白表达效率的影响,结果获得多个表达效率更高的单突变体、双突变体及三突变体信号肽,研究结果亦显示信号肽citH的N端正电荷数量与α-环糊精酶分泌效率无明显正相关性。
本研究对citH信号肽进行多点复合突变,获得分泌表达效率更高的信号肽三点突变体G2R-N3KT4L,其引导分泌α-环糊精酶的胞外环化活性达到(14.2±0.11 )U·mL-1,相比未突变信号肽 [(9.6±0.29) U·mL-1],分泌效率提高了47.9%;是野生菌株嗜热地芽胞杆菌Geobacillus caldoxylosilyticus.CHB1(0.66 U·mL-1)的 21.5倍[27]。本研究通过对枯草芽胞杆菌信号肽文库的筛选与优化,实现了α-环糊精酶在枯草芽胞杆菌中的高效表达,并研究了重组α-环糊精酶的酶学性质,其最适反应pH为6.0,最适反应温度为60 ℃,在50 ℃范围内稳定;Mg2+、Ca2+对α-环糊精酶活性具有一定的激活。尽管本研究较大程度提高了α-环糊精酶胞外分泌表达能力,但其仍无法满足规模化应用的要求,接下来的工作考虑通过更大范围内信号肽筛选优化及工程菌发酵条件优化等进一步提高α-环糊精酶表达水平。
