水酶法提取红瓜子仁油工艺条件优化及其挥发性成分分析
2022-08-04谭韩英谢冬娣陈振林李淑梅韦佳萍
谭韩英,高 丹,谢冬娣,陈振林,李淑梅,韦佳萍
(贺州学院 食品与生物工程学院,广西 贺州 542899)
红瓜子是籽用西瓜的种子,其壳呈红色,其仁富含蛋白质、脂肪、钙、磷和多种维生素[1-2]。红瓜子仁粗脂肪含量在40%左右,油中不饱和脂肪酸含量达79%[3], 可作为一种优质的食用植物油进行开发。
水酶法提油虽然在提取过程中易形成乳化层,对提取率有一定的影响[4],但由于其具有提取温度比较低、易于处理、污染少等优势,在花生油[5]、椰子油[6]、南瓜籽油[7]、蓖麻籽油[8]等方面均有研究报道。此外,研究发现水酶法提取的花生油[9]、大豆油[10]、橄榄油[11]等与压榨法、溶剂浸出法的相比,油脂的风味物质得到较好的保留。
挥发性物质是形成植物油风味的重要成分,是判断植物油质量优劣的重要指标,也可以作为油脂贮藏期品质变化的指标[12]。目前对挥发性成分检测使用的方法主要有顶空固相微萃取-气质联用 (HS-SPME-GC-MS)[13-14]、气相-离子迁移谱(GC-IMS)[15]、气相色谱-嗅闻-质谱联用(GC-O-MS)[16]等。目前尚未有对水酶法提取红瓜子仁油工艺及其挥发性成分的研究,因此本文以红瓜子为原料,对水酶法提取红瓜子仁油工艺条件进行研究,并采用顶空气相色谱-离子迁移谱(HS-GC-IMS)对其挥发性成分进行分析,为水酶法提取红瓜子仁油提供一定技术支持。
1 材料与方法
1.1 试验材料
红瓜子,贺州信都。碱性蛋白酶 Alcalase 2.4L(酶活 2.4 AU/g),丹麦诺维信公司;氢氧化钠(分析纯),西陇科学股份有限公司;石油醚(分析纯),天津市大茂化学试剂厂;1 mol/L盐酸溶液,广州和为医药科技有限公司。
FW100高速万能粉碎机;HWS电热恒温水浴锅;EX224ZH电子天平;SZC-C脂肪测定仪;TDL-5C低速大容量离心机;BPG-9070A精密鼓风干燥箱;FlavourSpec®风味分析仪, 德国G.A.S.公司。
1.2 试验方法
1.2.1 红瓜子仁油的水酶法提取工艺
红瓜子→剥壳取仁→烘干(80℃,2 h)→粉碎(15 s)→取5.0 g红瓜子仁粉并加水(料液比1∶5)→加酶并在设定条件下酶解→升温灭酶(100℃,15 min)→离心(5 000 r/min,10 min)→红瓜子仁油。
1.2.2 红瓜子仁油提取率的计算
红瓜子仁油提取率(Y)按式(1)计算。
Y=m1/m0×100%
(1)
式中:m1为提取的红瓜子仁油质量;m0为红瓜子仁中油的质量。
1.2.3 红瓜子仁油挥发性成分分析
采用HS-GC-IMS分析红瓜子仁油的挥发性成分。
1.2.3.1 样品制备
以最佳提取工艺提取的红瓜子仁油,贮藏期0 d,作为样品1(编号为HGZY-1);将红瓜子仁油置于4℃冰箱中存放1年,作为样品2(编号为HGZY-2)。
1.2.3.2 样品处理
取2.0 mL油样于20 mL顶空瓶中,在500 r/min、60℃下孵育15 min后进样。
1.2.3.3 GC-IMS 分析条件
MXT-5色谱柱(15 m×0.53 mm×0.25 μm);柱温60℃;IMS温度45℃;分析时间20 min;自动进样量500 μL;进样针温度85℃;载气E1(漂移气)流速150 mL/min;载气E2(气相载气)流速为0~2 min 2 mL/min,2~10 min 10 mL/min,10~20 min 100 mL/min。通过仪器内置NIST气相保留指数数据库和IMS迁移时间数据库进行定性分析。
2 结果与分析
2.1 水酶法提取红瓜子仁油单因素试验
2.1.1 酶添加量对红瓜子仁油提取率的影响
在pH 9、酶解温度50℃、酶解时间3 h条件下,按1.2.1方法提取红瓜子仁油,考察碱性蛋白酶添加量对红瓜子仁油提取率的影响,结果见图1。

图1 酶添加量对红瓜子仁油提取率的影响
由图1可知,随着酶添加量的增加,红瓜子仁油提取率逐渐增加然后趋于平缓,当酶添加量为5%时,红瓜子仁油提取率最高。这是因为酶添加量越多,酶与底物反应越充分,蛋白质被酶解,与蛋白质结合的油脂被释放,使红瓜子仁油提取率增加,但当酶与底物达到饱和时,酶添加量增多并不能使红瓜子仁油提取率增加。
2.1.2 酶解时间对红瓜子仁油提取率的影响
在碱性蛋白酶添加量3%、pH 9、酶解温度50℃条件下,按1.2.1方法提取红瓜子仁油,考察酶解时间对红瓜子仁油提取率的影响,结果见图2。
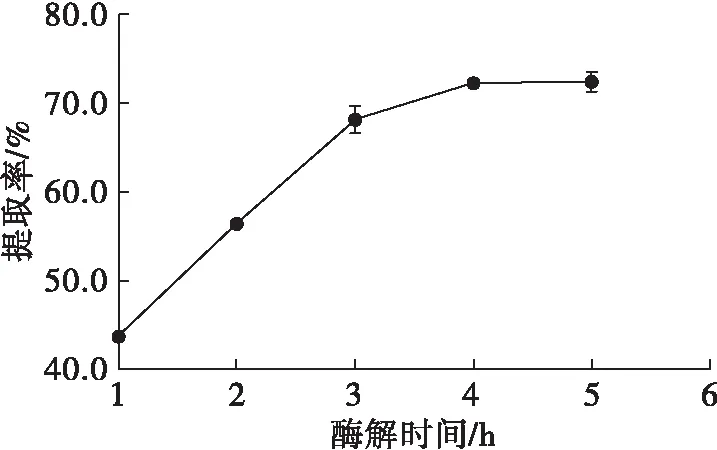
图2 酶解时间对红瓜子仁油提取率的影响
由图2可知,随着酶解时间的延长,红瓜子仁油提取率先快速增加后趋于平缓,当酶解时间为4 h时,红瓜子仁油提取率最高。这是由于延长酶解时间,红瓜子仁中的蛋白质不断被酶解,油脂得到充分释放,油脂提取率不断增大,但随着酶解时间的继续延长,底物与酶结合已经达到饱和,提取率不再增加。
2.1.3 酶解温度对红瓜子仁油提取率的影响
在碱性蛋白酶添加量3%、pH 9、酶解时间3 h条件下,按1.2.1方法提取红瓜子仁油,考察酶解温度对红瓜子仁油提取率的影响,结果见图3。
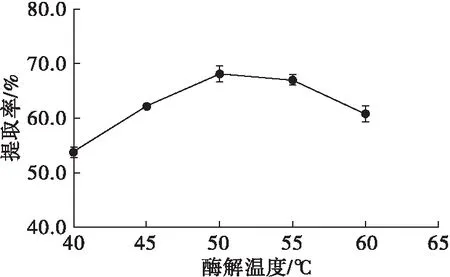
图3 酶解温度对红瓜子仁油提取率的影响
由图3可知,随着酶解温度的升高,红瓜子仁油提取率不断增加,在酶解温度为50℃时达到最高,之后随着酶解温度的继续升高红瓜子仁油提取率降低。这是因为温度对酶催化反应速率的影响有双重效应,温度升高,反应速率加快,达到酶最适反应温度时,酶的活性发挥到最高,但随着温度的继续升高,酶逐渐变性,催化反应速率下降[17]。
2.1.4 pH对红瓜子仁油提取率的影响
在碱性蛋白酶添加量3%、酶解温度50℃、酶解时间3 h条件下,按1.2.1方法提取红瓜子仁油,考察pH对红瓜子仁油提取率的影响,结果见图4。

图4 pH对红瓜子仁油提取率的影响
由图4可知,pH为9时,红瓜子仁油提取率最高。pH影响酶的活性,酶在最适pH条件下催化活性最高,pH过低或过高都会引起酶变性而失活。另外试验过程中观察到pH为7、8时,乳化现象相对严重。
2.2 水酶法提取红瓜子仁油正交试验
在单因素试验的基础上,以酶添加量(A)、酶解时间(B)、酶解温度(C)、pH(D)为因素,以红瓜子仁油提取率为考察指标,采用L9(34)正交试验对水酶法提取红瓜子仁油的工艺条件进行优化。正交试验因素水平见表1,正交试验设计及结果见表2,方差分析见表3。

表1 正交试验因素水平
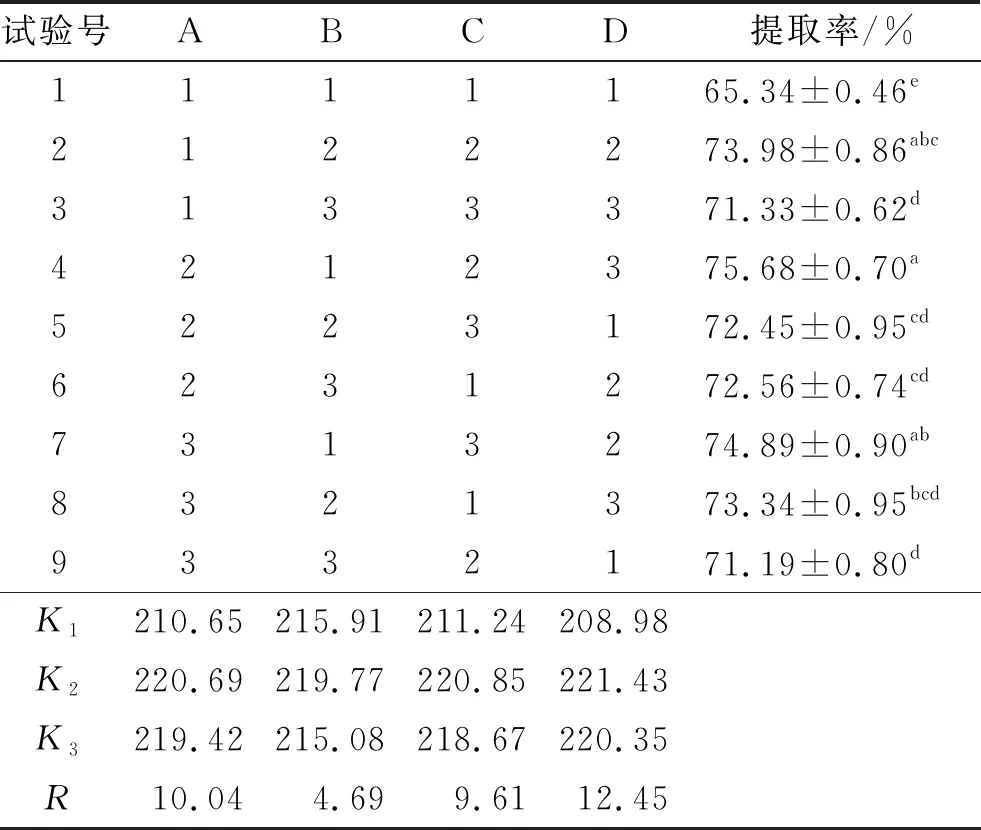
表2 正交试验设计及结果
由表2和表3可知,各因素对红瓜子仁油提取率的影响大小顺序为D (pH)>A(酶添加量)>C(酶解温度)>B(酶解时间),且各因素对红瓜子仁油提取率的影响均极显著,最佳提取条件为A2B2C2D2。在最佳提取条件下进行验证试验,红瓜子仁油提取率为76.67%,将其结果与试验方案A2B1C2D3、A3B1C3D2、A1B2C2D2的结果进行显著性分析,结果表明,A2B2C2D2与A2B1C2D3、A3B1C3D2试验结果差异不显著,考虑到提取时间越长、酶用量越多,成本更高,因此确定最佳提取条件为A2B1C2D3,即酶添加量5%、酶解时间3 h、酶解温度50℃、pH 10,在此条件下红瓜子仁油提取率为75.68%。
2.3 红瓜子仁油挥发性成分
2.3.1 新鲜红瓜子仁油挥发性成分
按照1.2.3方法对水酶法提取的新鲜红瓜子仁油进行挥发性成分分析,结果见表4。由表4可知,红瓜子仁油中共鉴定出25 种挥发性风味物质,包括13种醛类、8种酮类、2种醇类、2种萜类,挥发性成分数量与大豆油、玉米油[18]相近。
2.3.2 不同贮藏时间下红瓜子仁油挥发性成分的指纹图谱
按照1.2.3方法对贮藏0 d和1年的红瓜子仁油进行挥发性成分分析(每个样品平行测定3次),并制作指纹图谱,结果如图5所示。图5中颜色越深表示挥发性成分的含量越高。
由图5可知,两种红瓜子仁油样品的挥发性物质含量存在明显差异。A区域物质在1号样品(HGZY-1,贮藏时间0 d)中含量最高,明显大于2号样品(HGZY-2,贮藏时间1年),可作为特征挥发性成分用于区分样品间差异的主要物质是 3-甲基-1-丁醇和3-羟基-2-丁酮;B区域物质在2号样品中的含量明显高于1号样品中的,主要为3-甲基丁醛、丁醛、戊醛、β-蒎烯、2-丁酮、丙酮、2-戊酮、E-2-庚烯醛、己醛、2-庚酮、庚醛、3-甲基-2-丁烯醛、2-辛酮和2-甲基丙烯醛等。上述结果说明贮藏时间对红瓜子仁油挥发性物质的含量有一定影响,可结合挥发性成分分析的相关技术进一步研究贮藏期间各挥发性成分的变化规律,为红瓜子仁油货架期预测提供参考。

图5 不同红瓜子仁油样品挥发性成分的指纹图谱
3 结 论
本研究通过单因素试验和正交试验,获得水酶法提取红瓜子仁油最佳工艺条件,即料液比1∶5、碱性蛋白酶添加量5%、酶解温度50℃、酶解时间3 h、pH 10,在此条件下红瓜子仁油提取率为75.68%。本研究过程中发现水酶法提取红瓜子仁油存在一定的乳化现象,如果能找到合适的方法破乳,将进一步提高油脂提取率。通过HS-GC-IMS技术鉴定出红瓜子仁油中主要的挥发性成分有25种,其中 3-羟基-2-丁酮和 3-甲基-1-丁醇可初步确定为新鲜红瓜子仁油挥发性成分的标志物。贮藏时间影响红瓜子仁油中挥发性物质的组成及含量,通过研究红瓜子仁油贮藏期间挥发性成分的变化规律,可以为预测红瓜子仁油货架期提供参考。
