生物标志物预测肝细胞癌患者抗PD-1/PD-L1治疗客观疗效的研究进展
2022-08-03柳利利张成仁郝相勇田宏伟邓渊李雄蒋智良郭天康
柳利利,张成仁,郝相勇,田宏伟,邓渊,李雄,蒋智良,郭天康
(1.甘肃中医药大学第一临床医学院,甘肃兰州 730030;2.甘肃省人民医院普通外科,甘肃兰州 730030;3.宁夏医科大学临床医学院,宁夏银川 750000)
2020年全球癌症统计报告[1]显示肝癌为全球六大常见癌症之一,在世界癌症相关病死率中居第3 位,每年约有90.6 万新发病例和83 万死亡病例。原发性肝癌主要为肝细胞癌(hepatocellular carcinoma,HCC)(占75%~85%),其主要危险因素包括病毒感染、吸烟、肥胖、大量饮酒、2 型糖尿病以及食用黄曲霉毒素污染的食物等[2]。随着医疗技术的进步,早期HCC 患者的生存率虽有所提高,但晚期肿瘤患者的5年生存率仍不足16%[3]。因此,众多的研究者致力于提高晚期HCC 患者生存率的研究,经过多年的临床实践发现晚期HCC 患者的生存率仅依靠单一的放化疗在当前阶段很难取得突破性的进展。随着肿瘤生物学和肿瘤免疫学基础理论的发展,肿瘤免疫治疗和化疗的联合使用在多种肿瘤中取得了较单一疗法更优的临床疗效。免疫治疗与化疗的联合不仅能逆转肿瘤晚期导致的免疫抑制,提高肿瘤抗原的交叉提呈作用,增强杀伤性T 细胞的抗肿瘤效应,还能一定程度上减少化疗带来的毒副作用以及降低肿瘤细胞耐药性[4-6]。
近年来,肿瘤免疫治疗研究较为深入的当属程序性细胞死亡受体1(programmed death 1,PD-1)及其配体(programmed cell death 1 ligand 1,PD-L1)。PD-1 是表达于免疫细胞上的表面蛋白,可为免疫反应提供抑制信号,当与肿瘤细胞上的配体PD-L1结合时可发生免疫抑制,从而使肿瘤细胞发生免疫逃逸。抗PD-1/PD-L1 治疗的基本机制是依靠免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)阻断PD-1 与PD-L1 的结合,恢复机体的抗肿瘤免疫,从而达到抗肿瘤效应[7-11]。然而,大量的临床试验发现大约只有10%~30%的HCC 患者才能在抗PD-1/PD-L1 的治疗中获益[12-13]。因此,精确筛选出抗PD-1/PD-L1 治疗的获益人群成为当前一大难题。生物标志物则是免疫治疗的重大突破,不仅可以筛选出免疫治疗的获益人群,还能够避免无效治疗及其毒副反应。因此,本文通过大量阅读近期文献,对HCC 患者抗PD-1/PD-L1 治疗下新近出现的生物标志物的研究现状做一综述,以期为临床诊疗提供帮助。
1 组织生物标志物
1.1 PD-1/PD-L1
PD-L1 也称为表面抗原分化簇274 或B7 同源体,是由CD274 基因编码的人类体内的一种蛋白质。一般来说,PD-L1 在肿瘤细胞中的表达水平越高,患者的生存预后越好,此观点已在多种肿瘤中得到证实[14]。Zhu 等[15]研究发现帕博利珠单抗(PD-1 单抗)治疗HCC 患者后,PD-L1 在多种类型细胞中的组合表达评分(combined proportion score,CPS) 阳性率≥1% 组的客观缓解率(objective response rate, ORR) 为25%, 无进展生存期(progression-free survival,PFS) 延长的病例比例高达83%,而单纯肿瘤表达评分(tumor proportion score,TPS)和治疗反应没有相关性。另有研究[16]对纳武利尤单抗(PD-1 单抗)治疗的HCC 患者进行免疫组化检测后发现,PD-L1 阳性率≥1%/TPS 组和PD-L1 阳性率<1%/TPS 组的中位总生存期(overall survival,OS)分别为28.1 个月和16.6 个月。此外,一项全球多中心试验[17]结果显示,替雷利珠单抗(PD-1 单抗) 治疗HCC 患者后PD-L1 阳性率≥1% 组ORR 达到23.1%,疾病控制率(disease control rate,DCR)达到57.7%。
然而,Liu 等[18]的研究却发现PD-L1 的表达与患者的OS 以及无病生存时间(disease free survival,DFS)呈负相关。一项I/II 期临床试验[19]中发现PDL1 阳性率<10%/TPS 组ORR 达到19%,DCR 达到63%,而在PD-L1 阳性率≥10%/TPS 组ORR 和DCR均为0。此外,有研究者[20]发现细胞缺氧可以刺激CXCL12 的基因表达,同时PD-L1 的表达也有所上升,该研究认为CXCL12 阴性以及PD-L1 高表达的HCC 患者肿瘤的预后可能不佳。表1 总结了近年来HCC 患者免疫治疗下以PD-1/PD-L1 作为生物标记物的研究。由于不同研究中PD-L1 的检测存在免疫组化评分的主观性、瘤内异质性、抗体多样性以及缺乏统一的临界值标准等问题,因而得出的结论也各不一致[21]。因此,在HCC 患者抗PD-1/PD-L1治疗中如何统计PD-1/PD-L1 的表达水平以及选择哪种检测方法、PD-1/PD-L1 阳性率的最佳截断值以及PD-L1 表达的异质性对其预测能力的影响等问题都是未来深入研究的重点[22]。
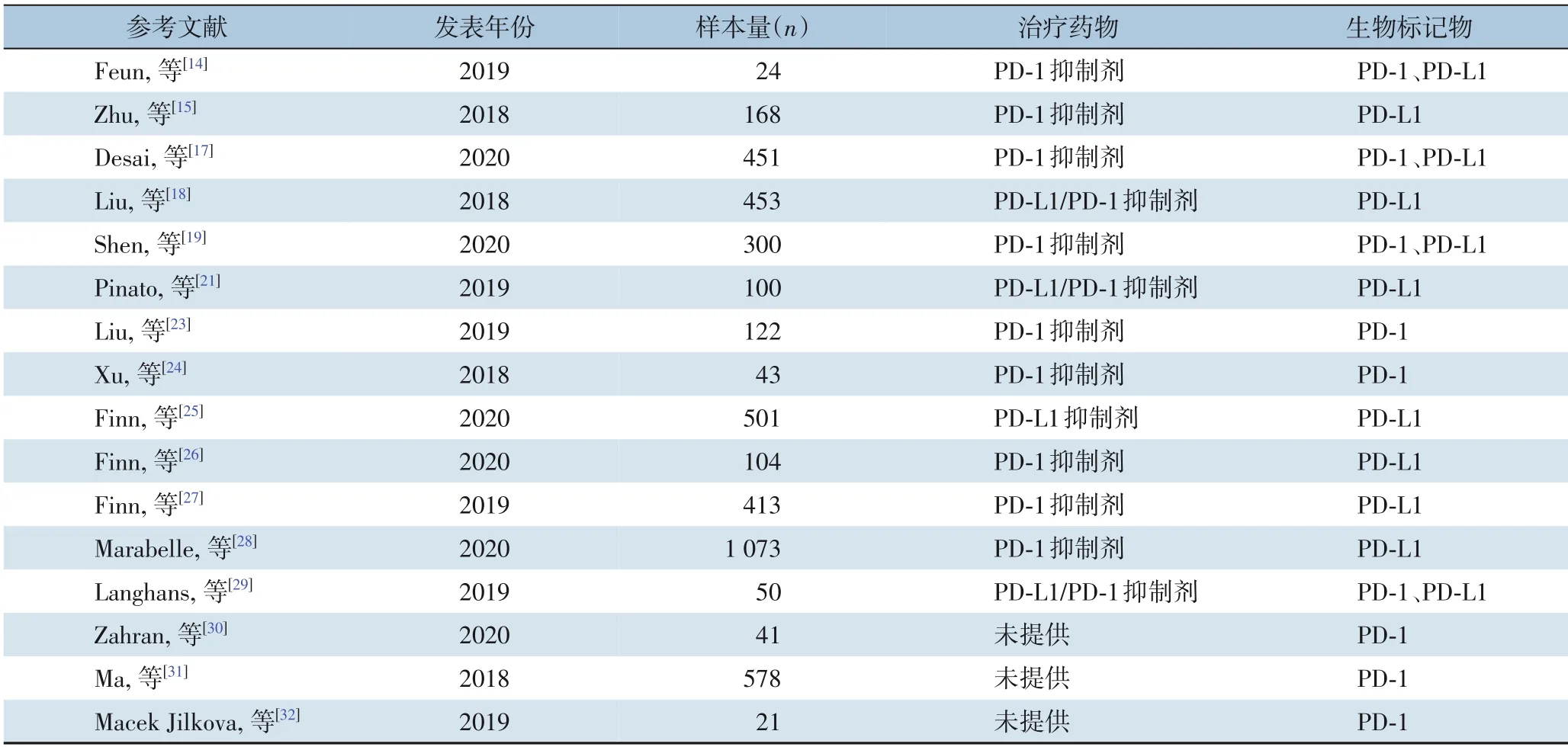
表1 PD-1/PD-L1预测HCC患者免疫治疗疗效的研究Table 1 Studies on the efficacy of immunotherapy for HCC patients predicted by PD-1/PD-L1
1.2 微卫星不稳定性(microsatellite instability,MSI)与错配修复功能缺陷(mismatch repair deficient,dMMR)
MSI 是指DNA 复制时插入或缺失突变引起的微卫星序列长度改变的现象,常由dMMR 引起[33]。MSI 现象于1993年在结直肠癌中首次发现,随着研究的深入,研究者发现MSI 现象不止存在于结直肠癌,在包括肝癌在内的其他实体瘤中均有发生[34-35]。一般来说,肿瘤细胞的MSI 表达水平越高,患者的总体生存越好,并且高微卫星不稳定性(microsatellite instability-high,MSI-H) 的肿瘤患者应用PD-1 抑制剂的应答率要优于低微卫星不稳定性(microsatellite instability-low,MSI-L)的肿瘤患者,这个观点已在多种肿瘤中被证实[36]。帕博利珠单抗目前已获批用于MSI-H/dMMR 的实体瘤,这也是美国食品药物管理局(Food and Drug Administration,FDA)首次基于分子标志物而非肿瘤组织来源批准的药物。因此,肿瘤患者的MSIH/dMMR 状态及其相关分子的变化对肿瘤的评估具有重要的意义。然而,有研究[37]却发现在HCC 中MSI-H 患者的比例仅占3.03%。因此,目前缺乏足够证据证明MSI-H/dMMR 在预测HCC 患者抗PD-1/PD-L1 治疗疗效中的地位。
1.3 肿瘤突变负荷(tumor mutational burden,TMB)
TMB 是指蛋白编码区非同义突变分布的密度。众所周知,肿瘤的发生是由于基因突变引起的,一般情况下人体的免疫系统可通过识别突变细胞表达的抗原从而对其进行清除,但部分肿瘤细胞由于肿瘤微环境的调节以及抗原的异常表达,导致机体无法识别这些抗原从而发生免疫逃逸,发生免疫逃逸的肿瘤细胞继续分裂生长则形成肿瘤[38]。目前TMB 专指蛋白编码区的非同义突变,因为只有突变的TMB 才有可能使肿瘤细胞产生新抗原。肿瘤患者的TMB 越高,新抗原的种类及数量越多,被免疫系统识别的概率越高,从而ICIs 激活机体自身的抗肿瘤免疫应答后,杀伤这些肿瘤细胞的概率就越大[39-40]。HCC 的TMB 相对于其他肿瘤基因组呈现出较高的水平,且有研究证实中国HCC 患者的TMB 强度在所有肿瘤中居第5 位,大约为30~150 mut/MB[41]。 此外, 欧洲肿瘤医学会(European Society for Medical Oncology, ESMO) 在2019年发布的一项共识[42]中推荐对实体瘤患者进行TMB 检测,但TMB 检测对肿瘤样本要求极高,检测周期漫长,价格颇为昂贵,且无统一的检测方法及其截断值。因此,TMB 用于预测HCC 患者的免疫治疗疗效仍有很长的路走。
1.4 拷贝数变异(copy number variation,CNV)
CNV 是由基因组发生重排而导致的,一般指长度1 kb 以上的基因组大片段的拷贝数增加或者减少,主要表现为亚显微水平的缺失和重复[43]。Pinyol 等[44]的研究发现抗PD-1/PD-L1 治疗过程中低负荷CNV 的HCC 患者肿瘤微环境中免疫细胞浸润水平以及炎性细胞反应水平相对更高,而高负荷CNV 的患者存在免疫排斥现象。因此,CNV 有潜力成为HCC 患者抗PD-1/PD-L1 治疗的预测性生物标志物。
1.5 懒氨酸甲基转移酶2D(KMT2D)
KMT2D 属于哺乳动物H3K4 甲基转移酶家族成员,在成人组织中广泛表达,对于早期胚胎的发育有着重要的作用,KMT2D 在调节细胞发育、分化、新陈代谢和肿瘤抑制方面具有重要作用,是癌症患者最常发生突变的基因之一,KMT2D 丢失导致DNA 损伤和突变增加、染色质重塑、内含子保留和转座因子激活[45]。有研究[46]发现KMT2D 突变的HCC 患者免疫浸润增加,KMT2D 突变可能通过增强肿瘤免疫原性使肿瘤细胞对ICIs 敏感性增加。
1.6 DNA 聚合酶ε(polymerase epsilon,POLE)和DNA聚合酶δ1(POLD1)
POLE 和POLD1 在维持DNA 复制保真度和防止突变方面至关重要。POLE/POLD1 突变是非常有潜力的免疫治疗的独立生物标志物,且不限癌种,与ICIs 的临床疗效密切相关[47]。Wang 等[10]研究结果发现在接受抗PD-1/PD-L1 治疗的实体瘤患者中,携带POLE/POLD1 突变的患者中位OS 显著优于未携带者(34 个月vs.18 个月)。该研究还发现那些通常认为无法获益于免疫治疗的微卫星稳定的患者如果伴随POLE/POLD1 基因突变也能获益于免疫治疗。因此,POLE/POLD1 突变可作为预测免疫治疗获益的全新独立指标。
2 循环生物标志物
2.1 循环肿瘤DNA(circulating tumor DNA,ctD‐NA)
液体活检不仅克服了组织活检的局限性,还为寻找HCC 患者免疫治疗疗效的预测性生物标志物提供了方向[48]。ctDNA 是一种特征性的肿瘤生物标志物,肿瘤细胞在进行分裂增殖过程中会凋亡或坏死破裂从而掉落DNA 片段,这些片段释放入血后使用一定的检测手段可以检测出来,这意味着可以通过检测ctDNA 来发现肿瘤的存在,对于肿瘤的早期诊断、用药方案的制定和预后观察都很有意义[49]。Jin 等[50]研究显示血液中存在和不存在ctDNA 的HCC 患者其中位PFS 分别为4.9 个月和7.4 个月。而在另一项随机对照试验[51]中,研究者发现ctDNA(+)的HCC 患者使用阿替利珠单抗(PD-L1 单抗)治疗后的DFS 和OS 优于ctDNA(-)的患者。虽然目前还没有任何一种以检测ctDNA 来诊断早期癌症的方法得到美国FDA 批准,但其未来的潜力值得期待。
2.2 肿瘤浸润淋巴细胞
肝脏是人体最大的免疫器官,长时间与外源性抗原发生应答,形成了复杂的免疫微环境[4,50]。既往多项研究[16,51]发现,淋巴细胞与HCC 患者抗PD-1/PD-L1 治疗后OS 成正相关。肿瘤免疫微环境中CD8+T 细胞的含量越高,HCC 患者抗PD-1/PD-L1治疗的效果越好[26,32,52]。Chen 等[53]研究发现HCC 患者抗PD-1/PD-L1 治疗后CD8+/CD4+T 细胞比率升高,并且ORR 较高的患者治疗前CD8+T 细胞的数量也更多。与此类似的一项研究[54]表明,使用PD-1 单抗治疗HCC 达到病情稳定的患者和治疗无效的患者相比,CD4+和CD8+T 细胞的聚集更高,提示CD4+和CD8+T 细胞高浸润的患者抗PD-1/PD-L1 治疗的反应更好。此外,Zhang 等[55]的研究发现PD-L1单抗联合紫杉醇治疗HCC 患者呈现高反应时,患者肿瘤微环境中CD8-CXCL13 和CD4-CXCL13 呈现出高表达,而对免疫治疗无反应的患者肿瘤微环境中几乎检测不到CXCL13+T 细胞,提示高基线水平的CD8-CXCL13 和CD4-CXCL13 对免疫治疗更加敏感。但肿瘤浸润淋巴细胞作为HCC 患者抗PD-1/PD-L1 治疗疗效的预测性生物标志物同样存在检测样本要求高、分析方法复杂、缺乏标准化的检测平台等问题,仍需继续研究。
2.3 嗜酸性粒细胞
目前嗜酸性粒细胞在肿瘤免疫微环境中的作用日益得到重视,并有研究[6]提示其变化水平可能与免疫治疗的疗效存在一定相关性。有研究[56]回顾性分析了抗PD-1 治疗的33 例晚期恶性实体肿瘤患者,结果显示在抗PD-1 治疗获得明显缓解的肿瘤患者中,治疗2 周期后外周血嗜酸性粒细胞的比例显著性升高,平均升高水平为基线的3.5 倍,嗜酸性粒细胞比例升高患者与非升高患者的中位PFS分别为12 个月和2 个月,中位OS 分别为15 个月和7 个月,提示嗜酸性粒细胞也有潜力成为HCC 患者抗PD-1 治疗疗效的预测性生物标志物。
2.4 外周血炎症指标
肿瘤的发生发展与炎症密切相关,炎症可促进癌细胞增殖、血管生成以及肿瘤侵袭,并且对一些抗癌药物的疗效也有一定程度的影响[57]。检测炎症因子有可能预测肿瘤的复发和预后,如中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、单核细胞与淋巴细胞比值(monocyte to lymphocyte ratio,MLR) 以及血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)等外周血炎症指标,很可能成为新一代重要的肿瘤生物标志物[58]。Qin 等[16]研究发现在接受PD-1 单抗治疗的HCC 患者中,NLR<5 的患者OS 明显改善。目前已有研究[59]证实MLR、NLR、PLR 在其他实体瘤(如胃癌,结直肠癌)中与患者的DCR 显著相关,并且MLR 是PFS 和OS 的独立影响因素。但目前关于上述炎症指标预测HCC 患者抗PD-1/PD-L1 治疗疗效的研究极少,需要后续加以验证。
3 其他的预测指标或方法
3.1 肠道微生物
肠道菌群是否会影响肝胆系统恶性肿瘤免疫治疗的应答目前没有统一的定论。Zheng 等[60]在研究中发现HCC 患者抗PD-1 治疗前的肠道菌群与健康人的基本一致,但经抗PD-1 治疗后大肠杆菌、肺炎克雷伯杆菌的数量显著增加,其他菌群也发生了明显变化。肠道微生物群的动态变化不仅可以对HCC 患者的免疫治疗进行早期预测,还对免疫治疗有一定的增效作用[61]。此外,有研究者[62]对65 例接受抗PD-1 治疗的晚期HCC 患者的肠道菌群进行研究,发现螺旋菌GAM79 以及拟杆菌富集的患者PFS 和OS 显著增加,而韦荣氏菌科富集的患者PFS 和OS 则较短。
3.2 预测模型
随着肿瘤免疫治疗逐渐趋于个体化,建立可以多方位评估患者疾病的预测模型是必然趋势,目前已有相关学者进行了此类的研究。Wang 等[63]通过分析TCGA 数据库免疫相关基因,构建了HCC免疫治疗的预测模型。 Zhang 等[64]以PDSS1、CDCA8 和SLC7A11 等缺氧相关基因构建出了HCC患者免疫治疗的预后、复发和诊断模型,该研究认为缺氧相关基因可以正向调节免疫反应,是HCC 诊断、预后和复发的潜在预测性生物标志物,可为患者的个性化治疗提供了免疫学视角。此外,有研究[65]以5 个内质网应激相关基因构建了预测HCC 患者免疫治疗的预后模型,该模型在HCC 患者的风险分层和总生存预测方面具有很高的临床应用潜力。
4 小结与展望
近年来,肿瘤免疫治疗的蓬勃发展加之精准诊疗的理念逐渐深入人心,为晚期HCC 患者带来了新的希望。本文综合以往的研究以及最新发现,选取了当前或未来阶段有潜力成为HCC 患者抗PD-1/PD-L1 治疗疗效的预测指标,以组织生物标志物 (PD-1/PD-L1、 MSI-H/dMMR、 TMB、 CNV、KMT2D、POLE/POLD1 突变)、循环生物标志物(ctDNA、肿瘤浸润淋巴细胞、嗜酸性粒细胞、外周血炎症指标)和其他预测指标或方法(肠道微生物、预测模型)进行分类阐述。但当前HCC 患者抗PD-1/PD-L1 治疗疗效预测和评价的多数研究尚未完善,并且缺乏标准化的生物标志物检测程序以及统一化的肿瘤疗效评价方法,极大地限制了众多有潜力的生物标志物的临床应用。因此,就目前阶段而言,尽管组织活检过程有创且复杂,并且也难以动态地监测,但其仍是不可缺少的一环。随着组学技术的迅速发展,未来多时间段的液体活检可能会成为主流。此外,单一生物标记物的敏感性和特异性不足,使其难以作为单独的生物标记物,多种生物标记物的联合可能更有利于预测HCC 患者免疫治疗的疗效。笔者认为,未来不仅需要大量的研究对上述生物标记物加以反复验证,还需要制定标准化的疗效评价策略,统一化的分子测量方法以及解决瘤内异质性和外部有效性等问题。此外,在人工智能迅速发展和医学理论以及技术不断成熟的背景下,开发更加精准的预测HCC 患者抗PD-1/PD-L1 治疗疗效的工具,对HCC 的个体化免疫治疗具有重要意义。
利益冲突:所有作者均声明不存在利益冲突。
