术中Sonazoid超声造影在特殊部位肝细胞癌经腹腔镜微波消融中的应用价值
2022-08-03段文斌薛蓉王子承杨建辉毛先海
段文斌,薛蓉,王子承,杨建辉,毛先海
(湖南省人民医院/湖南师范大学附属第一医院1.肝胆外科2.超声科,湖南长沙 410002)
微波消融(microwave ablation,MWA)被广泛应用于肝细胞癌(hepatocellular carcinoma,HCC)的治疗,在一些早期HCC 患者中可以获得与手术切除相类似的疗效[1-2]。超声具有简易、无创、可重复等多重优势[3],因而常用于MWA 术中的实时引导。部分MWA 可经皮完成,但特殊部位HCC 如肿瘤凸出肝脏表面,靠近膈肌、胆囊、胃、横结肠、心脏等脏器,经皮MWA 常存在困难和风险[4-5],该部分病例的消融治疗常选择通过腹腔镜完成。
然而,腹腔镜MWA 亦存在其局限性,对于小肝癌、等回声结节或合并肝硬化背景等,灰阶超声(gray-scale ultrasound,GSUS)常定位困难。而靶病灶的精准定位是保证消融完全的重要因素之一[6]。
近年来,超声造影常用于改善超声的可视性,在HCC 的MWA 治疗中起到了一定的引导作用[7-8]。但目前临床常用的造影剂如声诺维等增强时间窗较短暂,注射造影剂后5 min 左右即失去对比增强效果,其在HCC 消融术中的引导作用有限[9]。注射用全氟丁烷微球(Sonazoid)为第二代超声造影剂,于2019年在中国上市。相较于其他造影剂,Sonazoid 的优势在于其能被肝脏Kupffer 细胞摄取,在注射Sonazoid 约10 min 后进入其特有的肝实质特异期,亦称为枯否相(Kupffer phase),此期肝脏实质显像增强,而缺乏Kupffer 细胞的HCC 则呈低增强或增强缺失,提高了HCC 与肝实质的显影对比。且文献[10]报告枯否相可持续至少1 h,因此,Sonazoid 超声造影(contrast-enhanced ultrasound with Sonazoid,S-CEUS)理论上为靶病灶的定位提供了明确的依据,且为MWA 提供了充足的时间窗。
本文通过对比S-CEUS 与GSUS 针对特殊部位HCC 行腹腔镜MWA 时术中靶病灶的可视度差异,探讨S-CEUS 对于靶病灶的定位优势,同时通过观察枯否相引导MWA,分析S-CEUS 对于消融治疗的实时引导作用。
1 资料与方法
1.1 一般资料
连续选取2020年6月—2021年12月湖南省人民医院/湖南师范大学附属第一医院肝胆外科49 例不宜或不愿手术切除且肿瘤位于特殊部位考虑经皮MWA 存在困难的HCC 患者,其中男31 例,女18例;平均年龄(54.53±10.81)岁;49 例患者,术前增强MRI 共发现56 个靶病灶。
1.2 纳入及排除标准
纳入标准:⑴年龄>18 岁;⑵所有病例均符合HCC 的临床诊断标准,肿瘤直径<3 cm,肿瘤数目≤3 个;⑶靶病灶至少1 个位于特殊部位,如肿瘤凸出肝脏表面,靠近膈肌、胆囊、第一肝门区胆管和血管、胃、横结肠等脏器;⑷邻近器官无侵犯,无门静脉癌栓。排除标准:⑴肝外转移;⑵肝功能差不能耐受消融手术治疗;⑶伴随其他不能耐受手术的系统性疾病。医生术前与患者充分沟通,告知S-CEUS 的优缺点、对手术的价值及相应的并发症等,患者均签署手术知情同意书。本研究通过湖南省人民医院/湖南师范大学附属第一医院伦理委员会批准[伦理批复号:(2020)科研伦审第(101)号]。
1.3 靶病灶定位
患者全麻,术野消毒铺巾,于脐上做1 cm 切口,气腹针建立气腹,置入穿刺鞘及腹腔镜,根据靶病灶部位再于上腹分别穿刺置入2~3 个穿刺鞘,用于置入腔镜用超声探头及辅助器械。采用日立ARIETTA 60 型号超声诊断仪,选用UST-5418探头,频率2~13 MHz,造影谐波成像软件。GSUS扫描肝脏,对比术前MRI 观察能否准确定位靶病灶。再选取超声造影剂Sonazoid,使用前用2 mL 注射用水稀释混匀,用量0.015 mL/kg,经中心静脉或上肢外周静脉快速推注,推注后用5 mL 生理盐水冲洗静脉给药管路,确保造影剂完全注射。实时全程观察10 min 以上,分为动脉相(10~30 s)、门脉相(30~120 s)、枯否相(10 min 后),在注射造影剂同时启动超声仪计时器,快速扫描肝脏,观察肝脏实质灌注有无局限性异常显影的造影剂聚集区,发现病灶后存储扫描图并记录位置,与术前MRI 对比病灶的位置、大小,以及有无新病灶发现。同时存在两个或以上靶病灶的病例,在SCEUS 动脉相常难以同时观察到所有靶病灶,可在枯否相记录所有靶病灶位置后再重新造影观察各个靶病灶的各相表现。分别观察每个靶病灶在各时相的可视度差异,采用5 分信心量表[11]分别在GSUS 期、S-CEUS 动脉相、S-CEUS 枯否相对靶病灶的可视度进行评分:完全看不见,1 分;几乎看不见,2 分;勉强可见,可视度较差,3 分;可视度较好,4 分;清晰可见,5 分。于枯否相规划穿刺点及穿刺路径,体表标记。超声工作由临床医生和专门从事肝胆超声(造影)的超声科医生共同完成。
1.4 S-CEUS引导靶病灶活检及MWA
S-CEUS 实时引导下循规划路径行靶病灶穿刺活检。使用冷循环微波消融治疗仪(南京维京九洲医疗器械研发中心生产,许可证号:苏食药监械生产许20160024 号)在实时超声引导下沿规划路径,在枯否相将微波消融针插入靶病灶深面(图1),针尖定位在病灶的前端,启动冷循环系统,开始MWA,依据肿瘤直径设置消融工作功率为60~80 W,按瘤体形状采用单点或多点消融,消融范围超出肿瘤边缘0.5 cm,以达安全边界,若病灶紧邻横膈或大血管、胆囊、结肠等(<0.5 cm),无法获得0.5 cm 安全边界,但消融灶其他边缘均达到安全边界,可认为达到安全边界[12]。
1.5 消融效果评估
消融完成后15 min 再次S-CEUS 评估消融效果(图2)。造影显示原病灶区域无局部高增强灶,且非强化区覆盖肿瘤及其周边0.5 cm 视为消融完全,对于靠近包膜边缘、血管或胆囊等的肿瘤,非强化区至其边缘即视为消融完全[13]。若考虑消融不完全,再次消融直至术中即时评估消融完全。术后1 个月复查增强MRI 再次评估。
1.6 统计学处理
应用SPSS 20.0 进行数据分析,计量资料采用均值±标准差(±s)表示,GSUS 与S-CEUS 对靶病灶的可视度差异采用配对样本t检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 靶病灶定位情况
本组共49 例患者,术前MRI 发现肿瘤病灶56 个,术中S-CEUS 发现肿瘤病灶59 个,S-CEUS新发现3 个肿瘤。肿瘤大小(2.07±0.51)cm,所有靶病灶均通过穿刺活检证实为HCC。GSUS 期因肝硬化多结节的干扰而导致不可见的10 个靶病灶,有6 个靶病灶在S-CEUS 动脉相中可视度良好,10 个靶病灶在S-CEUS 枯否相中均可视度良好(图3)。GSUS 期因呈等回声而导致不可见的8 个靶病灶,有3 个靶病灶在S-CEUS 动脉相中可视度良好,7 个靶病灶在S-CEUS 枯否相中可视度良好(图4)。GSUS 期因≤1 cm 而导致不可见的4 个靶病灶,在S-CEUS 动脉相及枯否相中均可视度良好(图5)。S-CEUS 动脉相中因呈等增强而导致不可见的3 个靶病灶,2 个在CEUS 枯否相中可视度良好(图6)。各时相靶病灶可视性见表1。
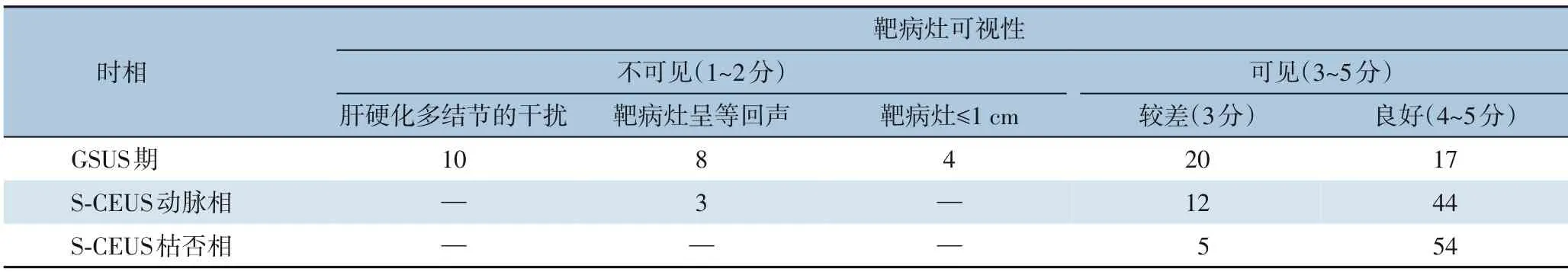
表1 各时相靶病灶可视性(n)Table 1 Visuality of the target lesion in each phase(n)
2.2 靶病灶的可视度比较
GSUS 期,靶病灶的可视度评分为2.86±0.96;S-CEUS 动脉相,靶病灶的可视度评分为3.90±0.78;S-CEUS 枯否相,靶病灶的可视度评分为4.25±0.60。S-CEUS 动脉相、枯否相对靶病灶的可视度评分均优于GSUS 期(图7),差异均有统计学意义(均P<0.001);S-CEUS 枯否相靶病灶的可视度评分优于动脉相,差异具有统计学意义(P<0.001)。
2.3 S-CEUS对于消融治疗的实时引导作用
术中靶病灶枯否相时间可持续1 h 以上(图8),所有靶病灶均在枯否相行MWA,术后15 min 即时S-CEUS 评估及术后1 个月行增强MRI 检查,均消融完全。
2.4 不良反应
1 例患者在推注造影剂后出现血压下降,考虑过敏反应,经积极抗过敏性休克处理后迅速恢复,无后续并发症及后遗症出现,其他患者未观察到不良反应发生。
3 讨 论
GSUS 因其简易、无创及可重复性等优点,常用于HCC 经腹腔镜MWA 的病灶定位及实时引导[14-15]。但在以下情况时,GSUS 定位靶病灶常存在困难:⑴存在肝硬化背景的肿瘤[6,16]:肝硬化背景下,肝脏常多发再生结节,这些结节的回声呈多样性,因此HCC 结节难以与周边的再生结节及发育不良结节区分。本组数据显示:16.95%(10/59)的靶病灶因肝硬化多发再生结节的干扰,GSUS 难以定位。⑵小肿瘤:小的HCC 在GSUS 时可能被遗漏[17]。Kim 等[16]统计有47.8%的直径≤1 cm 的HCC难以被GSUS 发现。本组数据显示,6.78%(4/59)的靶病灶因直径≤1cm,GSUS 难以定位。⑶等回声肿瘤[18]:部分HCC 结节呈等回声,与肝实质难以区分。本组数据显示,13.56% (8/59) 的靶病灶GSUS 期呈等回声,因而定位困难。
靶病灶定位困难,有可能导致消融不完全或异位消融[16]。超声造影因增加了病灶与周边肝实质的显影对比,改善了病灶在超声下的可视性,可提高靶病灶定位的精准性[7-8]。但目前临床常用的造影剂如声诺维等增强时间窗较短暂,注射造影剂后5 min 左右即失去对比增强效果,既不能满足多病灶患者的多次定位需要,也不能提供消融治疗时布针所需要的时间窗,因此其在HCC 消融治疗中的作用有限[9]。
S-CEUS 能较好地克服上述缺陷。HCC 在SCEUS 动脉相和门静脉相的显像与其他二代造影剂类似,但在注射Sonazoid 约10 min 后即进入其特有的枯否相[19],正常肝脏组织因Kupffer 细胞摄取Sonazoid 而表现为高增强,而HCC 因缺乏Kupffer 细胞则表现为低增强或增强缺失,亦称为“洗出”。肿瘤在枯否相的洗出效应提高了其在超声下的可视性。
多项研究[3,11,20-21]表明:S-CEUS 动脉相、枯否相对HCC 的可视度优于GSUS,差异具有统计学意义,与本研究结果相符。
S-CEUS 枯否相可持续1 h 以上[22],为靶病灶的定位和治疗提供了宽裕的时间窗,便于反复扫描及MWA 的实时引导、监测[4]。对于同一病例的多个肿瘤病灶,1 次造影剂注射即可满足多个病灶的显影和治疗需求,本组术前已知多个病灶的患者均只注射1 次造影剂即完成所有病灶的定位和MWA。同时,研究[3,23-25]表明,相较于动脉相,枯否相肝实质与HCC 的增强强度差异性更显著,枯否相尤其有助于消融治疗的穿刺引导。本研究亦显示,动脉相、枯否相靶病灶的可视性均优于GSUS 期,枯否相靶病灶的可视度优于动脉相。本组所有患者的消融布针、治疗均在枯否相引导完成,靶病灶显影良好。
同时,国内学者顾炯辉等[25]研究认为,基于枯否相的时间优势,Sonazoid 的使用有望提高肝脏隐匿性病灶的检出。本组数据中,S-CEUS 共发现了3 个术前影像学检查未发现的肿瘤病灶。相较于CT 或MRI 的间歇断层扫描成像,S-CEUS 的最大优势在于实时动态扫描,可以反复多次扫描肝脏。持续时间达1 h 以上的枯否相为反复扫描提供了充裕的时间窗,同时枯否相HCC 特征性的洗出效应也为隐匿性病灶的良恶性鉴别提供了依据。对于枯否相新发现的呈低或无增强的病灶,可通过造影剂再灌注成像的方式,进一步判断新检出的结节是否为HCC[26]。
消融后术中即时效果评估是肿瘤消融完全的重要保障,MWA 后再次注射Sonazoid 可观察肿瘤病灶是否消融完全[24,27-29]。无论是否消融,病灶在枯否相均表现为低或无增强,因此评估消融效果需再次注射造影剂,动脉相观察病灶区域有无局部高增强灶,以判断肿瘤是否消融完全。本组患者均在术中即时行消融效果评估,考虑消融不完全者均再次消融直至术中即时评估消融完全。术后1 个月复查增强MRI,原肿瘤区域均显示无活性。
Sonazoid 造影剂耐受性良好,不良反应多较轻[30]。Chou 等[31]统计54 例使用Sonazoid 的患者,无严重不良反应发生,最常见的不良反应为腹痛(9.3%),其次是心率不规则(5.6%),除1 例严重腹痛持续15 min 外,其他所有患者不良反应均是短暂且可耐受的,无需医疗干预。本组患者因均在气管插管全麻后注射造影剂,无法记录患者自觉症状,心电监护未显示心律失常等不良反应。1 例患者注射Sonazoid 后即出现休克表现, 考虑Sonazoid 过敏可能性大,予抗休克处理后迅速缓解。因Sonazoid 氢化卵磷脂酰丝氨酸外壳的存在,对蛋类和蛋类制品过敏的患者需谨慎使用[23],本例患者无相关过敏史。
综上所述,针对特殊部位HCC 的腹腔镜下MWA,靶病灶在S-CEUS 动脉相、枯否相的可视度均优于GSUS,有利于靶病灶的定位;持续时间达1 h 以上的枯否相有利于反复扫描及MWA 的实时引导,同时有可能发现术前影像学未能发现的隐匿性小病灶。但本研究缺少与其他超声造影剂的随机对照,且因样本数相对较少,部分结论可能存在偏差,尚待进一步的临床数据积累。
利益冲突:所有作者均声明不存在利益冲突。
