可切除肝细胞癌合并门静脉癌栓的外科治疗
2022-08-03李留峥张世荣陆顺李波赵海荣敖强高学昌龚国茶俸家伟徐雷升王雪
李留峥,张世荣,陆顺,李波,赵海荣,敖强,高学昌,龚国茶,俸家伟,徐雷升,王雪
(云南省临沧市人民医院1.肝胆外科2.介入科,云南临沧 677000)
肝细胞癌(hepatocellular carcinoma,HCC) 合并门静脉癌栓(portal vein tumor thrombus,PVTT),预示患者病程已属中晚期,如果放弃治疗,中位生存期仅2.7 个月[1]。PVTT 是影响HCC 预后的重要因素,已成为肝脏外科临床研究的重点。国际上对于HCC 合并PVTT 的诊治标准仍未达成共识,目前,欧美等国家根据巴塞罗那肝癌分期(BCLC),肝癌合并PVTT 患者被划分为晚期(BCLC C 期),指南[2-3]推荐行口服索拉非尼等分子靶向药物治疗,不建议对HCC 合并PVTT 患者行手术治疗,但东南亚包括我国在内的专家,认为外科手术、肝动脉化疗栓塞术(TACE)、放疗以及联合多种系统治疗手段的综合治疗可获得更为满意的疗效。亚太HCC 临床实践指南[4]推荐对部分类型的PVTT 患者,手术仍然视为是一种潜在且有效的选择性治疗方法。中国肝细胞癌合并门静脉癌栓诊疗指南(2021年版)[5]推荐采用手术切除和TACE 等方案治疗并发PVTT 的HCC,最大可能去除或控制肝癌原发病灶及PVTT,强调通过联合多学科的综合治疗手段,延长生存期和改善生活质量。目前,手术切除和TACE 已被推荐为并发PVTT 的HCC 的有效选择,且被外科医生广为接受。本文回顾性分析了手术切除与TACE 两种方法治疗可切除HCC 合并PVTT 患者的预后差异,旨在为此类患者的治疗提供循证医学证据,为临床医生选择合适的治疗方式提供一定的参考。
1 资料与方法
1.1 一般资料
回顾性分析云南省临沧市人民医院2016年3月—2021年3月收治的39 例可切除HCC 合并PVTT 患者的临床资料,其中男28 例,女11 例;平均年龄56.2 岁;病程3~7 个月。36 例表现为上腹部不适,乏力、纳差和体质量下降等。纳入标准:⑴肝脏增强CT、MRI 等影像学检查或术后病理诊断为HCC 伴PVTT;⑵首次接受治疗的HCC 患者;⑶肝功能Child A 级或短期治疗后由Child B 级转为Child A 级;⑷术前患者心肺功能及全身状况评估可承受大范围肝切除术;⑸肿瘤单个或多个,但局限在半肝或不大于3 叶,无肝外转移的肝原发肿瘤同癌栓可整块切除或经门静脉残端或切开主干能取尽癌栓;⑹经医院伦理管理委员会批准(伦急审2015020),患者同意并签署知情同意书。排除标准:⑴HCC 复发再次手术者;⑵肝功能Child C 级;⑶远处转移或有其他肿瘤病史者;⑷肝静脉或胆管癌栓者。39 例患者中,23 例行外科手术治疗(手术组),16 例行TACE 治疗(TACE 组),两组患者平均年龄、性别、Child-Pugh 分级、肿瘤大小等方面差异均无统计学意义(均P>0.05),PVTT 程氏分型[6](I 型,癌栓侵犯肝叶或肝段的门静脉分支;II 型,癌栓侵犯至门静脉左支或右支;III 型,癌栓侵犯至门静脉主干;IV 型,癌栓侵犯至肠系膜上静脉;术后病理学诊断微血管癌栓为I0 型)中I、II 型所占比例组间均差异有统计学意义(均P<0.05),III 型占比组间差异无统计学意义(P=0.82)(表1)。
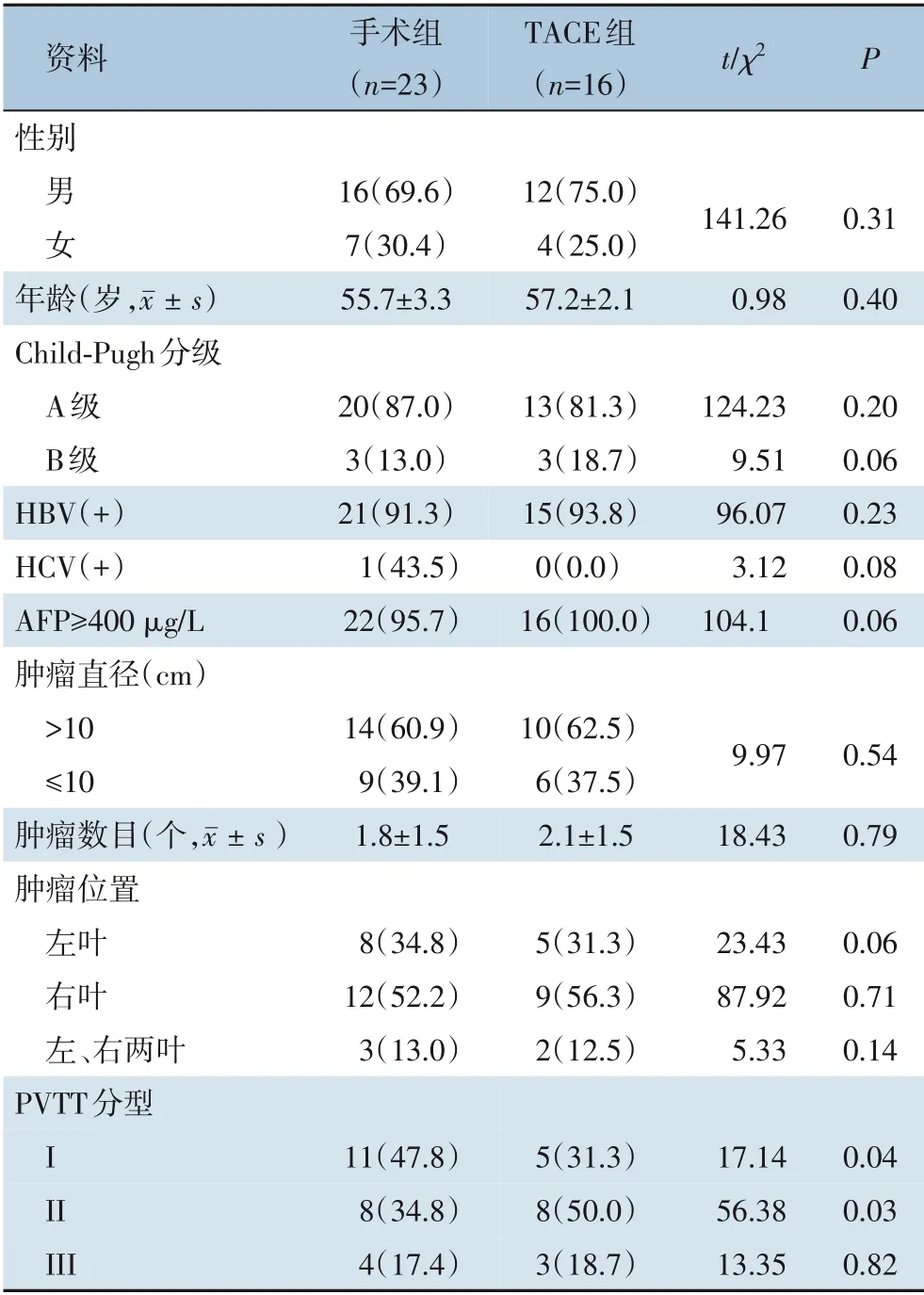
表1 两组一般资料比较Table 1 Comparison of the general data between the two groups
1.2 PVTT的诊断、治疗规划
39 例患者常规行B 超、增强CT 或MRI 检查,依据影像学资料评估肿瘤侵犯程度。肝脏B 超显示门静脉内充满或部分填充性占位,多呈低回声,显示占位性病变内血流成动脉样频谱。增强CT 提示门静脉内有低密度充盈缺损及动静脉瘘,受侵门静脉支扩张表现等。MRI 提示门静脉占位性病变,T1 像呈等或低信号,T2 像呈高信号。根据上述典型影像学表现,结合肝硬化以及HBV 感染证据,可明确诊断PVTT。尤其手术患者术中可见有门静脉及其分支癌栓。完善肝脏增强CT 或MRI 三期扫描行三维可视化系统成像,评估肿瘤大小、部位、数目,明确肿瘤血供与血管、胆管的关系及变异,判断门静脉侵犯范围及程度。测定残肝体积及残肝比以及吲哚菁绿15 min 潴留率(ICGR15),术前精确评估肝脏储备功能、虚拟切除手术规划及预定手术切除范围。手术组术中超声再次检查肿瘤的侵犯程度及有无肝内转移,与血管的毗邻解剖关系,明确门静脉癌栓范围及分型,确定无瘤切肝平面及切缘宽度,最后排除癌栓残留。所有患者治疗前充分评估,根据患者的一般身体状况,合理规划治疗方式。
1.3 手术治疗
PVTT 的处理:术中结合术前影像学资料、术中B 超或荧光显像技术确定肿瘤的部位和门静脉癌栓的范围,以及肝病或肝硬化的严重程度,决定肝切除的方式:⑴肝病或肝硬化严重程度较轻,预计剩余肝脏能够基本满足机体需要时实施解剖性肝段或肝段联合切除、半肝切除或扩大半肝切除,包括癌栓在内整块病肝切除术;⑵肝硬化较为严重,机体难以承受大范围肝切除时,选择肿瘤所在的肝段切除+邻近门静脉支癌栓取出术;⑶门静脉主干的癌栓,预先结扎或阻断荷瘤侧门静脉,经门静脉左、右干断端取栓,困难时行门静脉切开取栓术或门静脉切除置换。手术顺序按“癌栓优先”切除法,II 型先行结扎离断荷瘤侧门静脉支,III 型患者则需行门静脉主干切开取净癌栓后再行肝肿瘤切除术(图1)。
1.4 TACE治疗
在CT 引导下行肝主瘤穿刺活检,明胶海绵封闭针道,快速冷冻切片,明确HCC 的病理诊断。采用Seldinger 技术穿刺右股动脉,置入5-F 动脉短鞘。沿鞘送入导丝及5-F cobra 导管,将导管送入肠系膜上动脉间接门脉造影。将RH 导管插入肝动脉造影,判断肿瘤的部位、大小及数目后超选肝动脉分支注入氟尿嘧啶、盐酸吡柔比星、奥沙利铂三联化疗药物及碘化油,通过导管灌注到肿瘤滋养动脉,同时应用Embosphere 微粒或明胶海绵球栓塞肿瘤滋养血管。术后予以常规抑酸、保肝等对症治疗。化疗间隔周期通常为3~4 周,视复查情况再次化疗(图2)。
1.5 统计学处理
采用SPSS 22.0 软件对数据进行统计分析,两组治疗相关指标比较采用t检验,术后随访采用χ2检验,生存分析采用Kaplan-Meier 法和Log-rank 检验。多因素分析使用Cox 比例风险回归模型。P<0.05 为差异有统计学意义。
2 结 果
2.1 治疗情况
手术组1 例因术中发现肿瘤广泛侵犯,仅取材活检,其余均完成手术,无手术死亡。23 例患者术中均行快速冷冻病理学检查,19 例示切缘阴性。2 例术后肝功能不全,经人工肝及其他支持治疗痊愈出院。TACE 组16 例肝动脉超选、灌注、栓塞顺利,1 例因肝动脉完全栓塞,术后3 d 因急性肝衰竭救治无效死亡。手术组8 例术后辅助TACE 治疗,5 例靶向治疗,其中1 例I 型患者手术后联合TACE等治疗后仍生存47 个月。TACE 组13 例多次治疗,4 例给靶向药物,其中1 例II 型患者TACE 术后经过7 次灌注化疗及栓塞后仍生存25 个月。两组住院时间、医疗成本、术后行TACE 的例数、术后未做其他治疗的例数以及术后AFP 恢复正常的例数差异均有统计学意义(均P<0.05)(表2)。

表2 患者治疗及术后情况Table 2 Treatment results and postoperative conditions of patients
2.2 随访情况
38 例患者术后通过电话询问和门诊复查获得随访,随访时间为1~47 个月,中位随访时间18.1 个月,随访截止日期为2022年2月28日,中途失访5 例。至随访截止日期,手术组和TACE 组患者因肿瘤、PVTT 复发或肝内外多发转移分别死亡12 例与10 例,带瘤生存6 例与3 例,无瘤生存2 例与0 例,手术组与TACE 组的中位生存期分别为16.2 个月与9.5 个月;0.5、1、2、3年生存率分别为65.2%、 43.5%、 34.8%、 17.4% 与46.7%、33.3.0%、13.3%、0。两组患者中位生存期与累积生存率差异均有统计学意义(均P<0.05)(图3)。
2.3 影响患者预后的因素
单因素分析结果表明,PVTT 分型、AFP 水平、肿瘤大小、肿瘤数目与患者术后生存时间有关(均P<0.05)。多因素分析提示,治疗方式、PVTT分型、肿瘤直径、AFP 水平是患者术后生存时间的独立影响因素(均P<0.05)。AFP<400 ng/mL、肿瘤直径≤10 cm、手术切除、I 型癌栓的患者预后较好(表3)。
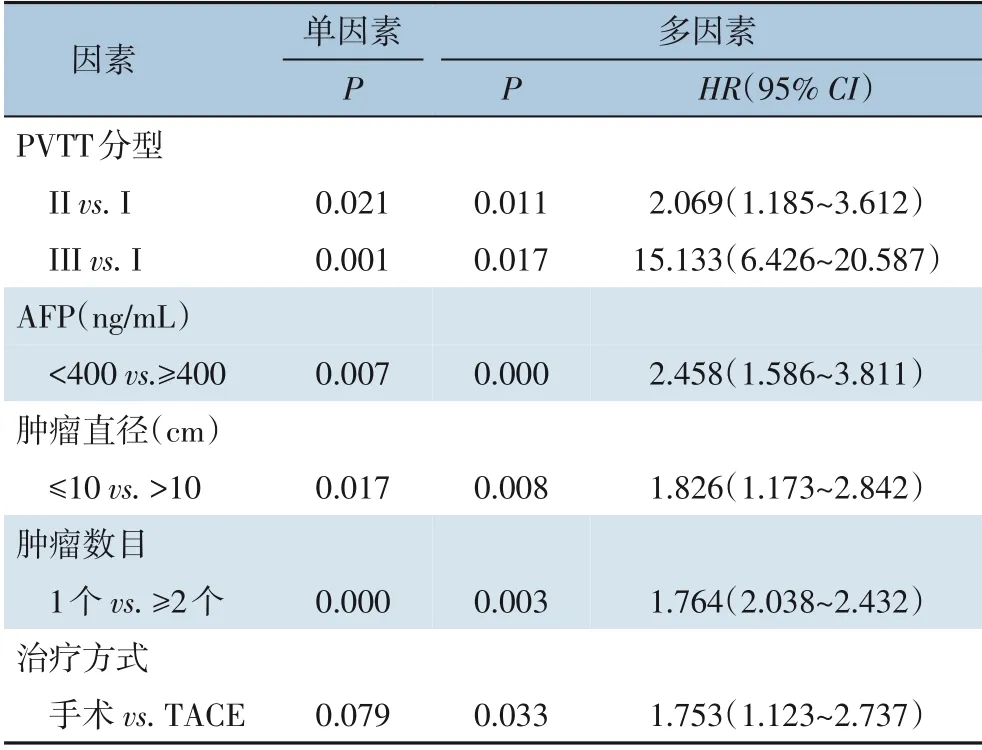
表3 单因素及多因素分析结果Table 3 Results of univariate and multivariate analysis
3 讨 论
HCC 合并PVTT,临床上有多种治疗选择,包括肝切除术、TACE、放射治疗和索拉非尼等[7]。但即使在根治性切除术后,由于肿瘤复发率高,与PVTT 相关的多数HCC 患者预后仍然不理想[8]。目前美国肝病协会(AASLD)指南和BCLC 分期对于合并PVTT 的HCC 患者均不作深层分型,靶向药物索拉非尼是唯一推荐的治疗策略,但疗效并不满意,中位生存期仅为8 个月左右[9]。但我国及东南亚国家与西方国家患者在HCC 的病因学、生物学特性、对靶向药物治疗反应等方面存在一定的异质性,相对于分子靶向药物及其他非手术治疗而言,手术治疗仍然可以改善部分PVTT 患者预后。不少学者尝试对PVTT 实施外科手术、TACE 等积极的综合治疗,并使少数患者获益[10]。以手术侧重的综合治疗,较非手术治疗方案,其5年存活率可提高20%以上[11-12]。有研究[13]结果表明,在I 型或II 型PVTT 患者中,手术切除的中位生存期显著高于其他治疗方法,TACE 对III 型患者的预后优于手术治疗,手术、TACE、索拉非尼对IV 型患者治疗效果均差。故涉及PVTT 的最佳治疗方式的选择主要取决于PVTT 的类型,并成为决定预后的关键因素。
3.1 PVTT治疗方式的选择
亚太HCC 临床实践指南[4]认为,在保证肿瘤可切除,主门静脉通畅的前提下,手术治疗是可选方案。日本肝细胞癌临床实践指南(2019 版)[14]推荐手术和TACE 适合Vp 分型Vp1、Vp2 型的患者,而Vp3、Vp4 型手术效果不佳,主张综合治疗为主。尽管合并PVTT 的HCC 属于局限晚期,但部分患者通过积极的肿瘤切除及取栓术,可显著改善门静脉高压及减少棘手的顽固性腹水、出血等相关并发症,改善肝功能,减轻肿瘤负荷,降低肝内及远处转移的风险,为进一步治疗赢得时机。肝细胞癌合并门静脉癌栓多学科诊治中国专家共识(2018年版)[6]推荐,HCC 合并PVTT 的治疗应以肝功能良好为基础,评估主瘤情况和PVTT 分型,首次治疗选择尽可能去除或控制肝癌原发病灶及PVTT 的方法,强调通过联合多学科的综合治疗手段,延长生存期和改善生活质量。
对可切除HCC 合并PVTT 患者治疗方式的选择,结合文献[5,15-16],笔者体会:⑴首先评估肝肿瘤是否可切除、确定PVTT 类型及肝功能状态。肝功能ChIld-Pugh A 级,原发灶可切除的PVTT I/II 型患者首选手术治疗。部分全身营养状况欠佳,残余功能性肝体积难于代偿,不能耐受或不愿意接受手术患者,则推荐TACE 治疗;⑵原发灶可切除的PVTT III 型患者应根据癌栓情况选择手术、TACE 或降期后再手术切除,强调术后TACE、放疗及靶向治疗的重要性,同时术者单位需具备PVTT III 型手术的技术条件和经验;⑶注重个体化精准治疗的原则。手术治疗较TACE 而言难度及风险较大,对手术者的技术、经验及相关设备要求较高,如果不能做到原发灶R0切除,则手术治疗未必使患者太多受益,故治疗方式的选择应使患者获得充分的知情权,根据患者对疾病的认知程度、经济状况以及术者单位的技术储备,注重个体化的原则,慎重选择治疗手段,切忌侧重于术者的偏好,刻意夸大手术或TACE 效果而过分诱导患者作倾向性治疗;⑷PVTT 的治疗无论采取何种方式,都应以延长患者的总体生存期,控制治疗并发症最小化为目的。肝移植、全身治疗、放射治疗、肝脏导向治疗和门静脉灌注化疗等,都成为了PVTT 治疗方式的选择,并改善了部分患者的预后[17-20]。有报道[21]显示,PVTT I 型HCC 肝移植的预后优于手术切除,尤其是AFP 水平>200 ng/mL 的患者。根据患者的肝功能、原发灶大小、PVTT 分型决定治疗方案,手术、TACE、放疗、化疗、靶向药物等均应处于治疗选择的平等地位,重视利于PVTT 患者个体化、精准化治疗的需求,并非完全以手术为主,而应结合综合治疗策略[22]。本研究32 例I/II 型PVTT 患者中,19 例接受手术治疗,13 例选择TACE,即使是确切的可切除PVTT,部分患者仍然不愿意接受手术治疗,倾向于侵袭较小、费用更低的TACE 治疗途径。
3.2 手术治疗PVTT的价值
对I/II 型患者而言,癌栓位于规划的肝切除范围之内,选择以门静脉解剖结构为基础的手术治疗,切除肿瘤的同时一并清除门静脉癌栓,处理相对容易,其治疗方式可能是合理的,并在可接受的复发率下提供了潜在的生存益处[23]。尤其是>5 cm 的孤立性HCC 伴I/II 型PVTT 患者,TACE 的治疗应答反应很差,预后不佳,需要积极手术切除及联合治疗[24]。而对于累及门静脉主干的III 型癌栓,手术需要掌握包括癌栓摘除和联合血管切除重建技术,手术难度及风险较大。虽然从技术层面来说手术切除这类癌栓是可行的,但因术后高复发率,生存期短,其手术价值颇受质疑,对此类患者应充分考虑患者的年龄、经济支付能力等因素,权衡手术的利弊,慎重选择。一项前瞻性研究[25]的结果,56 例手术的Vp3/4 PVTT 患者的中位生存时间为14.5 个月;1、3年总生存率分别为59.6%和16.8%。R0/1和R2肝切除患者的中位生存分别为14.3 和14.9 个月(P=0.383 1)。所有评估的肿瘤因素[Vp 分型(Vp3 或Vp4)、切除类型(R0/1或R2)、肝内肿瘤大小、肝内肿瘤数量和肝外转移的存在]均未显著影响总生存率,提示肝切除术是治疗HCC 合并Vp3/4 PVTT 的有效方法。PVTT III 型切除,癌栓的摘除是手术的难点,笔者的经验是:术中B 超检查,明确癌栓分布范围,重视“癌栓优先”原则,术中尽量避免对PVTT 的挤压导致癌栓播散。充分游离门静脉主干和左右侧分支,分别预置阻断带,阻断门静脉主干和健侧分支后,近左右支的分叉处小切口切开门静脉主干用取石钳取栓,同时吸引器头插入门静脉腔内辅助吸取,癌栓取净后用肝素盐水冲洗管腔,短暂开放门静脉近端主干,血流汹涌喷出冲刷残余的癌栓组织,缝合门静脉。若癌栓附壁剥离困难,则切除或置换受累门静脉段。术毕超声再次检查门静脉主干及分支,排外癌栓残留。门静脉阻断带,笔者选择8-F 小儿气囊导尿管剪除根部,远端穿过侧孔,方便门静脉松紧及牵拉,阻断效果佳。本组4 例PVTT III 型手术均顺利取净。有研究[26]表明,肝切除前先行取栓术可以减少因癌栓引起的新的肝内转移到残肝,有利于III 型和IV 型PVTT 得到更好的预后。总之,PVTT III 型手术需要术者具备丰富的肝脏手术经验,确保患者手术安全方可施行,不然必将出现癌栓脱落转移或大出血造成灾难性的后果。
3.3 TACE治疗PVTT的优势
对于可切除但手术风险过大,或失去手术机会以及不愿意接受手术的PVTT 患者,以TACE 为主的综合治疗被认为是安全、有效的治疗方法[27]。TACE 通过碘化油、弹簧圈、微球等栓塞肿瘤滋养血管阻止其生长,同时注入化疗药物杀伤或抑制肿瘤细胞。对于肝储备功能良好、门静脉形成足够侧支循环的患者,TACE 是可行的,并且TACE与保守治疗患者相比,TACE 患者生存期明显提高。本组资料提示,TACE 治疗组住院时间、医疗成本与手术组有显著性差异,有一定的经济效益优势,但TACE 不能完全阻断来自门静脉的营养血管,难以完全实现肿瘤坏死,影响其治疗效果。而多次重复治疗,也导致肝功能损害加重。目前更多的证据[28-30]表明,TACE+索拉非尼、TACE+I125粒子植入、TACE+立体放射治疗等方式,其生存结果明显优于单纯TACE,成为更优良有效的治疗方法。也有小样本的研究[31]证实,接受TACE 联合射频消融(RFA)治疗的晚期HCC 患者,累计生存时间明显优于单独TACE 治疗。本组16 例患者完成TACE 术,但1 例因肝动脉完全栓塞,肝储备功能不足,术后3 d 急性肝衰竭救治无效死亡。手术组8 例术后辅助TACE 治疗,5 例靶向治疗,其中1 例I 型患者手术后联合TACE 等治疗生存47 个月。TACE 组13 例多次治疗,4 例给靶向药物,其中1 例II 型患者TACE 术后经过7 次灌注化疗及栓塞仍然生存25 个月,获得了令人鼓舞的结局,但III 型患者的TACE 预后依然较差,关注靶向治疗仍然是不可或缺的环节。
目前更多学者倾向认为,I/II 型癌栓因其根治性切除的可能性更大,手术切除效果优于III 型癌栓及TACE 治疗者,但是手术也未必带来显著生存获益。尽管总体上PVTT 治疗预后较差,但仍有少数I/II 型癌栓患者R0切除联合后续的TACE 或再次切除以及靶向、免疫等综合治疗而有机会获得长期的生存。本研究结果显示,无论手术或TACE 治疗,I 型PVTT 患者中位生存明显优于III 型患者,手术治疗优于TACE,而且与AFP 水平、肿瘤直径、数目等密切相关,极少数分型较好的患者可获得长期的生存,与相关报道[32-34]一致。对III 型患者,无论手术或TACE 治疗效果均差,目前仍然缺少大样本随机对照研究等更高级别的循证医学证据来支持手术治疗,患者能否获益存在较大争议。HCC 合并PVTT 的患者需要注重多模式、多学科团队提供最佳的治疗方案,同时大量客观随机对照试验证据的支持更为迫切。
本研究仍然存在缺陷:⑴研究样本较少,为回顾性分析,存在信息偏移,所得出的结论有一定片面性,仍需要样本量大、多中心的前瞻性随机对照研究来进一步验证研究结论;⑵部分手术患者术后辅助TACE 治疗及靶向治疗,有可能存在选择性偏差,影响结局及研究结论;⑶TACE 治疗无法获得肿瘤的微血管侵犯情况及准确的分型;⑷本研究主要比较两种治疗方式对患者的生存获益情况,对肿瘤复发的原因分析较少。随着PVTT发病机制的阐明,新型靶向药物应用,中医中药辨证论治,多学科多模式治疗PVTT 必将受到更多的关注和重视,以期提高治疗效果,降低复发率。
利益冲突:所有作者均声明不存在利益冲突。
