白细胞介素4 诱导蛋白1 促进肾癌进展的实验研究
2022-08-02魏诗瑶来佳丹李常颖
魏诗瑶,来佳丹,李常颖
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津 300211)
迄今为止癌症仍然是发病率和致死率最高的疾病之一,寻求有效的、新的治疗途径也一直是研究热点。近些年发现,肿瘤与机体代谢之间存在密切联系,氨基酸代谢酶可能在肿瘤发生、发展中发挥重要作用,诸如吲哚胺-2,3-双加氧酶(IDO)、精氨酸酶1(Arg1)及诱导型一氧化氮合酶(iNOS),而白细胞介素4 诱导蛋白1(IL4I1)可能是一个新的、有潜力的免疫检查点。
IL4I1 编码一种分泌性的氨基酸代谢酶,参与苯丙氨酸、精氨酸和色氨酸的代谢[1-2]。因最初在B细胞上被白细胞介素4(IL-4)诱导表达而得名,其编码基因位于人染色体19q13.33 位置。研究发现,IL4I1 在抗原呈递细胞及肿瘤相关性巨噬细胞中高表达,能够以分泌的形式作用于免疫突触位置,抑制T 细胞的活化增殖和功能,促进调节性T 细胞(Treg)和M2 巨噬细胞的分化,以及免疫抑制细胞的募集[3]。目前对IL4I1 的研究多集中于黑色素瘤及胶质瘤,而IL4I1 在肾癌中的表达情况及其功能尚不明确。
肾透明细胞癌是肾癌中最常见的类型,本研究通过数据库分析了IL4I1 在肾透明细胞癌中的表达及其与预后之间的关系,探讨IL4I1 的表达对于肾透明细胞癌细胞生物学功能的影响,并探究了IL4I1 影响肿瘤发生、发展的潜在信号通路。
1 材料与方法
1.1 数据库分析 通过在线数据库UALCAN(http://ualcan.path.uab.edu/index.html)和Kaplan-Meier 生存分析(https://www. kmplot. com/analysis/index.php)分析IL4I1 在正常肾组织及肾透明细胞癌组织中的表达及与预后的关系。
1.2 细胞系与主要试剂 人肾癌细胞系786-O、769-P 及人肾近曲小管细胞HK-2(American Type Culture Collection),胎牛血清(Biological Industries),RPMI-1640、DMEM-F12 细胞培养基(源培生物),青链霉素混合液(索莱宝),Trizol(ThermoFisher Sci entific),反转录试剂盒(ThermoFisher Scientific),FastStart Universal SYBR Green Master(Roche),PCR 引物(生工生物),重组Anti-IL4I1/LAO 抗体(Abcam,ab222102),siRNA 合成(吉玛基因),opti-MEM 培养基(Gibco),X-tremeGENE siRNA 转染试剂(Roche),山羊抗兔IgG H&L(FITC)(Abcam,ab6717),IC Fixation Buffer(ThermoFisher Scientific),Permeabilzation Buffer 10X(ThermoFisher Scientific),CFSE 荧光染料(ThermoFisher Scientific)。
1.3 实验方法
1.3.1 细胞培养 正常肾小管细胞系HK-2 细胞采用DMEM-F12 完全培养基培养,肾癌细胞系786-O和769-P 细胞系采用RPMI-1640 完全培养基进行培养,3 种培养基的配置均采用在培养基中添加10%胎牛血清及2%青链霉素混合液配置。细胞置于5% CO2的37℃恒温培养箱中进行培养,根据ATCC推荐比例进行传代。
1.3.2 siRNA 干扰和细胞分组 于吉玛基因订购沉默IL4I1 的小干扰RNA(siRNA),siRNA 序列为:上游5′-GCAACUAUGUGGUGGAGAAGG-3′,下游5′-CCUUCUCCACCACAUAGUUGC-3′,对照siRNA 由吉玛基因提供。
根据表达情况选择786-O 细胞系进行干扰,提前24 h 于6 孔板中每孔接种1×105个细胞,使用opti-MEM 培养基稀释X-tremeGENE siRNA 转染试剂及siRNA 后以10∶2 比例混合并添加于细胞中,培养24~48 h 至合适密度后收集细胞提取RNA 检测沉默水平。
siRNA 干扰后的细胞分组为:实验组786-O-si,对照组786-O-ctrl。
1.3.3 RNA 提取和实时荧光定量PCR(qPCR) 去除上清并用预冷的PBS 洗涤后,在25 cm2培养瓶/6孔板中添加1 mL/500 μL Trizol 提取细胞RNA,利用反转录试剂盒Thermo Scientific RevertAid First StrandcDNASynthesisKit进行逆转录得到细胞cDNA。
以cDNA 为模板,添加FastStart Universal SYBR Green Master 及相应引物,采用95℃激活10 min 后进行95℃变形15 s,60℃退火并延长60 s 进行40个循环进行检测,以GAPDH 作为对照基因,利用△△Ct 法计算差异倍数。所用到的引物序列及产物大小见表1。
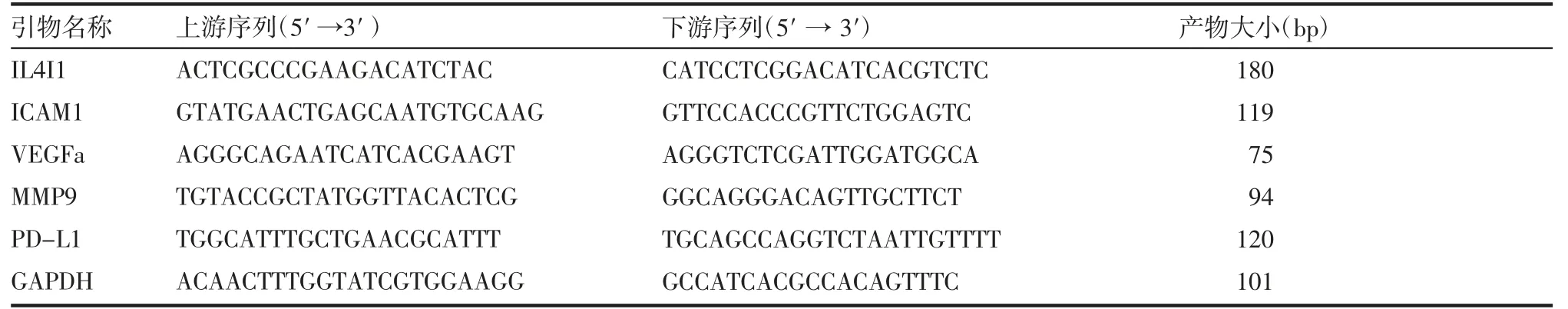
表1 引物序列及产物大小Tab 1 The sequence of primers and length of products
1.3.4 流式细胞技术(FCM) 收集细胞并用预冷的PBS 洗涤后,加入IC Fixation Buffer 于4℃固定30 min。洗涤后,用蒸馏水稀释为1×的 Permeabilzation Buffer 10X 重悬后以1∶1 000 比例加入IL4I1 抗体4℃孵育30 min。洗涤后用冷PBS 重悬后以1∶1 000比例添加山羊抗兔IgG H&L(FITC)后4℃孵育30 min。洗涤后PBS 重悬上机检测。
1.3.5 细胞划痕实验 6 孔板中每孔接种5×105个细胞,待细胞生长至90%密度后使用200 μL 枪头进行细胞划痕,PBS 洗涤至无明显漂浮细胞后更换培养基为无血清RPMI-1640 培养基,于0、24、48 h分别进行定点拍照。使用Image J 软件进行划痕面积计算。
1.3.6 CFSE 增殖实验 消化细胞并洗涤后,用PBS重悬为1×106/mL 比例后加入CFSE 染料至10 μmol/L浓度后避光孵育10 min,添加5 倍体积冷RPMI-1640 完全培养基停止标记并在4℃孵育5 min,洗涤3 次后于6 孔板中每孔接种1×105个标记后的细胞,于第0 天和第4 天分别在流式细胞分析仪中检测CFSE 荧光强度。
1.4 生物信息学分析 在TCGA(The Cancer Genome Atlas)数据库中下载并整理肾透明细胞癌样本数据(n=598),根据样本中IL4I1 基因表达水平,通过中位值将样本分为IL4I1 高表达组和IL4I1 低表达组,整理后的数据通过GSEA v4.1.0 软件进行KEGG 通路富集分析。
1.5 统计学处理 统计学分析使用GraphPad Prism 8.3.0 进行。正态分布的计量资料以±s 来表示,采用t 检验或方差分析进行组间比较。P<0.05 为差异有统计学意义。
2 结果
2.1 IL4I1 的表达及与预后的关系 相较于正常肾组织,IL4I1 在肾透明细胞癌中的mRNA 和蛋白水平均升高(均P<0.001)(图1A、B)。根据IL4I1 表达水平将肾透明细胞癌患者分为高、低表达组,生存分析结果显示IL4I1 高表达组具有更短的生存期(OS)(n=530,P<0.001)(图1C)。

图1 IL4I1 在肾透明细胞癌中的表达及与预后的关系Fig 1 The expression of IL4I1 in kidney clear cell carcinoma and its relationship with prognosis
2.2 肾癌细胞系中IL4I1 的表达和干扰 qPCR 结果显示,与HK-2 细胞相比,肾癌细胞系786-O 细胞中IL4I1 过表达(t=16.83,P<0.001)(图2A)。FCM结果显示,与HK-2 细胞相比,786-O 及769-P 细胞系IL4I1 蛋白阳性表达细胞比例均增加(t=280.40,t=37.11,均P<0.001)(图2B、D)。siRNA 干扰后,与对照组相比,实验组IL4I1 mRNA 表达水平显著降低(t=56.51,P<0.001)(图2C)。
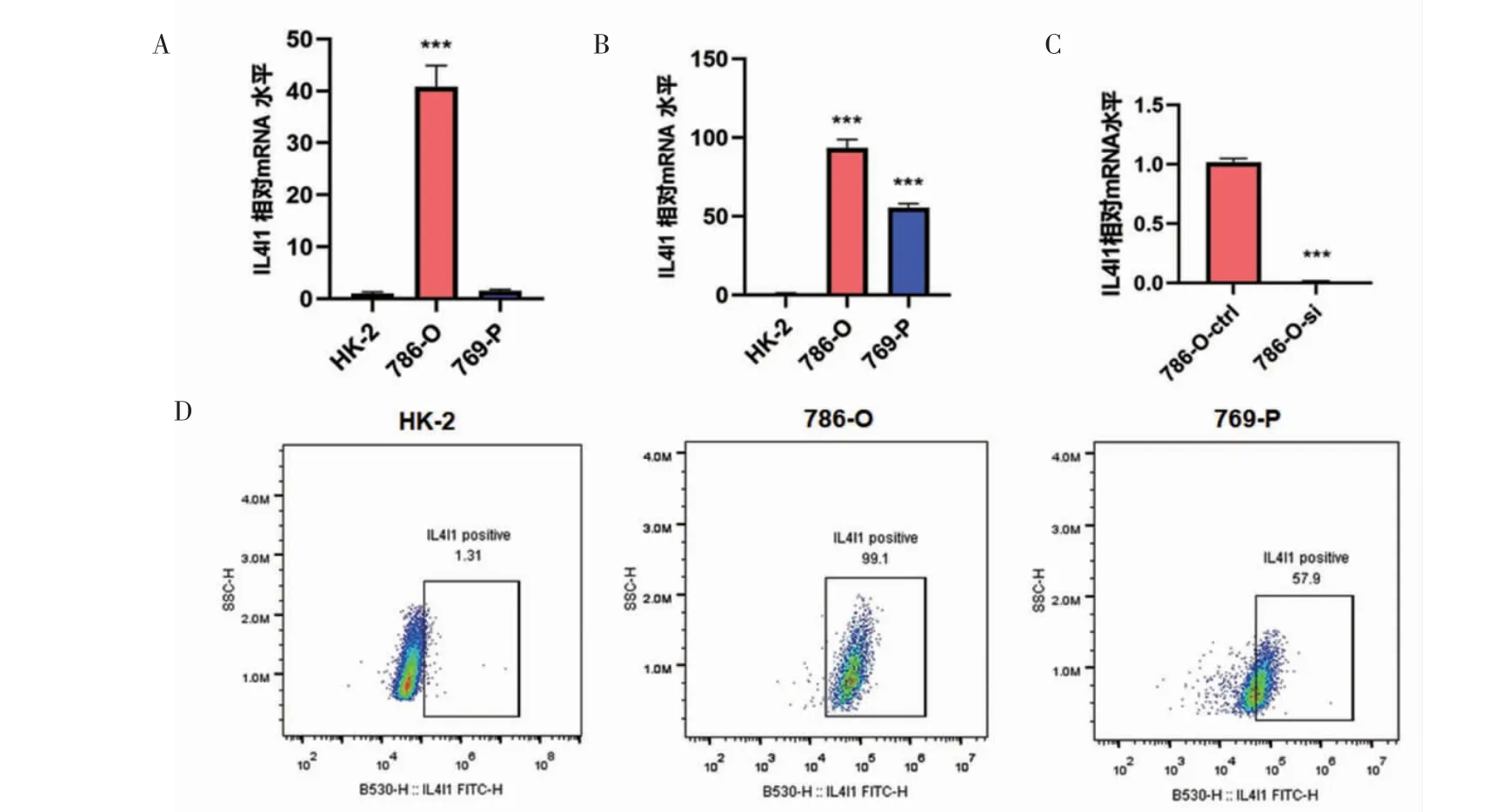
图2 IL4I1 在肾透明细胞癌细胞系中的表达和沉默Fig 2 The expression and silence of IL4I1 in tumor cells of KIRC
2.3 沉默IL4I1 基因表达对于肾透明细胞癌细胞生物学功能的影响 干扰IL4I1 表达后,细胞划痕实验结果显示,与对照组相比,实验组细胞迁移能力明显减弱(F=97.45,P<0.001)(图3A、3B);CFSE增殖实验结果显示,与对照组相比,实验组细胞增殖速度减慢(图3C)。
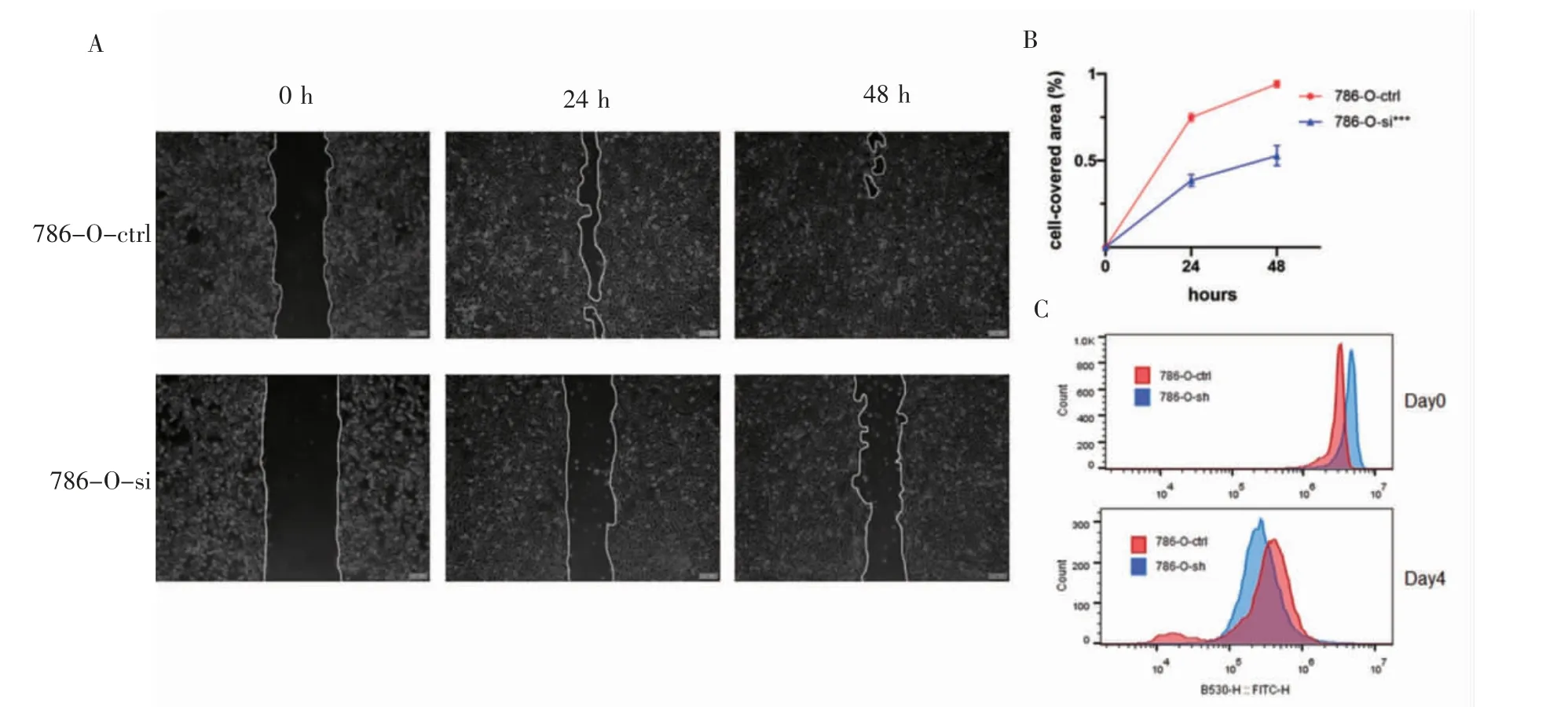
图3 IL4I1 的表达影响肾透明细胞癌细胞的增殖和迁移Fig 3 The proliferation and migration of KIRC cells influenced by expression of IL4I1
2.4 与IL4I1 表达及功能相关的机制探究 KEGG通路富集结果显示,与细胞增殖相关的细胞周期信号通路、P53 信号通路以及与细胞迁移能力相关的VEGF 通路和CAM 通路在肾透明细胞癌IL4I1 高表达组显著富集(FDR<0.25,P<0.05)(图4A)。
进一步相关富集通路重点基因的mRNA 水平检测的qPCR 结果显示,在沉默IL4I1 后,与对照组相比,实验组细胞间黏附分子-1(ICAM1)、基质金属蛋白酶9(MMP9)以及血管内皮生长因子A(VEGFa)表达水平都显著降低(t=9.031、8.613、9.066,均P<0.05)。此外,实验组细胞程序性死亡-配体1(PD-L1)表达水平也显著降低(t=12.66,P<0.05)(图4B)。
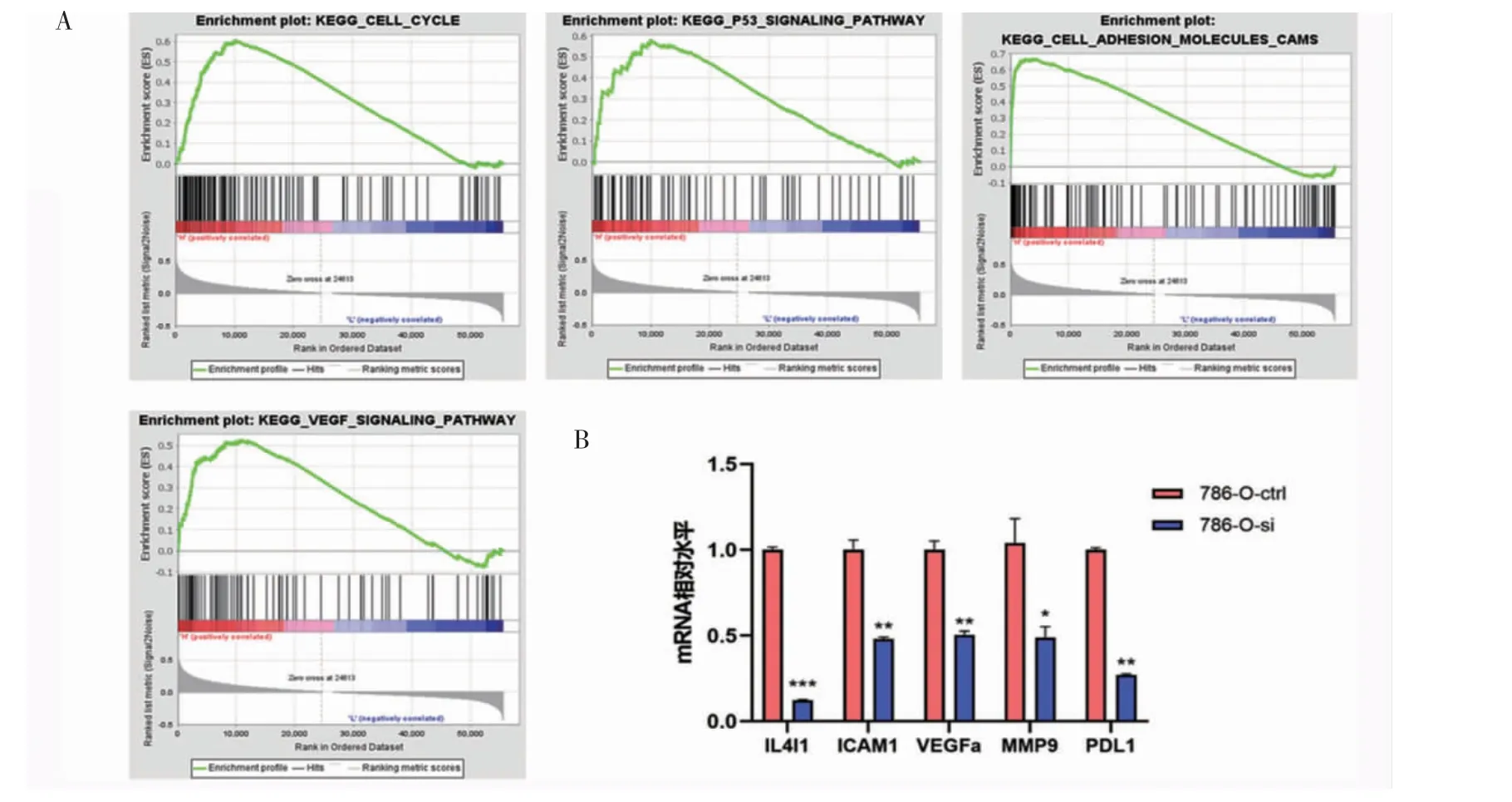
图4 肾透明细胞癌与IL4I1 表达及功能相关的潜在通路Fig 4 The related potential pathway of IL4I1 in expression and function in KIRC
3 讨论
肾细胞癌是常见的泌尿系统肿瘤之一,其中肾透明细胞癌约占总体的65%~85%[4]。肾癌相对较易诊断,但由于早期无明显症状,很多患者在确诊时已发展为晚期肾癌及转移癌,存在无法根治性切除的情况[5],迫切需求探究肾癌治疗的新手段。
近年肿瘤与代谢的关系备受关注。有研究观点认为肿瘤是一种代谢性疾病,肿瘤中存在的代谢重编程影响着肿瘤的发生发展[6]。2017 年批准上市的第一个针对肿瘤代谢的抗癌药物——主要异柠檬酸脱氢酶2(IDH2)抑制剂恩西地平(Enasidenib),使靶向代谢的肿瘤治疗成为可能[7]。
肾透明细胞癌与代谢异常密切相关,其胞质中存在的脂质异常积累导致的代谢重编程是其不同于其他肾癌的一大特征[8]。本研究发现IL4I1 这种特殊的氨基酸代谢酶在肾透明细胞癌中存在显著过表达,并且指示不良预后。
作为一种免疫调节酶,IL4I1 被发现在以树突状细胞为主的抗原呈递细胞中和肿瘤相关性巨噬细胞中高表达[9]。IL4I1 可以被抗原呈递细胞合成并释放,抑制免疫突触的稳定形成,下调T 细胞CD3ζ链的膜暴露影响CD8+T 细胞活化[10-11]。IL4I1 介导的局部必需氨基酸的消耗以及有毒产物的产生形成不利于抗肿瘤免疫的环境,从而进一步限制肿瘤杀伤性T 细胞的增殖和功能[1,12]。最新一项研究发现IL4I1 的高表达可以抑制CD8+T 细胞向记忆表型的分化从而限制对于肿瘤的长效免疫[10]。此外,IL4I1可以促进Treg 细胞及M2 型巨噬细胞的分化,可以参与调节MDSC 的分化,以及对于这些免疫抑制性细胞的募集[1,13-14]。
既往认为IL4I1 是乳腺癌和胶质瘤重要的预后标志物[3]。在最新的两项研究中,IL4I1 被发现在体外实验中能够影响胶质瘤细胞和卵巢癌细胞的迁移能力,以及促进卵巢癌细胞的增殖,并且在小鼠模型中被证实IL4I1 的表达与肿瘤生长密切相关[2,15]。IL4I1的表达还与黑色素瘤的前哨淋巴结侵袭、较高肿瘤分期以及快速复发相关,往往提示较短的总生存期[1,3]。
本研究发现IL4I1 在肾透明细胞癌中存在过表达并且指示预后不良。干扰IL4I1 表达后发现肾透明细胞癌细胞的增殖速度及迁移能力下降,IL4I1可能是因此促进肾癌的发展和转移。KEGG 通路富集分析显示在IL4I1 高表达的肾透明细胞癌组中存在49 个通路显著富集,而在低表达组中无通路显著富集。其中,与细胞增殖密切相关的细胞周期通路及P53 信号通路,以及与肿瘤细胞迁移发展转移密切相关的CAM 通路及VEGF 信号通路显著富集。而在干扰IL4I1 表达后,肾癌细胞表达ICAM1、VEGFa、MMP9 及PD-L1 的mRNA 水平显著降低。
ICAM1 可以降低肿瘤细胞间的黏附能力,使肿瘤细胞脱落入血,从而完成肿瘤的转移,ICAM1 也参与肿瘤血管生成[16]。VEGFa 能特异性促进细胞的分裂增殖和迁移,对于肿瘤的新生血管生成十分重要[17]。研究显示,MMP9 能够通过降解细胞外基质(ECM)从而在肿瘤的转移和侵袭中发挥重要作用[18]。这可能有利于IL4I1 影响肿瘤转移的相关机制的研究,从而为靶向IL4I1 提供指导。
此外,Sadik 等[2]研究发现了IL4I1 可以通过代谢色氨酸产生中间代谢产物犬尿喹啉酸(KynA),活化AHR 调控相关基因的转录,促进肿瘤转移以及抑制CD8+T 细胞的增殖和增强免疫抑制性细胞的募集。他们同时发现在部分应用抗PD-1/PD-L1 效果不佳的恶性黑色素瘤患者中出现IL4I1 和IDO1表达水平的增高,并且在联用IDO1 抑制剂后没有改善。这提示IL4I1 可能是改善现有免疫疗法的一个可能方向,而笔者的研究也发现IL4I1 的表达会影响PD-L1 的表达,这可能是肿瘤免疫逃逸的机制之一。
近期也有对小鼠肿瘤局部注射IL4I1 抑制剂后观察到肿瘤明显体积减小的报道[19],也是IL4I1 能够作为一个肿瘤治疗靶点的有利证据之一。目前针对IL4I1 的有效安全的抑制剂也在研究中[20]。总之,IL4I1 可以通过影响肿瘤细胞的增殖和迁移能力从而影响肾透明细胞癌的发展,是一个有潜力的针对肾透明细胞癌靶向治疗的检查点。
