基于GEO数据库脓毒症心肌病差异基因的筛选与生物信息分析
2022-08-01秦伟强顾杨李莉余涛
秦伟强,顾杨,李莉,余涛
脓毒症心肌病(sepstic cardiomyopathy,SCM)是在脓毒症休克中经常出现的疾病,且常常预示着不良的预后,但由于其显著提高了病人的死亡率至70%,其发病率约在所有脓毒性休克病人中的18%~40%[1]。脓毒症病人在发作时可能会出现心肌严重抑制,表现为心率紊乱、心力的衰竭和血压下降,在SCM中可能会发展得更严重。因此,目前SCM已被视为是脓毒性休克的潜在并发症;SCM通常被认为一个对左心室可逆性的收缩障碍[2]。不过,目前其致病机理尚不明确,主要包括细胞因子对心肌的损伤、缺血和再灌注损伤、Ca2+心肌细胞超载、心肌功能障碍等。
SCM的发生主要是因为左室和右室的结构和功能发生了复杂的血流动力学变化,同时也与外周动脉的张力发生了绝对或相对的降低,从而导致中心血容量减少有关。脓毒症患者可能具有低动态状态,特征为左心室扩张和左心室射血分数(EF)降低;容量复苏后,脓毒症患者可以形成多动力循环,其特征为动脉张力降低、心动过速和LVEF增加[3,4]。由此可见,对于SCM的早期准确识别是极其困难的。但目前,对SCM的检测主要还是以心脏酶谱法、彩色多普勒超声心动图等方法为主,但其特异性仍然不高。现有的研究显示,SCM患者的心脏基因与晚期心力衰竭患者之间的基因表达差异很大,但还需要更多的研究。本文采用GEO数据库中的SCM相关基因芯片进行了生物信息学的分析和挖掘,从中找出与SCM相关的基因,并进行了富集分析,从中筛选出与SCM发病有关的重要基因,从而为进一步深入地探索SCM的发病机制和早期识别提供了新的思路。
1 资料与方法
1.1 资料来源和处理
资料来源:GEO公共数据库中通过关键词“Septic Cardiomyopathy”检索并整理出有关脓毒症心肌病患者的基因芯片表达数据集:GSE79962,由Matkovich SJ.eg提交,共有31个样本,包括11名对照组(Nonfailing)和20例SCM患者的基因表达矩阵。
1.2 差异基因筛选与可视化
使用Networkanalyst在线分析工具(https://www.networkanalyst.ca/)对数据集GSE79962进行分组,筛选差异表达基因(DEGs)进行研究,P<0.05,logFC(差异倍数)>15。筛选上调和下调基因。Graphpad prism 8用于数据集基因的定位和可视化显示。
1.3 功能富集解析使用
Metascope在线数据库基因本体(go)解析和京都遗传学组和遗传学组百科全书(KEGG)解析在SCM相关DEG上进行。P<0.05有统计学意义。
1.4 蛋白质相互作用网络分析
将筛选得出的DEGs输入String在线数据库(https://String-db.org/),以最小互作评分为0.4构建蛋白质互相作用(protein-protein interaction,PPI)的网络图。并使用Cytoscape 3.9.0,更进一步实现了可视化展示。使用Cytoscape插件MCODE可以实现具有明显效果的功能模块,设定参数为Degree cutoff=2、Node score cutoff=0.2、K-score=2、Max.depth=100。应用CytoHubba的MMC算法插件,拣选出前10个分数最高的关键基因。
2 结果
2.1 使用NetworkAnalyst技术
对GSE79962数据集进行了检测,共确定三百九十个符合条件的DEGs,其中上升基因228个,下降基因162个。按照logFC大小进行排列,从而获得差异中表现最明显的前10个DEGs,并分为了上升和下降(见表1);而且由PCA图可以看出,两组间有明显的组间差异。应用GraphPad Prism 8.0.1对DEGs实施可视化展示(见图1)。
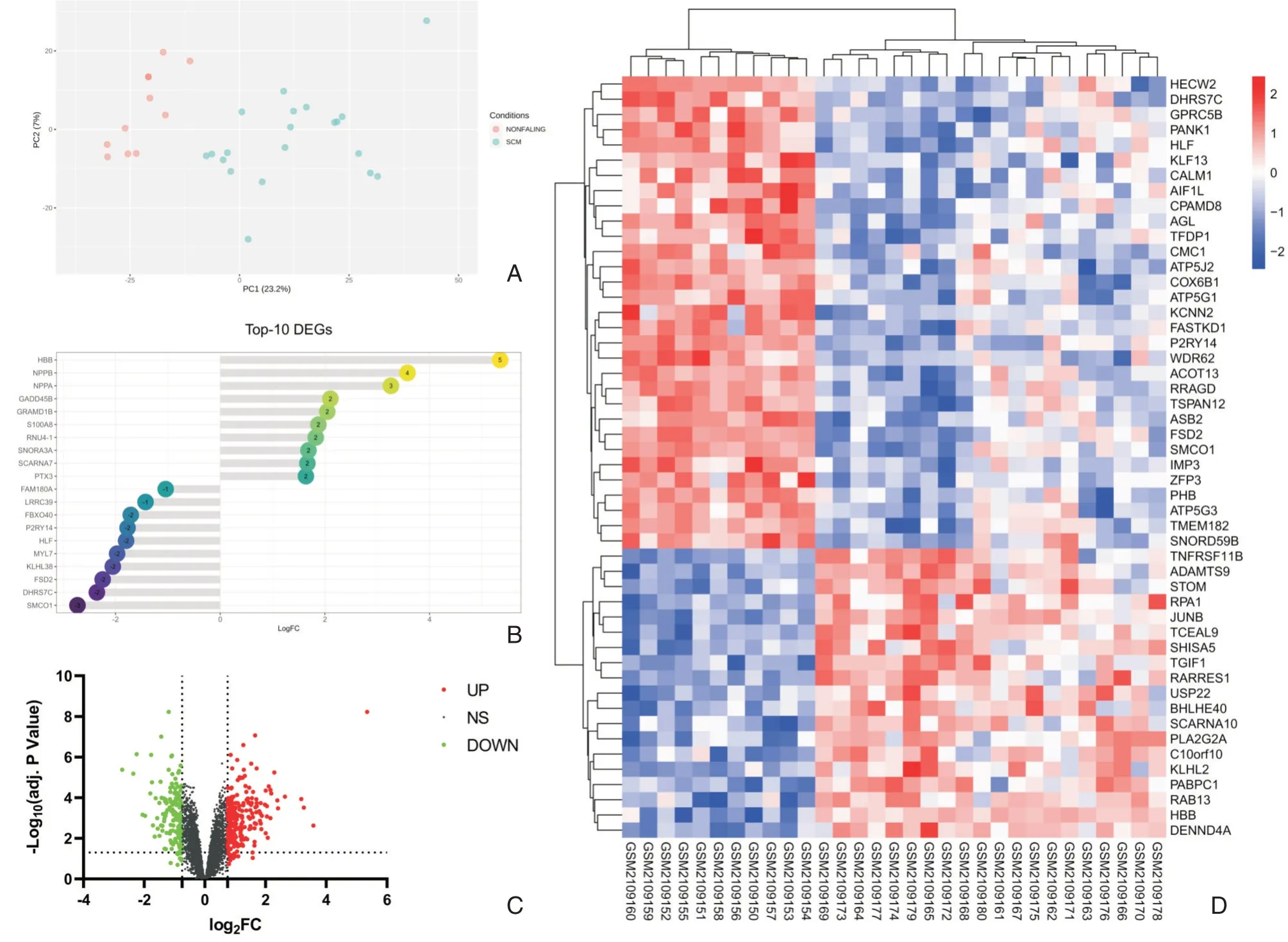
图1 数据集差异基因 A:脓毒症心肌病组与对照组基因表达值进行样本间的PCA分析;B:脓毒症心肌病组与对照组排名前10的DEGs的棒棒糖图;C:脓毒症心肌病组与对照组间差异基因火山图;D:脓毒症心肌病组与对照组间DEGs表达谱热图

表1 TOP10上调DEGs
2.2 GO解析与KEGG解析
使用String在线数据库系统实现对DEGs实现的GO解析与KEGG解析。GO功能富集解析结论为:①生物流程(biological process,BP):DEGs功用一般富集在对药物反应、对血栓形成的积极调控、对细菌繁殖的负性调控等;②细菌组成(cellular component,CC):DEGs一般富集于细胞外范围、细菌外间隙、浆膜的整体成分等;③分子作用功能(molecular function,MF)DEGs一般富集于蛋白质融合、钙离子融合、受体融合等(见表3)。KEGG的分析结果表明,DEGs主要是富集在矿物质营养吸收、HIF-1信息通道、胰岛素抵抗、肿瘤中的转录障碍、小细胞肺癌、p53信息通道、PI3K-Akt信息通道、脂肪细胞激素信息通道中等(见图2,表3)。

图2 富集分析 A:排名前20的生物过程(BP)通路;B:排名前20的细胞组成(CC)通路;C:排名前20的分子功能(MF)通路;D:排名前10的KEGG通路

表2 TOP10下调DEGs

表3 GO分析
2.3 PPI网络建立和对关键基因的筛选
通过String在线分析网络构建了PPI系络图,并使用Cytoscape 3.9.0进行解析其结果,得到了二百八十八个蛋白节点和七百二十八条边,从而绘制了PPI系络图(见图3)。利用MCODE插件可以获得显著的相互作用模块一和模块二(见图4),各包括八个节点、28条边,MCODE score为9.33。使用cytoHubba的MCC算法,检测出了十个重要基因:STAT3、SERPINE1、TIMP1、TP53、ICAM1、IGF1、MYC、THBS1、HMOX1、ADIPOQ(见表4、图3)。

图3 A:PPI网络建立;B:关键基因(Hub Genes)的筛选

表4 关键基因
3 讨论
SCM作为脓毒症中最严重的并发症之一,同时也是最常见的临床表现。SCM病因病理过程十分复杂,也可能是由许多原因相互作用所造成的后果,可能与心脏抑制物、线粒体功能障碍、过氧化应激、钙调节失衡、神经细胞凋亡、肾上腺素受体等相关[5,6]。在脓毒症初期,心肌细胞会受到抑制,并且会随着病情的进展而发展成心功能紊乱。因此,倘若及时早期识别和预防心功能不全,将能更好地改善患者的预后。近几年,随着生物信息学的迅速发展,人们对很多疾病的认识都有了新的认识,并为进一步了解其致病机理和可能的治疗目标提供了新的途径。
这次研究中,选择了GEO数据库中的GSE79962数据集,平台则是GPL6244。以SCM病人的左心室壁组织为实验组,以非脓毒症人群的组织样品为对照组,使用NetworkAnalyst等在线数据分析工具检测与SCM有关的上升、下降差异基因。根据DEGs的生物信息学结果表明,在SCM病人中含有228个上升基因和162个下降基因。GO分子功能分析描述,其大多数在Ca2+结合、蛋白质的结合、受体的结合等过程中富集和调控。心肌细胞钙离子含量的失调引起了钙超载,钙超载在缺血性心脏再灌注损伤中起了主要作用。Ca2+作为心肌细胞内最主要的第二信使,在脓毒症中参与了许多重要的信号通路的传导,例如线粒体损害、氧化应激、细胞自噬作用、炎症的激活等[7]。Ca2+在细胞质中的增加会引起磷脂酶的活化,促使细胞膜中的磷脂降解致使细胞膜损伤;聚集于细胞质的Ca2+进入线粒体后消耗大量ATP,并与磷酸根结合,形成不能溶解的磷酸钙,进一步损害线粒体[8];细胞内Ca2+的增加,会促进钙依赖性蛋白酶的活力,促进黄嘌呤氧化酶的产生,使氧自由基的增加,加剧氧化应激的损害;另外,心肌的缺血再灌注期间,Ca2+与蛋白C复合物相互作用,导致肌钙蛋白Ⅰ构象发生变化,致使肌动蛋白释放与肌球蛋白结合增加,进而引起心肌纤维的收缩[9,10]。
KEGG分析提示,SCM的DEGs在矿物质吸收、
PI3K-Akt信号通路、胰岛素抵抗等通路显著富集。PI3K-Akt信号通路参与免疫调控、介导细胞因子表达、细胞增殖、分化及凋亡和葡萄糖转运等多种细胞功能的调节[11]。研究表明,TLR4受体与脂多糖(LPS)结合后,能直接激活PI3K-Akt信号通路,而PI3K-Akt信号通路激活后可抑制LPS诱导的炎症反应以及细胞凋亡[11]。有研究显示,抑制PI3K或Akt,能促使炎症因子如IL-12、IL-6、TNF-α等的表达增加,提示PI3K-Akt信号通路的激活能减少脓毒症患者体内炎症因子的释放[12]。最近也有实验证实,通过激活PI3K-Akt信号通路,能抑制NF-κB信号通路从而减少炎症因子的释放如TNF-α,同时抑制心肌细胞的凋亡,最终产生对心肌细胞的保护作用[13]。可见,PI3K-Akt信号通路的激活在脓毒症心肌病中,参与炎症反应、心肌细胞凋亡等起着重要作用。另外,DEGs在体内的矿物质吸收、胰岛素抵抗、胰岛素信号通路等方面均有富集,表明基因的失调在SCM患者体内的代谢中扮演了重要角色。
通过Cytoscape的分析,获得了10个关键基因,分别是STAT3、SERPINE1、TIMP1、TP53、ICAM1、IGF1、MYC、THBS1、HMOX1、ADIPOQ。其中STAT3(信号转导及转录激活蛋白3)为STAT蛋白家族之一,其激活后起着重要的转录调节功能,并参与了细胞的增殖和凋亡[14]。STAT3作为脓毒症细胞内主要信号转导系统之一,它与IL-6等炎症因子的释放有很大关系,因而在SCM患者中对机体的持续损害起着关键的作用[15,16]。研究显示,STAT3表达量的升高对心肌具有保护作用,并具防止心力衰竭的发生[17,18]。TP53、thbs1和ADIPOQ尚不完全清楚,需要进一步研究。TIMP-1、IGF1、IGF1-24主要起心肌保护作用。SERPINE1该基因编码丝氨酸蛋白酶抑制剂(Serpin)超家族成员为纤溶的抑制剂,多在心肌纤维化重塑中起作用[19,20],但具体作用尚未完全情况,可能是判断SCM病情严重程度新的标志物。
本研究主要通过筛选出脓毒症心肌病患者的差异基因并对其进行GO、KEGG及PPI功能通路的富集分析,寻找出可能是新的治疗靶点。由于本研究的局限性,未发现药物对基因表达的影响。但随着生物信息技术的发展,使人们对其发病机制有了更多的了解,这将为SCM的治疗提供了新的思路。
