基于网络药理学分析灯盏乙素治疗动脉粥样硬化的分子机制和体内验证
2022-07-31王雨婷石佳宁余丹杨仁华沈志强龙江陈鹏
张 莉 ,王雨婷 ,石佳宁 ,余丹 ,杨仁华 ,沈志强 ,龙江 ,陈鹏
(1)昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2)昆明医科大学第一附属医院神经外科,云南 昆明 650032)
心血管疾病(cardiovascular disease,CVD)是世界范围内人类死亡的主要原因之一,而动脉粥样硬化(atherosclerosis,AS)是所有心血管疾病的病因和共同的病理生理基础[1−3]。动脉粥样硬化(atherosclerosis,AS)是一组发展缓慢、复杂的炎症性血管疾病,其特征是动脉壁增厚、硬化,失去弹性,管腔狭窄,血管内膜上积淀淡黄色动脉粥样硬化斑块,是临床重多心血管系统疾病的关键的病理基础。近年来研究表明,AS 发病呈现年轻化的趋势[4−5]。因此,寻找AS 关键有效的预防靶点一直是心脑血管领域研究的热点和重点。目前,他汀类药物、抗血小板聚集药物和一些中草药复方制剂是临床上常用一线的抗AS 药物[6]。虽然这些药物对AS 有一定的防治疗效,但既往研究表明,长期使用他汀类药物会导致肝肾损伤和横纹肌溶解等不良反应[7],甚至会出现横纹肌溶解后急性肾衰竭而死亡等严重的后遗症[8]。因此,关注AS 的发病机制对其防治AS 的病程进展具有非常重要的临床价值。
灯盏花又名灯盏细辛,是云南特色药用植物,其主要成分为灯盏乙素(Scutellarin),其结构式:4′,5,6-三羟基黄酮-7-葡萄糖醛酸苷,见图1。前人研究发现,灯盏乙素能改善高血糖引起的血管内皮细胞损伤[3]。与前人[9]的研究结果相似,笔者的研究表明灯盏乙素可以保护血管内皮细胞,并通过减少氧化作用发挥抗AS 的作用,而具体的分子机制并不清楚。结合上述研究结果,提示灯盏乙素具有潜在的抗AS 临床价值,值得进一步深入研究。网络药理学是以系统生物学和多向药理学为基础,可以为研究者提供新的药物研究策略,它可以通过构建“疾病-基因-靶点-药物网络,筛选出关键作用的靶点与生物学过程” 更直观的向人们阐述药物作用于疾病的生物学作用和潜在的分子机制[10]。因此,本课题结合网药预测结果,同时复制APOE-/-小鼠动脉粥样硬化模型,研究系列浓度的灯盏乙素对APOE-/-小鼠AS模型的胸主动脉斑块组织中PI3K/AKT/mTOR 信号通路的调控作用及炎症因子的影响,深入挖掘灯盏乙素抗 AS 的分子生物学作用机制,为AS 的预防和治疗进一步提供全新的视角和实验室数据支持。

图1 灯盏乙素的化学结构式Fig.1 Chemical structure of Scutellarin
1 资料与方法
1.1 一般资料
1.1.1 数据库及软件实验中用到的数据库和软件如下:PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/);SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/);PharmMapper 数据库v2017(http://www.lilab-ecust.cn/pharmmapper/);GeneCards 数据库v5.6.0(https://www.genecards.org/);DisGeNET Database v7.0(https://www.disgenet.org/);Uniprot 数据库(https://www.uniprot.org/);Venny 2.1.0 软件(https://bioinfogp.cnb.csic.es/tools/venny/);蛋白相互作用网络平台STRING v11.5(https://stringdb.org/);DAVID v6.8 数据库(https://david.ncifcrf.gov/);微生信平台(http://www.bioinformatics.com.cn/);Cytoscape v3.9.0 软件(https://cytoscape.org/),见表1。

表1 实验涉及的部分数据库Tab.1 Main databases involved in the experiment
1.1.2 药物与试剂(1)云南省药物研究所张人伟教授提供灯盏乙素,纯度为98.8%。阿托伐他汀钙由辉瑞公司提供。(2)灯盏乙素组每天以0.1 mL/10 g 体重进行灌胃。以28 mg/kg 的灯盏乙素组为例,将2800 mg 的灯盏乙素单体溶于100 mL 蒸馏的0.02 mmol/L NaOH 溶液中,调整pH 值至7.8。将上述28 mg/kg 剂量的溶液稀释一半,以获得灯盏乙素(14,7 mg/kg)溶液。(3)阿托伐他汀钙(atorvastatin calcium,ATV)的配制,10 mg/kg 的阿托伐他汀钙阳性对照组药物,每天以0.1 mL/10 g 体重进行灌胃。
1.1.3 实验动物70 只健康的ApoE-/-小鼠和20只健康的C57BL/6J 小鼠(雌雄各半),年龄8 周,体重(20±5)g,ApoE-/-小鼠由北京伟同利华实验动物技术有限公司(北京,中国)购买。生产许可证号为SCXK(京)2012-0001。C57BL/6J 小鼠由昆明医学院实验动物系提供,生产许可证号为SCXK(滇)2015-0002。动物在洁净的动物房中饲养,温度18~25 ℃,湿度40%~70%。适应性饲养1 周后,开始实验。
1.2 实验方法
1.2.1 灯盏乙素(“Scutellarin”)的靶点筛选及网络构建以“Scutellarin”为检索词,使用PubChem 数据库下载灯盏乙素2D 结构式的SDF格式并复制灯盏乙素的Canonical SMILES 号。通过Swiss 数据库预测药物靶点时,提供PubChem数据库下载的灯盏乙素的Canonical SMILES 号,即可得到该数据库中灯盏乙素潜在的作用靶点;使用PharmMapper 数据库查找灯盏乙素潜在作用靶点时,在PharmMapper 数据库首页点击Submit job,将灯盏乙素结构式的SDF 格式导入,选择Human Protein Targets Only,提交后可得到该数据库中灯盏乙素的潜在作用靶点,由于在PharmMapper 数据库下载的药物靶点只有Uniplot格式,需要转化为常见基因名,故使用Uniprot数据库进行转化,首先把PharmMapper 数据库下载得到的靶点进行筛选,将Zscore 列设置为大于0.9,把筛选出的基因的Uniplot 列粘贴到Uniprot数据库,选择UniProtKB AC/ID to Gene name,提交后下载Target list。将2 个数据库查的药物靶点整合后,构建药物-靶点网络(Cytoscape 3.9.0)。
1.2.2 Atherosclerosis 靶点筛选输入“Atherosclerosis”,通过DisGeNET Database v 7.0 和Gene Cards 数据库检索疾病靶点,按照筛选条件,将筛选结果整合后得到疾病(动脉粥样硬化)的潜在靶点。
1.2.3 Scutellarin 与 Atherosclerosis 的 Venny分析将灯盏乙素的作用靶点与动脉粥样硬化的基因靶点进行Venny 分析,将共同靶点上传Venny 2.1.0 数据库构建韦恩分析图,筛选得到共同作用靶点,即为灯盏乙素治疗动脉粥样硬化的作用靶点。
1.2.4 蛋白质相互作用关系网络构建为了深入挖掘灯盏乙素潜在靶点与动脉粥样硬化疾病靶点之间的潜在分子机制,现将筛选得到的共同作用靶点上传STRING 数据库,“Minimum required interaction score”设置为0.4(中等可信度),并隐藏不连接节点,其余数值均保持默认值,则蛋白质相互作用关系网络图绘制完成。
1.2.5 GO 富集分析为说明灯盏乙素的靶点在基因功能中的作用,将上述筛选出的灯盏乙素治疗动脉粥样硬化的作用靶点导入DAVID v6.8 数据库中,按照FDR 值升序(FDR <0.05),筛选细胞组 成(cellular component,CC),生物学过程(biological process,BP),分子功能(molecular function,MF)富集最显著10 个GO 条目,利用微生信平台绘制条形图。
1.2.6 KEGG 通路富集分析KEGG 通路分析,按照FDR 值升序(FDR <0.05)筛选排名前20 的信号通路,计算通路富集倍数(Gene ratio),以P值作为参数,将数据导入微生信平台进行数据可视化处理。
1.2.7 AS 模型的复制、给药和血管取材适应性喂养7d 后,用西方高脂肪饮食(1%胆固醇、15%猪油、15%花生油、20%蛋黄粉、1%盐和48%普通饮食)喂养ApoE-/-小鼠,用标准饮食喂养C57BL/6J 小鼠。12 周后,随机牺牲6 只ApoE-/-小鼠和6 只C57BL/6J 小鼠,收集胸主动脉进行组织病理学评估,检测动脉粥样硬化的形成。确认模型构建成功后,将剩余的60 只动脉粥样硬化模型小鼠随机分为5 组(n=12):动脉粥样硬化模型组;7 mg/kg、14 mg/kg 和28 mg/kg 的灯盏乙素治疗组;以及10 mg/kg 的阿托伐他汀钙(atorvastatin calcium,ATV)作为阳性对照组;12只C57BL/6J 小鼠设为正常对照组。每周称量调整剂量,治疗组用不同剂量的灯盏乙素灌胃,每天1 次,每次0.1 mL/10 g,对照组和模型组用相同量的正常生理盐水灌胃,持续12 周。取材前给予小鼠2%异氟烷吸入式麻醉。然后,分离每只小鼠的胸主动脉,最后小鼠吸入2%异氟烷过量致死。
1.2.8 HE 染色取各组小鼠总动脉一段固定后的主动脉,常规脱水、透明、浸蜡,石蜡包埋,以20 µm 厚度连续切片,每只动物从连续切片的第 5 张开始,每间隔 10 张选1 张,即第 5、15、25,共3 张切片,显微镜下观察,拍照。
1.2.9 ELISA 法检测TNF-α 和IL-1β 的含量小鼠麻醉后,迅速眼球取血,离心,取上清,使用小鼠ELISA 的TNF-α 和IL-1β 试剂盒检测各实验组中小鼠分离提取血清实验样本TNF-α 和IL-1β 中含量。依据说明书依次加入试剂和样品,用酶标仪在 450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠肿瘤坏死因子α(TNF-α)和白细胞介素 1β(IL-1β)含量。
1.2.10 RT-PCR 确证差异基因为了研究灯盏乙素对AS 模型影响,进行RT-PCR 来检测PI3K、AKT、mTOR、Bax、Bcl-2、Caspase-3 的mRNA水平。用TRIzol 试剂提取各组胸主动脉血管组织总RNA,并使用Quant Script RT 试剂盒进行逆转录。在ABI7900HT(Applied Biosystems,Foster City,CA,USA)上进行PCR。2-ΔΔCT值用来表示PI3K、AKT、mTOR、Bax、Bcl-2、Caspase-3 RNA 的相对表达水平。随机选择并准备了7 条PCR 引物来分析颈总动脉的变化。PCR 条件如下:95 ℃热变性40 s,60 ℃退火30 s,60 ℃延伸45 s,共40 个循环。一式3 份的PCR,20 µL 的混合物含有4 µL 的5×FastPfu 缓冲液,2 µL 的dNTPs(2.5 mM),0.8 µL 的每个引物(5 µM),0.4 µL 的Fast Pfu 聚合酶,和10 ng 的模板DNA。则样品中的相对mRNA 表达水平被确定为2-ΔΔCT。特定基因的引物序,见表2。

表2 引物序列Tab.2 The primer sequence
1.3 统计学处理
2 结果
2.1 灯盏乙素(Scutellarin)靶点筛选
从PubChem 数据库中得到灯盏乙素分子结构图 的sdf 格式及Canonical SMILES 号,通过Pharm Mapper 数据库、Swiss Target Prediction 数据库寻找与灯盏乙素相关的潜在靶点,经筛选后共得到167 个靶点,主要有肿瘤坏死因子-a(TNFα)、NADPH 氧化酶4(NADPH oxidase 4)、MAP激酶p38α(MAP kinase p38 alpha)、P-糖蛋白1(Pglycoprotein 1)、淋巴细胞分化抗原 CD38(Lymphocyte differentiation antigen CD38)等。
2.2 成分-药物靶点网络构建
将“Scutellarin”与167 个潜在靶点经数据处理后上传Cytoscape 3.9.0,即呈现灯盏乙素-靶点网络图,其中黄色代表灯盏乙素,灰色代表灯盏乙素作用的靶点,见图2。
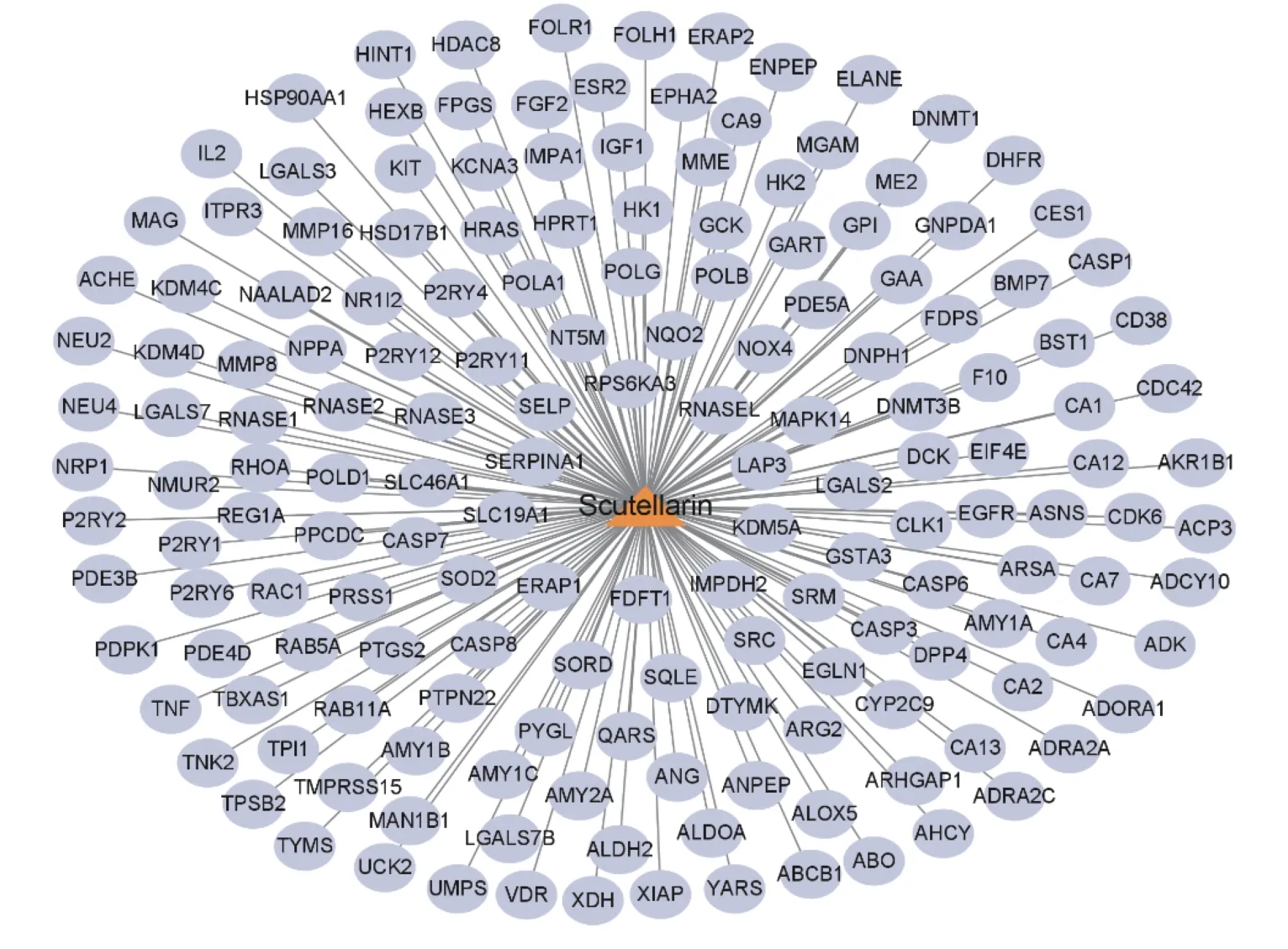
图2 灯盏乙素-靶点网络图Fig.2 Scutellarin-target network
2.3 疾病靶点筛选
以“Scutellarin”为检索词,通过DisGeNET Database v7.0 数据库和Gene Cards 数据库分别进行检索,共得到5197 个与AS 的相关靶点,包括低密度脂蛋白受体(low density lipoprotein receptor)、肿瘤坏死因子-α(TNF-α)、白介素6(interleukin 6,IL-6)、载脂蛋白E(apolipoprotein E,APOE)、AKT 丝氨酸/苏氨酸激酶1(AKT serine/threonine kinase 1)等。
2.4 PPI 网络构建
将药物和疾病靶点依次上传至Uniprot 数据库进行靶点基因标准化,再通过 Venny 2.1 软件绘制韦恩图及药物-疾病-靶点网络图,其中AS 靶点用黄色表示,灯盏乙素靶点用蓝色表示,2 部分交集得到106 个共同靶点,见图3;将共同靶点上传STRING 绘制PPI 网络,见图4。
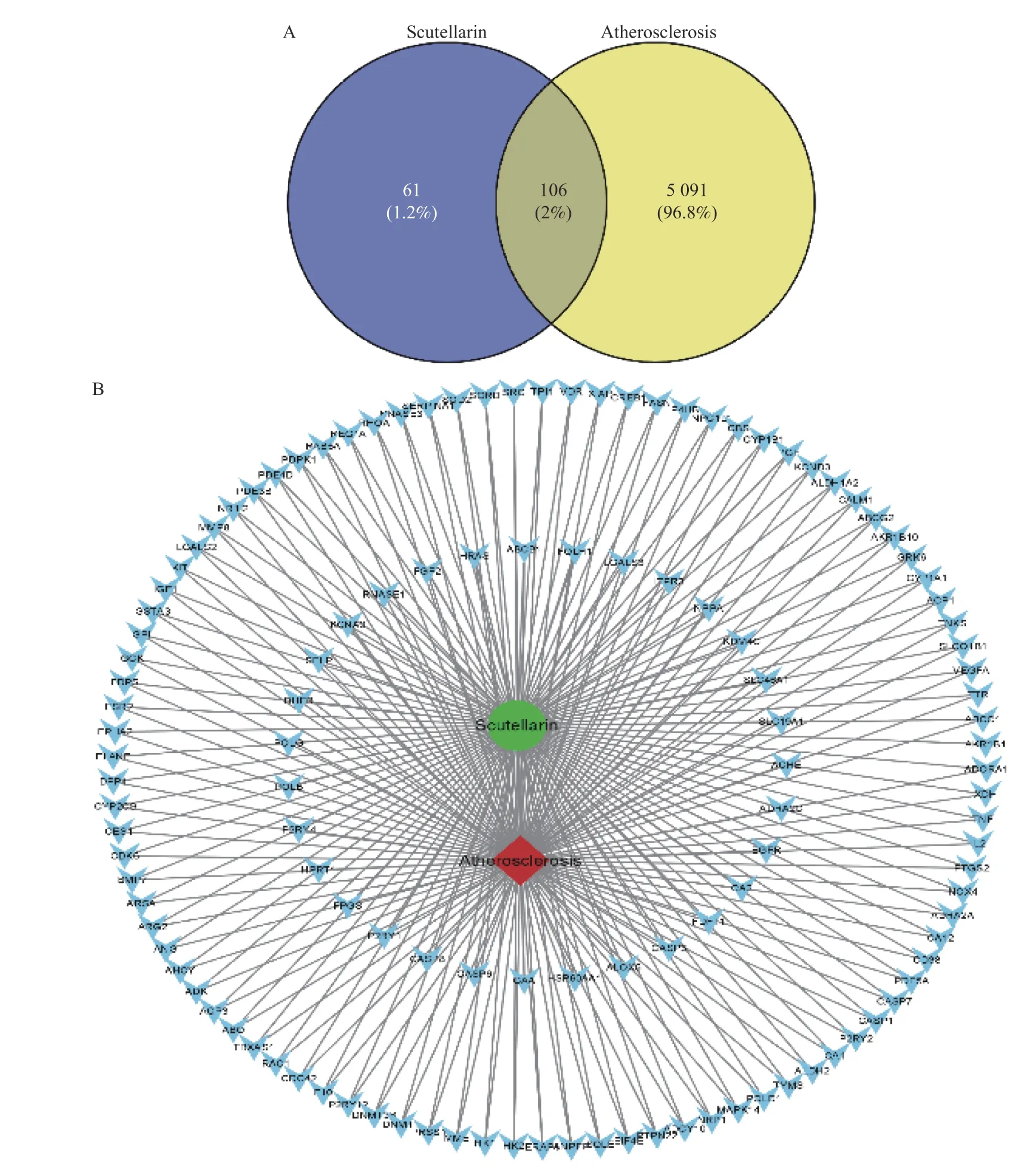
图3 灯盏乙素-动脉粥样硬化-靶点网络Fig.3 Intersection of Scutellarin predicted targets and atherosclerotic targets
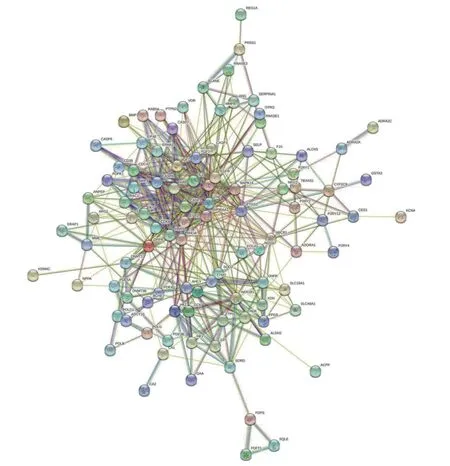
图4 灯盏乙素治疗动脉粥样硬化潜在靶点的PPI 网络Fig.4 PPI network of potential targets of Scutellarinl on anti-AS
2.5 核心靶点筛选
将PPI 图的tsv 格式导入Cytoscape v3.9.0 软件,在Cytohubba 中提交,选择排名前20 的靶点制作核心靶点图,见图5。

图5 核心靶点筛选Fig.5 Core target screening
2.6 GO 功能富集分析
将上述共同靶点上传至DAVID v6.8 数据库,通过DAVID 数据库对106 个差异基因进行GO 功能富集分析,其中共得到239 个生物学过程(biological process,BP),主要包括MAP 激酶活性的正调控(Positive regulation of MAP kinase activity)、平滑肌细胞增殖的正调控(Positive regulation of smooth muscle cell proliferation)、Ras 蛋白信号转导(Ras protein signal transduction)等;41 个细胞组成(cellular component,CC),主要涉及细胞外空间(Extracellular space)、细胞溶质(Cytosol)、薄膜(Membrane);68 个分子功能(molecular function,MF),主要包括蛋白酶结合(Protease binding)、酶结合(Enzyme binding)等,见图6。

图6 灯盏乙素治疗动脉粥样硬化潜在靶点的GO 富集分析Fig.6 GO enrichment analysis of potential targets of Scutellarin for anti-atherosclerosis
2.7 KEGG 通路富集分析
同样,笔者得到20 条与AS 相关的KEGG 信号通路,依据是按照P值升序排列,主要包括PI3K/AKT 信号通路、MAPK 信号通路、TNF 信号通路等,笔者用“微生信”平台处理上述信号通路,其中与AS 相关且涉及该通路的基因数用气泡大小代表示,颜色深浅代表富集显著性,见图7。
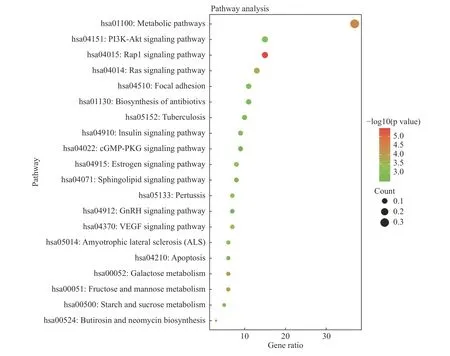
图7 灯盏乙素治疗AS 潜在靶点的KEGG 通路分析Fig.7 KEGG pathway analysis of potential targets of Scutellarin on anti-atherosclerosis
2.8 HE 染色结果
HE 染色显示,正常组小鼠主动脉内膜完整,排列紧密,中膜平滑肌细胞排列整齐,未见明显增厚的现象,无脂质沉积,无炎性细胞的浸润。与正常组相比,AS 模型组则表现出内皮细胞损伤严重,部分内膜脱落,内膜上可见大小不等的斑块,见黑色箭头。经过阳性药物阿伐他汀钙(atorvastatin calcium,ATV)治疗后,病理改变明显减少,内膜基本完整,增厚不明显,中膜平滑肌细胞增生明显减少。与AS 模型组相比,7 mg/kg Scutellarin 治疗组内膜上可见大小不等的斑块,并伴有大量的炎症细胞的浸润,平滑肌细胞排列也比较紊乱;14 mg/kg Scutellarin 治疗组内膜增厚情况减轻,泡沫细胞数量减少明显,平滑肌细胞排列整齐程度有所改善,且脂质沉积情况有所改善;28 mg/kg Scutellarin 治疗组内膜增厚程度明显减轻,泡沫细胞数量减少,中膜平滑肌细胞排列变得较为整齐,脂质沉积几乎没有出现,细胞间隙减小,见图8。

图8 HE 染色结果(200×)Fig.8 HE staining results(200×)
2.9 RT-PCR 确证差异基因的结果
RT-qPCR 结果提示,和正常组相比,模型组PI3K、AKT、mTOR 和Bcl-2 的mRNA 表达量明显升高(P<0.01);Bax 和Caspase-3 的mRNA表达量明显降低(P<0.01);和模型组相比,灯盏乙素组则呈浓度依耐性地下调PI3K、AKT、mTOR 和Bcl-2 的mRNA表达,上调Bax 和Caspase-3 的mRNA表达(P<0.05),见图9A,图9B。
2.10 ELISA 结果
和正常组相比,模型组血清TNF-α 和IL-1β 的含量明显升高,(P<0.01)。和模型组相比,灯盏乙素则呈浓度依耐性地下调小鼠血清TNFα 和IL-1β 的含量(P<0.05),见图9C,图9 D。

图9 灯盏乙素对PI3K/AKT/mTOR 信号通路及炎症因子的影响[( ),n=6)]Fig.9 Effects of Scutellarin on PI3K/AKT/mTOR signaling pathway-related genes and inflammatory factors[( ),n=6)]
3 讨论
动脉粥样硬化的病程进展与慢性炎症反应、氧化应激等病理过程密切相关,寻找有效的防治AS 的靶点有重要的临床意义。灯盏花在传统的中医中药有着悠久的民族药理历史,灯盏乙素作为一种灯盏花的主要活性成份,目前学者们正在研究其对各种组织损伤的保护作用。课题组前期研究发现灯盏乙素可通过降低胞内Ca2+浓度、促NO、释放抗脂质过氧化及调控抗氧化酶与氧化酶活性等,降低氧化应激作用保护血管内皮细胞,发挥抗动脉粥样的作用[9],然而其作用机制并不明确,同时缺乏分子水平的验证研究。因此,深入研究分析灯盏乙素抗动脉粥样硬化的作用机制,探索其潜在作用靶点,对临床应用提供重要的参考价值。
本研究采用网络药理学方法构建基于Scutellarin 的“药物-作用靶点-疾病”网络[10]。笔者的PPI 交互用网络研究结果提示,灯盏乙素与AS 的交集靶点包括LDL-R,TNF-α,AKT1等,参与机体的各种炎症和氧化应激反应过程,以上结果表明Scutellarin 可能是通过这些靶点来干预动脉粥样硬化的病程进展的。GO 功能富集分析显示BP 主要包括MAP 激酶活性的正调控、平滑肌细胞增殖的正调控、Ras 蛋白信号转导等多数与平滑肌细胞增殖,氧化应激反应等相关,推测灯盏乙素干预 AS 的病程进展与平滑肌细胞增殖等相关的生物过程密切相关。另外,KEGG结果表明,灯盏乙素可同时作用于多种与AS 疾病相关的信号通路,包括PI3K/AKT 信号通路(hsa04151)、Ras 信号通路(hsa04014)、MAPK 信号通路(hsa04010)等,其中PI3K/AKT 信号通路显著富集。大量研究表明,PI3K/AKT/mTOR 信号通路与血管平滑肌细胞的增殖和迁移密切相关[11]。白藜芦醇可通过调控PI3K/AKT 信号通路抑制此效应发生,发挥抗肺动脉高压治疗作用[12]。另有研究证实[13],磷酸化蛋白分子p-AKT、p-mTOR的过度表达可引起肺动脉平滑肌细胞的增殖。综上,灯盏乙素治疗AS 是通过多成份,多靶点,多途径发挥协同作用的,笔者发现 PI3K/AKT 信号通路参与增殖、分化、凋亡等多细胞多因子的调节功能,在细胞代谢、细胞周期调控及细胞增殖凋亡等诸多生物学过程中发挥着关键作用,因此笔者选择PI3K/AKT 信号通路作为笔者研究的靶标。
因此,结合网络药理学预测结果,笔者在APOE-/-小鼠AS 动物模型上进行RT-PCR 的验证。因为AS 动物模型是研究动脉粥样硬化病理生理机制、寻找有效药物的重要前提,选择和复制合适的动物模型是评价抗 AS 作用必不可少的研究工具[14]。笔者选择高脂饮食喂养的APOE-/-小鼠复制AS 动物模型,该模型显示了头干动脉粥样硬化伴不稳定AS 斑块的特征,被认为是研究动脉粥样硬化的理想模型[15]。在AS 整体动物模型上,RT-qPCR 的验证结果提示,Scutellarin 通过调控PI3K/AKT/mTOR 信号通路,抑制炎症反应,促进细胞凋亡。笔者的实验数据进一步确认了灯盏乙素治疗AS 的可靠性,为其进一步进入临床应用提供数据支持。
综上所述,本研究基于网络药理学的分析方法,结合有效成分、靶点预测、GO 富集分析、KEGG 分析等,从系统的角度预测了灯盏乙素治疗动脉粥样硬化的分子机制。另外,通过APOE-/-小鼠AS 模型对筛选出的靶点进行验证,确认灯盏乙素调控PI3K/AKT/mTOR 信号通路,抑制小鼠AS 模型炎症反应的过程,促进细胞凋亡,从而达到治疗AS 的目的。本研究可为将灯盏乙素研究成为自主创新和云南特色植物来源的防治AS 的药物提供理论和实验依据。
