抗菌肽LL-37 对尿路上皮细胞跨膜屏障功能破坏的作用
2022-07-31杨童欣王光徐蕊苏思维方克伟刘建和李炯明
杨童欣,王光,徐蕊,苏思维,方克伟,刘建和,李炯明
(昆明医科大学第二附属医院泌尿外科,云南 昆明 650101)
间质性膀胱炎(interstitial cystitis,IC)是一种病因不明的慢性疾病,又称膀胱疼痛综合征,以储尿期的膀胱疼痛和尿频、尿急等非特异性症状为特征[1]。流行病学研究表明,IC 的发病率大约为0.1%;近来,IC 在女性群体中的发病率上升至2%左右,其危险因素包括女性激素使用、妊娠终止、妊娠相关(膀胱压迫、尿路感染)和精神类疾病,尤其是抑郁症和恐慌症[2]。
膀胱壁尿路上皮的尿液屏障功能主要由位于膀胱粘膜层的尿路上皮细胞及存在于其细胞间隙的葡萄糖胺聚糖(glycosaminoglycan,GAG)构成,是阻碍尿液成分向尿路上皮下渗透的关键结构[3]。尿路上皮对尿液的屏障缺陷使尿液中的高渗透性物质侵入到膀胱黏膜下层次,诱发尿路上皮及其固有层炎症水肿反应[4],可能是引起IC 的主要原因。因此,研究尿路上皮尿液屏障异常的机制对IC 的临床诊断和治疗十分重要。
IC 患者膀胱壁的病理检测多表现为炎症反应和实质纤维化[5]。LL-37 是目前已知一类可由人体自身细胞合成的抗菌肽,是泌尿系统感染过程中天然的抗生素和免疫调节剂[6]。然而,已有研究证实,一定剂量的LL-37 对真核细胞具有细胞毒性[7]。尿液中如果持续存在过高浓度的LL-37,则有可能诱发炎症反应,逐步破坏尿路上皮细胞的跨膜屏障功能,导致IC/BPS 相关临床症状和病理改变出现。Martin 等[8]报道,LL-37 膀胱灌注可诱导IC 小鼠模型。
本研究团队在前期研究中已成功构建抗菌肽LL-37 诱导大鼠膀胱炎症反应模型,并证实在该模型中大鼠膀胱壁肥大细胞脱颗粒现象显著,相关炎症因子表达明显上调,说明大鼠LL-37 膀胱灌注是有效的BPS/IC 动物实验模型[9]。在本研究中,笔者进一步通过LL-37 在体外实验条件下诱导尿路上皮细胞,探讨LL-37 对尿路上皮细胞屏障功能的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞人尿路上皮永生化细胞SVHUC-1(货号:HT-X1556)购自深圳豪地华拓生物科技有限公司。
1.1.2 主要试剂F12K 培养基(货号:21127030)、胎牛血清(fetal bovine serum,FBS)购自美国Thermo Fisher;1%双抗购自武汉普诺赛生命科技有限公司;TRIzol 试剂购自美国Life Technologies;逆转录试剂盒(TIANSeq M-MLV 逆转录酶)、SYBR Green 荧光定量PCR 试剂盒(SuperReal PreMix Plus)购自北京天根生化科技有限公司;荧光定量PCR 引物自上海生工生物工程股份有限公司订制;RIPA 裂解液购自北京索莱宝科技有限公司;CCK-8 试剂盒、PVDF 膜、BCA 蛋白浓度测定试剂盒购自上海碧云天生物科技有限公司;HS3ST2、β-actin 抗体英国Abcam;抗菌肽LL-37 购自美国MCE。
1.2 实验方法
1.2.1 细胞培养将SV-HUC-1 细胞培养在含10% FBS 和1%双抗的F12K 培养基中,置于5%CO2的37 ℃细胞培养箱中常规培养24 h。
1.2.2 细胞处理及分组将SV-HUC-1 细胞分别暴露于0(对照组)、0.1、1、10、20、100、200 µg/mL LL-37 的环境中24 h,随后分别用上皮细胞跨膜电阻仪、CCK-8 和流式细胞仪检测细胞的跨膜电阻、细胞增殖活力、细胞周期和钙离子浓度。再将上述分组处理的细胞收获后,采用RTqPCR 和Western blot 检测GAGs 关键成分硫酸乙酰肝素的表达水平。
1.2.3 RT-qPCR 检测mRNA 的表达收集各组SV-HUC-1 细胞,采用TRIzol 试剂法提取各组细胞中的总RNA,再采用逆转录试剂盒获得cDNA,最后采用SYBR Green 荧光定量PCR 试剂盒配置RT-qPCR 反应96 孔板,在Applied Biosystems 7500 型定量PCR 仪上进行反应。反应条件为:94 ℃ 15 min,随后95 ℃ 10 s、55 ℃ 30 s、72 ℃32 s 循环40 次。mRNA 相对表达水平采用2-ΔΔCT法计算。以GAPDH 为内参,进行归一化处理。引物序列,见表1。

表1 引物序列Tab.1 Primer sequences
1.2.4 Western blot 检测通路蛋白表达用蛋白抑制剂修饰的RIPA 裂解液裂解SV-HUC-1 细胞,获得细胞中的总蛋白,用BCA 蛋白检测试剂盒检测蛋白质的浓度和纯度。每通道加入50 µg 蛋白质在10% SDS-PAGE 凝胶上进行电泳分离,随后转移至PVDF 膜上。室温下用含5%脱脂牛奶的TBS 溶液封闭PVDF 膜2 h,再与一抗4 ℃条件下孵育过夜。次日用TBST 缓冲液洗涤PVDF 膜3 次,随后用与辣根过氧化物酶结合的二抗在室温下孵育30 min。TBST 缓冲液再次清洗膜并用ECL 化学发光试剂处理1 min。最后使用荧光成像系统成像,利用Image J 软件分析蛋白条带灰度值并记录实验数据。
1.2.5 CCK-8 检测细胞增殖活力收集细胞,调整细胞密度为2×104个/mL 的单细胞悬液,向96 孔板中接种细胞,每孔100 µL,培养板置于37 ℃、5% CO2细胞培养箱中培养。分别在培养后的第6、12、24、36、48 h 时向每孔中加入10 µL CCK-8 溶液。继续培养2 h,通过酶标仪检测450 nm 处的吸光度值,记录实验数据。
1.2.6 流式细胞术检测细胞周期和钙离子细胞周期检测:调整细胞,在每个培养皿中加入1×105个细胞,细胞培养箱中过夜培养。PBS 清洗细胞,加入0.25%胰蛋白酶消化,收集细胞于离心管中,11000 r/min 离心6 min,弃上清。将预冷的PBS 溶液加至离心管,反复轻轻吹打细胞,清洗2 次后,将细胞收集至EP 管,同时向EP 管中加入500 µL 预冷的乙醇,混匀,4 ℃过夜孵育。取出细胞,1100 r/min 离心6min,加入预冷的PBS 洗涤,再次离心,弃上清。加入500 µLPBS重悬细胞,同时加入10 µL RNase A 溶液37 ℃孵育。30 min 后,加入5 µL PI 染液混匀,4 ℃避光孵育30 min,流式细胞仪检测细胞周期。
钙离子检测:Fluo-3 AM 用无水DMSO 溶解,向储存液中加入等20%体积的Pluronic 溶液,制得2~5 mM 的储存液。将Fluo-3 AM 溶液用HBSS 稀释制得4µM 的Fluo-3 AM 工作液。向细胞中加入Fluo-3 AM 工作液,细胞培养箱中继续培养。20 min 后向细胞中加入5 倍体积的含1%FBS 的HBSS,继续培养40 min。用HEPES 生理盐水缓冲液洗涤细胞3 次,再用HEPES 生理盐水缓冲液重悬细胞,制得1×105个/mL 的细胞悬液。置于细胞培养箱中培养10 min,流式细胞仪检测钙离子水平。激发波长为488 nm,发射波长为525 nm。
1.2.7 上皮细胞跨膜电阻测量仪检测跨上皮细胞电阻将各组细胞接种至Transwell 嵌套的6 孔培养板,电阻测量仪的电极分别插入上部空间和下部空间。将细胞培养液和空白电阻嵌套培养板电阻的和设为空白值,每隔12 h 测定跨上皮细胞电阻,当跨上皮细胞电阻值达30 Ohm cm2(Ωcm2)时开始正式测量。小心移除培养板上的液体,细胞用37 ℃预热的HBSS Hanks 洗涤3 次,向每孔中加入细胞培养液,检测各组细胞的跨上皮细胞电阻值。
1.3 统计学处理
所有实验数据采用GraphPad Prism 9.0 进行数据分析并作图。其中,2 组间比较采用Student’ st检验,多组间比较采用one-way ANOVA 检验,若ANOVA 检验差异有统计学意义则进一步采用Dunnett-t 检验进行两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 LL-37 可促进尿路上皮细胞小分子溶质屏障功能受损并抑制细胞增殖
采用不同浓度的LL-37 处理尿路上皮永生化细胞SV-HUC-1,通过上皮细胞跨膜电阻测量仪检测各组细胞的跨膜电阻,结果表明,0.1、1、10、20 µg/mL LL-37 处理对SV-HUC-1 细胞的跨膜电阻没有显著影响(对照组至20 µg/mL LL-37组TEER 值分别为 [(67.36±4.95)、(65.45±6.71)、(71.01±2.83)、(69.60±2.47)、(67.28±4.60 )] Ωcm2,100 和200 µg/mL LL-37 可显著抑制细胞的跨上皮电阻(100 µg/mL 和200 µg/mL LL-37 组TEER 值分别为[(54.42±5.66)、(41.89±3.89 )] Ωcm2,且差异有统计学意义(P<0.05),见图1A。CCK-8 检测显示,与对照组相比,SV-HUC-1 细胞的增殖活力可被100 µg/mL LL-37 显著降低(P<0.05),见图1B,在1 和10µg/mL LL-37 组中当培养至48 h 时也可见细胞的增值活力显著低于对照组。通过流式细胞术检测细胞周期,结果表明,与对照组相比[G0/G1:(31.83±1.89)%],100 和200 µg/mL LL-37 同样可显著提高SV-HUC-1 细胞处于G0/G1 期的比例 [100 µg/mL LL-37 组G0/G1:(36.62±1.63)%;200 µg/mL LL-37 组G0/G1:(36.25±2.06)%;与对照组相比(P<0.05)],见图1C、图1D。说明细胞增值受到显著抑制。
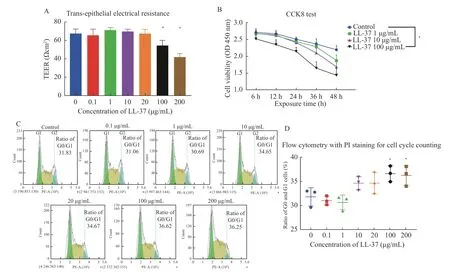
图1 LL-37 显著降低SV-HUC-1 细胞的增殖活力和跨膜电阻Fig.1 LL-37 significantly reduced the proliferative activity and transmembrane resistance of SV-HUC-1 cells
2.2 LL-37 调控膀胱尿路上皮细胞中钙离子浓度和GAGs 的产生
通过流式细胞术检测SV-HUC-1 细胞中的钙离子浓度,结果表明,LL-37 处理后的尿路上皮细胞内钙离子浓度显著升高,其中,1 µg/mL LL-37 既可使细胞内钙离子浓度升高,(104.11±55.67)vs(273.92±73.64),差异有统计学意义(P<0.05),见图2A、图2B。10 和100 µg/mL LL-37 则进一步显著提高细胞内钙离子浓度[(104.11±55.67)vs(345.45±16.95),(104.11±55.67)vs(349.73±36.92),(P<0.01)]见图2A、图2B。经RT-qPCR 检测各组细胞中GAGs 关键成分硫酸乙酰肝素的表达水平,结果显示,10 µg/mL 和100 µg/mL LL-37 组SV-HUC-1 细胞中HS3ST2 的表达显著高于对照组,其中10 µg/mL组HS3ST2 表达平均上调1.88 倍(P<0.05),见图2C,100 µg/mL 组HS3ST2 表达平均上调7.61倍(P<0.01),见图2C。再采用WB 验证HS3ST2在蛋白表达水平的差异,结果显示,与对照组相比1µg/mL 组HS3ST2 蛋白表达平均上调2.41 倍(P<0.05),见图2D。10 µg/mL 组和100 µg/mL 组蛋白表达分别平均上调3.23 倍和3.41 倍(P<0.01),图2D。

图2 LL-37 调控SV-HUC-1 细胞内钙离子浓度和GAGs 关键成分硫酸乙酰肝素的表达Fig.2 LL-37 Regulating the Intracellular Calcium Ion Concentration of SV-HUC-1 and the Expression of heparan sulfate,a key component of GAGs
3 讨论
IC 是一种以“储尿期下腹部、会阴部慢性疼痛,迫使患者反复排尿”为表现的疾病,严重时可影响患者的身心健康,降低患者的家庭和社会活动能力。由于对该疾患的发生和发展尚无清晰认识,临床工作中只能以患者的主观症状和排除其他可能疾病作为诊断依据,并给予经验性的治疗,许多患者与膀胱疼痛症状终生相伴。因此,探索和解释 IC 的病因和发病机制,从中寻找有效的治疗方法,是目前泌尿尿控亚专科发展亟待攻克的难题。
LL-37 是一种人类抗微生物肽,可由多种类型的细胞合成,包括上皮细胞和循环中性粒细胞[10],在感染相关的或感染无关的IC 患者尿液中水平升高[11−12]。LL-37 是一种高效的炎性氨基酸序列,可在尿路上皮引起细胞凋亡,诱导白细胞趋化,刺激肥大细胞脱颗粒,增强中性粒细胞功能,诱导炎性趋化因子,增加组织中的血管形成,增加细胞外基质沉积使膀胱壁纤维化[10,13]。Oottamasathien 等[12]报道,LL-37 在IC 患者中表达升高,在小鼠LL-37 剂量递增小鼠实验中,较高浓度的LL-37 会增加小鼠的IC 炎症反应,同时肥大细胞浸润明显增加。Lee 等[14]研究发现,LL-37 可迅速诱导尿路上皮细胞中ATP 的释放和细胞凋亡,GAG 类似物GM-0111 可通过阻断细胞凋亡和尿路上皮细胞释放ATP 抑制IC 的发展。
本项研究在既往动物实验的基础上[9],首次在体外实验条件下使用抗菌肽LL-37 刺激尿路上皮细胞。通过上皮细胞跨膜电阻测量和细胞内钙离子浓度测定证实了LL-37 可在体外实验条件下破坏尿路上皮细胞的跨膜屏障功能,通过CCK8试剂盒和流式细胞术细胞周期检测证实了LL-37可在体外实验条件下抑制尿路上皮细胞的增殖活性,并通过RT-qPCR 和WB 检测证实了LL-37可在体外实验条件中下调尿路上皮细胞GAGs 关键成分硫酸乙酰肝素的表达,上述特征符合IC 的临床表现。此外,通过对LL-37 不同浓度梯度条件下尿路上皮细胞GAGs 表达差异和跨膜屏障破坏程度的检测,笔者探明了适于体外研究尿路上皮跨膜屏障损伤机制的实验方案,有助于系列课题的进一步开展和对IC 病理机制的深入研究。
目前,已有报道JAK/STAT[15]、AKT/mTOR[16]、NF-κB[17]等信号通路参与调控IC 发生与发展。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)是一种丝氨酸/苏氨酸激酶,是真核生物特有的进化保守信号转导酶,C-JUN N 端激酶(JNK)是MAPK 超家族成员,是参与炎症发生的重要信号通路。JNK 可在包括氧化应激和细胞因子等刺激下被激活和磷酸化,激活的JNK 磷酸化C-JUN,促进激活蛋白AP-1 转录因子复合物的形成,这些复合物参与了多种炎症基因的形成[18−19]。Zhao 等[20]研究发现,JNK 信号通路在IC 患者中被激活,JNK、C-JUN、p-JNK、p-CJUN、IL-6 和TNF-α 表达显著增加,导致IC 中的炎症,JNK 抑制剂可有效抑制p-JNK、p-CJUN、IL-6 和TNF-α 表达,抑制IC 模型大鼠的膀胱炎,改善膀胱排尿功能。Song 等[15]研究发现,miR-132 在IC 模型大鼠膀胱组织中表达升高,抑制miR-132 可阻断制JAK/STAT 信号通路的激活,从而减少IC 大鼠胶原纤维、炎性细胞浸润和肥大细胞减少,抑制IL-6、IL-10、IFN-γ、TNFα、ICAM 1、Collagen I/III 型胶原表达,减轻IC炎性反应和膀胱逼尿肌纤维化。本课题组将利用已掌握的抗菌肽LL-37 大鼠IC 动物模型和本文中展示的体外抗菌肽LL-37 尿路上皮跨膜屏障损伤模型进一步IC 疾病的发生和发展过程进行深入研究,以期揭示IC 疾病的病理过程和转化有针对性的临床诊疗方案。
综上所述,抗菌肽LL-37 可抑制SV-HUC-1细胞内GAGs 关键成分硫酸乙酰肝素的表达,并破坏SV-HUC-1 的细胞增殖和跨膜屏障功能。对该体外细胞实验模型的进一步研究将有助于揭示IC 疾病发生过程。
