Si-GATA-3 对AR 小鼠PBMCs 中Th1/Th2细胞亚群功能的体外调节
2022-07-31李玉晓贺铭王天蓉姚永刚王雨
李玉晓 ,贺铭 ,王天蓉 ,姚永刚 ,王雨
(1)昆明医科大学第一附属医院耳鼻咽喉头颈外科,云南 昆明 650032;2)昆明医科大学基础医学院生物化学与分子生物学教研室,云南 昆明 650500;3)中国科学院昆明动物研究所动物模型与人类疾病机理重点实验室,云南 昆明 650223;4)中山大学附属第七医院耳鼻咽喉科,广东 深圳 517108)
变应性鼻炎(allergic rhinitis,AR)是特应性个体对变应原产生的主要由特异性免疫球蛋白E(immunoglobulin E,IgE)介导的鼻黏膜非感染性慢性炎症性疾病,成为全球性公共的健康问题。对患者的生活质量和劳动能力造成严重的影响,并造成严重的社会经济负担[1],AR 是哮喘的高危因素[2]。全球约10%~20%的人口罹患该病[3],我国城市的发病率在9.6%~23.9%[4]之间。临床发现近年来AR 的患病率显著增加趋势。AR 的发病机制复杂,尚不完全清楚,目前主要观点认为:AR 的发病机制是由炎性细胞、细胞因子、转录因子以及趋化因子等组成的复杂信息网络系统相互作用的结果。新近研究发现,2 型滤泡辅助性T 细胞和滤泡调节性T 细胞在IgE 的产生中起重要的调节作用,2 型先天性淋巴样细胞参与了早期2 型免疫反应[5−7]。在这复杂的炎症信息网络系统中Thl 和Th2 细胞及其相应的细胞因子可能在变应性炎症过程中起关键性作用,Th2 细胞免疫增强而Thl 细胞免疫降低,以Th2 细胞免疫反应为主的炎性反应造成变应性疾病[8]。Th1 和Th2分化与转化受多种因素影响,如局部微环境中多种细胞因子的作用、遗传背景等,其中,特异性转录因子T-bet、GATA-3 在T 细胞亚群分化过程中具有重要的调节作用。GATA-3 和IL-4 是Th2特异性转录因子和细胞因子,对Th2 型细胞因子的转录起关键作用[9−10]。T-bet 能够阻断或抑制Th2 细胞分化信号,诱导已分化的Th2 向相反的Th1 细胞方向分化,是Th1 细胞分化的特异性转录因子[11]。GATA-3 是Th2 细胞分化,增殖,存活的关键的转录因子,能促使Th2 细胞因子IL-4,IL-5,IL-13 的表达[12]。有研究[13]发现:在AR动物模型PBMCs 中GATA-3 mRNA 表达增强,Tbet mRNA 表达降低,大蒜新素能有效地降低GATA-3 mRNA 表达,增强T-bet mRNA 的表达,恢复二者的免疫平衡,改善临床症状。其他的研究[14−15]结果也发现了AR 动物模型中PBMCs 中GATA-3 mRNA 表达增强,T-bet mRNA 表达降低。因此,Th2 细胞特异性转录因子GATA-3 在变应性鼻炎的发病中可能起着关键作用,可能是未来治疗AR 的一个靶点。
慢病毒(Lentivirus)载体是以人类免疫缺陷型病毒(human immunodeficiency virus,HIV)为基础发展起来的基因治疗载体,它对分裂细胞和非分裂细胞均具有感染能力,可以在体内较长期的表达而其安全性高,是目前常用的RNA 干扰技术[16]。RNA 干扰技术多见于肿瘤疾病的研究,但鲜见于变应性疾病的研究。本研究团队[17]前期针对目的基因靶基因序列,成功制备并筛选出最佳的慢病毒介导的RNAi 载体si-GATA-3。本研究的目的是研究si-GATA-3 能否在体外有效地调节AR 小鼠外周血PBMCs 中GATA-3 mRNA 和Tbet mRNA 及其相应蛋白和相应的下游细胞因子IL-4 和IFN-γ 的表达,并纠正AR 中Th2/Th1 的免疫失衡。假定si-GATA-3 能够成功在体外纠正AR 中Th2/T1 的免疫失衡,将为今后的体内实验打下坚实的基础,并为今后AR 治疗提供一种崭新的思路。
1 材料与方法
1.1 实验材料
(1)主要试剂:Platimum HIFI Taq Polymerase、高保真扩增酶、Platinum Taq DNA Polymerase(Takara 公司,日本),100 mmol/L dNTPs(Promega公司,美国),DH5α 感受态细胞(威斯腾生物,中国 ),stbI3 感受态细胞、包装质粒Packing Mix(Sigma 公司,美国),293T 细胞(中科院上海细胞所,中国),Oligo Dt/随机引物/特异性引物(威斯腾生物,中国 ),限制性内切酶(Invitrogen公司,美国),T4 ligase 连接酶(NEB 公司,英国),慢病毒干扰载体PL/shRNA/F、Lipofectamine 2000(Invitrogen公司,美国),胎牛血清(Invitrogen公司,美国),AMV Reverase Transcriptase(Promega,美国),DNase/RNase-free,Random Primer d(N)6(上海申能博彩,中国),Trzol(Invitrogen 公司,美国),SYBR Green I(Invitrogen 公司,美国),Ficoll 400(Sigma,美国),RPMI1640 培养基(Gibco,美国),DMEM/F12 培养基(Gibco,美国),牛血清白蛋白(BSA)(Gibco,美国),台盼蓝(Sigma,美国),淋巴细胞分离液(Sigma,美国),卵蛋白(OVA)(Sigma,美国),引物(上海生工,中国),RT 试剂(威斯腾生物,中国),荧光定量PCR 试剂(威斯腾生物,中国),T-bet antibody sc-21003、GATA-3 antibody sc-9009(Santa Cruz,美国)等。(2)主要设备:荧光定量PCR 仪(FTC2000,加拿大),CO2恒温孵箱(TC2323,SHEL LAB 公司,美国),荧光倒置显微系统(BMI 3000,Leica 公司),测序仪(ABI3730,Invitrogen 公司,美国),GDS8000 凝胶扫描系统(UVP,美国),电泳仪(Bio-rad,美国),微量 DNA/RNA 定量仪(GeneGuent Pro,美国),梯度PCR 仪(Eppendorf MG,德国),紫外分光光度仪(Eppendorf MG,德国),高速恒温离心机和低温高速离心机(Beckman,美国),电子分析天平(Precisa12A,瑞士),光学倒置显微镜(Olympus AX70,日本),隔热式电热恒温培养箱(XMTH-142,中国),细胞培养箱(Shellab,美国),细胞计数板(上海医用仪器厂,中国)等。
1.2 实验方法
1.2.1 si-GATA-3 的制备根据李玉晓等[17]的文献报道的方法对抑制 GATA-3 基因慢病毒载体进行构建、包装、纯化及慢病毒病毒载体浓度滴定。
1.2.2 变应性鼻炎小鼠模型的制备实验动物:Specific pathogen-free(SPF)级BALB/C小鼠,40只(购于昆明医科大学动物中心),4~6 周龄,体重15~18 g,获得昆明医科大学动物伦理委员会批准。随机分为2 组,AR 组30 只,正常对照组10 只。小鼠在SPF 级实验室喂养1 周,观察无异常进入动物实验。
AR 小鼠模型的制备:AR 组:(30 只)致敏阶段:第1 天每只小鼠腹腔注射抗原溶液0.1% OVA 0.1 mL(OVA100 µg)+100 g/L 氢氧化铝凝胶0.2Ml(20 mg)。第7、14、21 天同样剂量、方法加强。激发阶段:致敏结束后,间歇1 周,于第27 天后的连续7 d,1% OVA 溶液20 µL 滴鼻激发,10 µL/鼻孔。
正常对照组(10 只):小鼠在致敏阶段和激发阶段,用等体积的0.9%的生理盐水代替OVA,其它同AR 模型的建立。
记录末次激发后30 min 内每只小鼠的症状积分。符合AR 模型标准[18]的进入下一阶段的实验,见表1。

表1 AR 小鼠症状评分标准Tab.1 Symptom scoring criteria for AR mice
1.2.3 si-GATA-3 载体感染AR 小鼠PBMCs(1)细胞分离方法,于末次激发结束后10 h 腹腔内注射3%戊巴比妥钠(1 mL/kg)麻醉,以眼球途径取血,血液滴入肝素抗凝管中,取足1mL 新鲜血液,加入PBS 溶液按1∶1 稀释血液;取稀释血液,在分离液上方1 cm 处沿试管壁徐徐加入,使血液重悬于淋巴细胞分离液上(血液∶分离液=2∶1);室温,水平离心2000 r/min,20 min;吸取PBMCs,加5 倍以上体积的PBS 溶液洗涤2 次,每次离心1500 r/min,10 min;弃上清液,加入1640 培养液1 mL,取少量进行细胞计数,细胞活性在95%以上;PBMCs 样本(30 个)分组:将AR 小鼠PBMCs 随机等分为3 组,即RNAi 载体(si-GATA-3 group)、空载体组(si-NC group)和阳性对照组(AR group)。正常对照组PBMCs 样本(10 个)(Control group)。
(2)细胞培养方法:将收集的PBMCs 集中于离心管中用培养液洗涤2 次,分别以2500 r/min和2000 r/min 离心各10 min,弃上清,之后进行接种。严格无菌操作。将接种后的培养瓶放CO2培养箱中,条件37 ℃、5%CO2、95%O2饱和度。从24 h 开始每24 h 添加等体积的培养液。每6~8 h 晃动1 次培养器皿。(3)si-GATA-3 转染PBMCs:①RNAi 载体组(si-GATA-3 group):将收集的AR 小鼠PBMCs,无血清培养基重悬,调整细胞密度为3~5×106/mL,装到不同的1.5 mL离心管中,每管200 µL 细胞悬液。准备病毒载体(si-GATA-3):冻存在-80 ℃的病毒载体先在冰上融化,根据慢病毒使用量参考公式:细胞感染复数MOI=慢病毒滴度×慢病毒使用量/细胞数目,按照MOI=20 进行后续试验,计算好每孔所需病毒原液量,同时加入5 µg/mL 的Polybrene 助转染试剂。混匀后将1.5 mL 管放在37 ℃、5%CO2饱和度培养箱中孵育过夜。将管中混合溶液吸出加到12 孔板里,加入足够量的新鲜培养液,500 µL/孔。8~12 h 以后观察细胞状态。细胞状态与未感染组无明显差异,表明慢病毒对细胞没有明显毒性作用,继续培养,感染72 h 后,荧光显微镜观察荧光表达情况,估计慢病毒感染目的细胞的效率;②空载体组(si-NC group):将等量的si-NC 加入AR 小鼠PBMCs 培养液中共培养;方法同①;③阳性对照组(AR group):生理盐水代替si-GATA-3 载体与AR 小鼠PBMCs 共培养,方法同①;④正常对照组(Control group):用生理盐水取代si-GATA-3 载体与正常小鼠PBMCs 共培养,方法同(1)。
对上述各组共培养的PBMCs 进行分离,分离出PBMCs 和上清液,以备用于测定PBMCs 中GATA-3 mRNA、T-bet mRNA 及其相应蛋白相对表达量以及检测上清液中细胞因子IL-4 和IFNγ 的含量。
1.2.4 GATA-3 mRNA 和T-bet mRNA 及其相应蛋白以及IL-4 和IFN-γ 的表达(1)荧光定量Q-PCR 技术测定PBMCs 中GATA-3 mRNA 和T-bet mRNA 的表达量,RNA 的提取 :用Trizol进行RNA 的提取(严格按RNA 的提取试剂盒说明)。提取的RNA-70℃保存。GATA-3 和T-bet mRNA 及内参β-actin mRNA 引物序列及大小,见表2。①反转录反应体系:2×RT buffer 10 µL,6N 随机引物(100 pmol/µL)1 µL,RT-mix 1 µL,模板(RNA)1 µL,DEPC 水 3 µL,共20 µL。反应条件:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min;②荧光定量PCR 反应体系:2×PCR buffer 25 µL,Primers(25 pmol/µL)1 µL×2,Sybr green I 0.5 µL,模板(cDNA)2 µL,DEPC 水 20.5 µL。扩增条件:94 ℃ 4 min,94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s 循环35 次,72 ℃检测信号;③用荧光定量PCR 仪进行检测。荧光定量PCR 结果用2-ΔΔCT表示目标基因的相对表达量。

表2 GATA-3 和T-bet mRNA 引物Tab.2 The primer of GATA-3 and T-bet mRNA
(2)用ELISA 法检测细胞培养上清液中细胞因子IL-4 和IFN-γ 的水平:将上述PBMCs 培养分离的上清液,再次离心。严格按ELISA 试剂盒说明检测细胞培养上清液中IL-4 和IFN-γ 的表达量。
(3)Western bloting 技术检测PBMCs 中GATA-3 和T-bet 蛋白相对表达量。目标基因的相对表达水平用目标基因与GAPDH 灰度值比率表示。
1.3 统计学处理
2 结果
2.1 慢病毒载体的制备
成功地构建了抑制 GATA-3 基因的慢病毒载体LV3-GATA3-Mus-1615(si-GATA-3),并进行了包装、纯化及慢病毒载体浓度滴定,si-GATA-3 的滴度为5×108TU/mL。LV3NC(si-NC)阴性对照(滴度为3×108TU/mL)。
2.2 AR 小鼠模型的制备
末次激发后30min 内,AR 模型组30 只小鼠中出现挠鼻、喷嚏、流涕等症状,症状积分为(7±1.2)分;而对照组小鼠上述症状均不明显,症状积分为(3±1.4)分,差异有统计学意义(P=0.002),表示造模成功。鼻黏膜病理(HE 染色)显示,AR 小鼠鼻黏膜嗜酸性粒细胞较正常对照组增多,见图1。从病理上证实造模成功。

图1 病黏膜病理(HE)。AR 组小鼠鼻黏膜中嗜酸性粒细胞较正常组小鼠增多(×200)Fig.1 Nasal mucosa pathology in normal mice and allergic rhinitis mice(×200)
2.3 si-GATA-3 的细胞转染
研究发现,si-GATA-3 感染AR 小鼠外周血PBMCs 的倒置荧光显微镜图像中有较好的转染效率,见图2A;含有GFP 的LV3NC(si-NC)的阴性对照图像,PBMCs 中仍可见大量的LV3NC 转染细胞,见图2B;使用qPCR 鉴定GATA-3 慢病毒转染效率,与对照组相比,AR+si-GATA-3 组中GATA-3 mRNA 表达量显著降低,显示si-GATA-3 有较好的PBMCs 的感染效率,见图2C。

图2 si-GATA-3 感染AR 小鼠外周血PBMCs 效率的检测Fig.2 Detection of transfecting effeciency of si-GATA-3 for PBMCs in allergic rhinitis mouse
2.4 si-GATA-3 对AR 小鼠外周血PBMCs 中GATA-3 mRNA 和T-bet mRNA 及其相应蛋白表达的调控
研究结果显示:GATA-3 mRNA 相对表达量:si-GATA-3 组GATA-3 mRNA 相对表达量明显低于AR 组和si-NC 组,AR 组和si-NC 组均明显高于正常对照组(P<0.01),但AR 组和si-NC 组相比,差异无统计学意义(P>0.05),见图3A。Tbet mRNA 相对表达量:si-GATA-3 组T-bet mRNA 相对表达量明显高于AR 组和si-NC 组,差异有统计学意义(P<0.01);AR 组和si-NC 组均明显低于正常对照组,AR 组和si-NC 组相比,差异无统计学意义(P>0.05),见图3B。Western blotting 灰度图像,si-GATA-3 组T-bet 蛋白相对表达量较AR 组和si-NC 组明显增强,均少低于正常对照组,差异有统计学意义(P<0.05),见图4A;而AR 组和si-NC 组无变化;而si-GATA-3 组GATA-3 蛋白的相对表达量较AR 组和si-NC 组明显降低,与正常对照组相比无变化,AR组和si-NC 组较正常对照组明显增强,但二组无明显变化。GATA-3 蛋白相对表达量,见图4B:si-GATA-3 组GATA-3 蛋白相对表达量较AR 组和si-NC 组明显减少,差异有统计学意义(P<0.05),AR 组和si-NC 组,差异无统计学意义(P>0.05),si-GATA-3 组与正常对照组,差异无统计学意义(P>0.05)。T-bet 蛋白的相对表达量,见图4C:si-GATA-3 组T-bet 蛋白相对表达量较AR 组和si-NC 组明显增多,差异有统计学意义(P<0.05),AR 组和si-NC 组,差异无统计学意义(P>0.05),si-GATA-3 组与正常对照组,差异无统计学意义(P>0.05)。因此,si-GATA-3 能显著上调AR 小鼠PBMCs 中T-bet mRNA 及其蛋白的表达,显著下调GATA-3 mRNA 及其蛋白的表达。si-GATA-3 能够从转录水平纠正Th2/Th1细胞免疫失衡。

图3 si-GATA-3 对AR 小鼠外周血PBMCs 中GATA-3 mRNA 和T-bet mRNA 表达的调控Fig.3 Regulation of si-GATA-3 on relative expressions of GATA-3 and T-bet mRNA in PBMCs of allergic rhinitis mouse
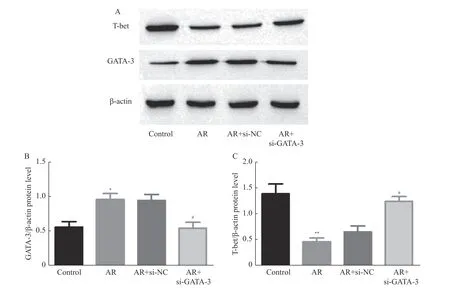
图4 si-GATA-3 对AR 小鼠外周血PBMCs 中GATA-3 和T-bet 蛋白表达的调控Fig.4 Regulation of si-GATA-3 on Relative expressions of GATA-3 and T-bet protein in PBMCs of allergic rhinitis mouse
2.5 si-GATA-3 对AR 小鼠外周血PBMCs 培养上清液中IL-4 和IFN-γ 的调控
结果显示:上清液中IL-4 含量,见图5A:AR 组与si-NC 组IL-4 含量明显高于正常对照组和si-GATA-3 组,差异有统计学意义(P<0.01),但AR 组与si-NC 组间,差异无统计学意义(P>0.05),si-GATA-3 组稍高于AR 组,差异无统计学意义(P>0.05)。上清液中IFN-γ 的含量,见图5B:si-GATA-3 组IFN-γ 的含量明显高于正常对照组,差异有统计学意义(P<0.05);AR 组与si-NC 组明显高于AR 组和si-GATA-3 组,差异有统计学意义(P<0.01)。因此,si-GATA-3 能明显下调PBMCs 中IL-4 的表达,与AR 组相比也下调了IFN-γ 表达,与正常对照组相比,明显上调了IFN-γ 表达。上述T-bet mRNA 及其蛋白的表达上调不一致。总之,si-GATA-3 能够调节Th2、Th1 细胞因子的表达,纠正Th2/Th1 细胞免疫失衡。

图5 si-GATA 对AR 小鼠外周血PBMCs 培养上清液液中IL-4 和IFN-γ 的调控Fig.5 Regulation of si-GATA-3 on Relative expressions of IL-4 and IFN-γ in supernatant of the cultured PBMCs of allergic rhinits mouse
3 讨论
变应性鼻炎(AR)是特应性体质的患者对外界致敏原所发生的变态反应的鼻部表现,其发病机制复杂且尚不完全清楚。目前研究认为Th1 和Th2 类细胞及其相应的细胞因子可能在变应性炎症过程中起关键性作用。Th2 细胞免疫增强而Thl 细胞免疫降低,以Th2 细胞免疫反应为主的炎症性反应造成变应性疾病[8]。GATA-3 是Th2细胞分化,增殖,存活的关键的转录因子,能促使Th2 细胞因子IL-4,IL-5,IL-13 的表达[12]。T-bet 是Th1 细胞分化的关键的转录因子,GATA-3 是调节Th2 细胞分化的重要的转录因子,能使Th0 细胞向Th2 细胞分化,能抑制向Th1 细胞分化,并逆转分化的Th1 细胞向Th2 细胞分化[19−20]。研究发现:季节性AR 患者鼻甲黏膜标本中FOXP3 +、GATA-3+细胞数量增多,激素能减少GATA-3+细胞数量,而T-bet+细胞数量不变,且不受花粉和鼻用激素的影响[21]。笔者研究[13]发现:在AR 动物模型中PBMCs 中GATA-3 mRNA表达增强,T-bet mRNA 表达减弱。大蒜新素能降低GATA-3 mRNA 表达,增强T-bet mRNA 的表达,恢复二者的免疫平衡,改善小鼠AR 症状。因此,笔者认为在外界致敏原的作用下转录基因GATA-3 的过表达可能是AR 发生的分子免疫学基础。其它研究结果[14−15]也证实这一结论。总之,转录因子GATA-3 可能在AR 的发病机制中起着重要作用,以Th2 细胞免疫增强为主Th1/Th2 细胞免疫失衡可能是AR 的发病机制之一。
目前AR 的治疗多以药物治疗为主,能有效控制临床症状,但用药时间长,患者依从性较差,并加重家庭和社会经济负担。免疫治疗是近年来研究的热点,疗效佳,但治疗时间较长,费用昂贵,且部分患者依从性较差,疫苗的种类较少,不能满足所有的AR 患者的需求。为探索过敏性疾病的治疗方法,一些学者进行了有益的探索。转录因子GATA-3 的反义寡链核苷酸,可以减少哮喘小鼠体内Th2 型细胞因子的产生,降低气道高反应性,减少嗜酸性粒细胞的浸润[22]。IL-5的siRNA,可以显著降低哮喘小鼠气道高反应性,降低支气管灌洗液中extonin 水平,以及肺组织中IL-5 的水平[23]。加大Th1 型相关细胞因子的表达也是改变Th 细胞平衡的方法之一,如卵清蛋白致敏小鼠内转染重组基因,可以抑制Th2 型细胞免疫反应,Th2 相关细胞因子IL-4,IL-5,血清特定IgE 水平、嗜酸性粒细胞肺含量均显著降低,气道高反应性得以抑制[24−25]。miRNA-135a 干预AR 小鼠,结果显示miRNA-135a 能增强小鼠鼻黏膜中GATA-3 mRNA 和IL-4 mRNA 及其相应蛋白的表达,减弱小鼠鼻黏膜中T-bet mRNA 和IFN-γ mRNA 及其相应蛋白的表达[26]。以上研究从不同方面纠正GATA-3 mRNA、TbetmRNA 及其相应蛋白与相应细胞因子的表达,都显示一定的调节作用,都可能通过某一途径对关键转录因子起作用,都可能作为治疗过敏性疾病的一种方法。因为T-bet 是Th1 细胞分化的关键的转录因子;GATA-3 是调节Th2 细胞分化的关键转录因子,能使Th0 细胞向Th2 细胞分化,能抑制向Th1 细胞分化,并逆转分化的Th1 细胞向Th2 细胞分化;新近的文献[27]表明调节Th2 细胞分化的机制仍不清楚,非编码RNA 可能对GATA-3 的表达起关键作用,进一步证明GATA-3 在AR 的发病机制中起重要作用。慢病毒介导的 RNAi 具有对分裂和非分裂细胞均有感染作用、容纳外源性基因片段大、感染后可以整合到受感染细胞的基因组进行长时间的稳定表达且未见病理损害现象等显著优点[28]。因此,笔者设计针对GATA-3 mRNA 的siRNA 慢病毒载体在体外干预AR 小鼠的PBMCs,研究si-GATA-3 是否能够有效调节PBMCs 中GATA-3 mRNA 与T-betmRNA及其相应蛋白的表达,进而调节IL-4 与IFN-γ的表达尚不清楚。本研究结果显示:si-GATA-3对AR 中PBMCs 无毒害,且有较高的转染效率,能显著地减弱GATA-3 mRNA 及其蛋白的表达,进而下调其下游细胞因子IL-4 的表达;能显著地增强PBMCs 中T-bet mRNA 及其蛋白的表达。但,本实验结果显示AR 小鼠PBMCs 培养液IFN-γ表达增强,与笔者以往的研究结果[13]不一致,且与本实验中T-bet mRNA 及其蛋白表达水平也不一致,究其什么原因,值得进一步研究。因此,si-GATA-3 在体外实验中能特异而有效、稳定地阻断PBMCs 中靶基因GATA-3mRNA 及其蛋白的表达,进而减少IL-4 的表达,逆转了Th2 细胞的过表达,同时增强了Th1 细胞特异性转录因子Tbet mRNA 的表达,进而增强T-bet 蛋白的表达,从特异性转录纠正了以Th2 细胞免疫增强为主的Thl/Th2 细胞免疫失衡。这也为进一步研究si-GATA-3 能否体内调节AR 小鼠PBMCs 中的GATA-3 mRNA 与T-betmRNA 及其相应蛋白的表达打下坚实的实验基础,提供理论依据。
本研究创新之处是:根据Thl 和Th2 细胞特异性转录因子T-bet 和GATA-3 在特定的条件下能相互抑制对方的表达的特性,笔者利用si-GATA-3 在体外对AR 小鼠PBMCs 进行干预,研究si-GATA-3 是否能同时调节GATA-3mRNA、T-bet mRNA 及其相应蛋白的表达,结果显示,si-GATA-3 能同时调节GATA-3mRNA、T-bet mRNA及其相应蛋白的表达,纠正Thl/Th2 细胞免疫失衡,这与以往文献[22−26]报道的通过某一途径对关键转录因子起作用不同。
总之,si-GATA-3 在体外能够有效地抑制AR 小鼠PBMCs 中GATA-3 mRNA 及其蛋白的表达,进而减少IL-4 的表达;增强T-betmRNA 及其蛋白的表达,纠正以Th2 细胞免疫增强为主的Th1/Th2 细胞免疫失衡。利用RNA 干扰技术对AR 发病机制中起关键作用的过表达基因进行有效的基因沉默,恢复免疫平衡,以达到免疫治疗的目的,为AR 患者提供一种新的治疗思路和方法,为临床从基因水平进行免疫治疗提供理论依据。si-GATA-3 在体内能否有效的调节AR 小鼠BMCs 中GATA-3 mRNA、T-bet mRNA 及其相应蛋白的表达,恢复免疫平衡,消除临床症状,仍有待继续研究,为探索对人AR 从基因水平进行临床免疫治疗提供理论基础。
