促成骨细胞增殖活性骨胶原蛋白肽的靶向筛选及活性分析
2022-07-29陈永凯郭玉杰张鸿儒张春晖
陈永凯,郭玉杰,2,张鸿儒,刘 泓,张春晖,*,姜 珊
(1.中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193;2.新疆泰昆集团有限责任公司,新疆 昌吉 831100;3.内蒙古阿荣旗牧原康肽实业有限公司,内蒙古 呼伦贝尔 162750)
酶解法制备的骨胶原蛋白肽为混合肽,通常具有抗高血压、抗骨质疏松、抗氧化和促进伤口愈合等多种潜在的生理功能。影响肽生物活性的主要因素包括一级结构(氨基酸的排列和组成)和肽链长度等,例如牦牛骨胶原蛋白肽GPAGPPGPIGPV(GP-12)能显著促进成骨细胞增殖,而GPAGPAGPR(GP-9)和GEKGETGLR(GE-9)对成骨细胞增殖起抑制作用。在骨胶原蛋白分子的三股螺旋(2 条α肽、1 条α链)结构中,甘氨酸(Gly)是其特征氨基酸,与其他两个氨基酸残基(多为Pro和Hyp)共同构成(Gly-X-Y)的特征序列结构,可能是解析其生物活性的潜在“策略区”。因此,有必要进一步挖掘骨胶原蛋白肽的结构信息与促成骨细胞增殖活性之间的关系,为促成骨细胞增殖活性肽的定向制备提供参考。
活性肽构效关系的研究方法涉及体内实验、体外实验和虚拟筛选三大领域。体内实验主要依靠建立动物模型,但成本高、周期长,常用作活性研究的最后一步。Yamada等前期研究发现牛乳酪蛋白肽MKP具有血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性,进一步通过建立自发性高血压大鼠模型发现,三肽MKP能经小肠吸收进入血浆,显著降低高血压大鼠的收缩压。体外实验主要包括化学实验、酶相关实验和细胞培养实验等,可直接验证肽的生物活性,但不适合初期大规模筛选,多与其他分离纯化技术联用。颜阿娜等采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验,结合高效液相色谱(high performance liquid chromatography,HPLC)法成功鉴定出了黑鲨鱼皮抗氧化肽PGGTM。计算机辅助虚拟筛选技术可有效弥补体内实验和体外实验的不足,提高筛选效率,常见的虚拟筛选方法包括定量-构效关系(quantitative structure-activity relationship,QSAR)建模、数据库检索和分子对接等。在筛选促成骨细胞增殖活性肽的相关研究中,可将肽与表皮生长因子受体(epidermal growth factor receptor,EGFR)进行半柔性对接,以对接能(CDOCKER energy,CE)评价其潜在的促增殖活性,此法在促成骨细胞增殖牛骨胶原蛋白肽和乳铁蛋白肽的筛选中均取得了良好的效果。
牦牛是我国珍贵的畜牧资源,牦牛屠宰产生的骨副产物质量约占胴体质量的20%~30%,但综合利用却严重不足,现已证实牦牛骨胶原蛋白肽具有良好的成骨活性,能显著改善去卵巢骨质疏松大鼠模型症状。本研究采用酶法制备牦牛骨胶原蛋白肽,通过CDOCKER分子对接技术靶向筛选作用于EGFR的促成骨细胞增殖活性肽段,基于体外细胞增殖培养验证其活性并阐释与EGFR的结合机制,以期为促成骨细胞增殖活性肽的靶向筛选和工业化制备提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜牦牛腿骨由西藏农牧学院提供;牦牛骨胶原蛋白肽由北京华大蛋白质研发中心有限公司合成,经鉴定纯度均大于98%;小鼠前成骨细胞系MC3T3-E1细胞购自武汉普诺赛生命科技有限公司。
乙腈(质谱级) 美国Fisher Chemical公司;甲酸(质谱级)、三氟乙酸(色谱级) 美国Sigma-Aldrich公司;CCK-8溶液 北京索莱宝科技有限公司;复合蛋白酶 丹麦Novozymes公司。
1.2 仪器与设备
中试生产装备(包括破骨机、工业纯水机、蒸煮罐、静置罐管式冷却器、管式分离机、碟式分离机、脱色罐、单效蒸发器、喷雾干燥机) 上海本优机械有限公司;1260-II型HPLC仪 美国Agilent公司;Ultimate 3000型毛细管HPLC仪、电喷雾-组合型离子阱质谱仪、Multiskan FC型酶联免疫检测仪 美国Thermo Fisher Scientific公司;Infinite M200型恒温培养箱 瑞士Tecan公司。
1.3 方法
1.3.1 牦牛骨胶原蛋白肽制备流程
牦牛骨破碎→冲洗血污→热压提取(135 ℃、3 h)→静置分层(1.5 h)→酶解脱色(1.5 AU/g复合蛋白酶,56 ℃、4.5 h)→喷雾干燥(进风温度190 ℃、出风温度80 ℃)
1.3.2 牦牛骨胶原蛋白肽分子质量分布测定
参考Ye Mengliang等的方法并稍作修改,采用HPLC法测定牦牛骨混合肽分子质量分布,配制质量浓度为5.0 mg/mL的标准品甘氨酰肌氨酸(146 Da)、甘氨酰甘氨酰酪氨酰-精氨酸(451 Da)、杆菌肽(1 422 Da)、抑肽酶(6 511 Da)、细胞色素c(12 327 Da)以及牦牛骨混合肽溶液,经0.22 μm膜过滤,待用。色谱条件:TSK gel G2000 SWXL柱(7.8 mm×300 mm),柱温30 ℃,进样量10 μL,进样3 次,流速1.0 mL/min,流动相为含45%(体积分数,下同)乙腈和0.1%三氟乙酸的超纯水溶液,采用等梯度洗脱,洗脱时间为20 min,于214 nm波长处测吸光度,以标准品分子质量对数(lg)为纵坐标,保留时间()为横坐标建立标准曲线,采用手动积分的方式测定不同分子质量活性肽的占比。
1.3.3 牦牛骨胶原蛋白肽序列测定
采用纳米液相色谱-串联质谱(nano liquid chromatogram-tandem mass spectrometry,nano LC-MS/MS)测定牦牛骨胶原蛋白肽序列。
1.3.3.1 液相分离条件
预柱:Acclaim PepMap RPLC C柱(5 mm×300 μm,5 μm);分析柱:Acclaim PepMap RPLC C柱(150 mm×150 μm,5 μm);流动相A:0.1%甲酸+2%乙腈;流动相B:0.1%甲酸+80%乙腈;流速:600 nL/min;梯度洗脱条件:0~5 min,6%~9% B;5~20 min,9%~14% B;20~50 min,14%~30% B;50~58 min,30%~40% B;58~60 min,40%~95% B。
1.3.3.2 质谱分析条件
采用正离子扫描模式;设定毛细管温度320 ℃、毛细管喷射电压2 300 V。一级质谱参数:分辨率:70 000;AGCtarget:3×10;MaximumIT:40 ms;扫描范围:350~1 800/。二级质谱参数:分辨率:75 000;AGCtarget:1×10;MaximumIT:60 ms;Top N:20;NCE/stepped NCE:27。
1.3.3.3 数据库检索
使用Maxquant 1.6.2.10平台分别检索目标多肽。
1.3.4 EGFR和多肽前处理
从Protein Data Bank(PDB)数据库(http://www.rcsb.org/)下载EGFR-表皮生长因子(epidermal growth factor,EGF)(PDB编号:1IVO)复合物结构,采用Discovery Studio 2019软件删去原配体EGF和水分子,添加氢原子,补充非完整的氨基酸残基并模拟缺失的loop区域;分别绘制牦牛骨肽的一级序列,添加CHARMm力场,采用Smart Minimizer算法对其进行能量最小化处理,最大步数设定为2 000 步,RMS梯度值设为0.01。
1.3.5 活性口袋确定
以EGF和EGFR的结合位点为对接位点,设定活性口袋半径为22,将原配体结合区域完全包裹。
1.3.6 分子对接
定义经过前处理的多肽为配体,EGFR为受体,使用Discovery Studio 2019软件的CDOCKER半柔性对接方式进行分子对接,仅保留一个CE最低的构象。以具有促成骨细胞增殖活性的牦牛骨胶原蛋白肽GDRGETGPAGPAGPIGPV(GD-18)和GPSGPAGKDGRIGQPG(GP-16)为阳性对照,选取CE较阳性肽CE差值大于20 kcal/mol的多肽用于后续研究。
1.3.7 多肽合成
参考Xu Zhe等的方法,采用固相合成技术合成牦牛骨胶原蛋白肽GP-18、TP-14、GP-17、GK-21和GK-22,HPLC-MS检验纯度,均大于98%。
1.3.8 多肽促成骨细胞增殖活性验证
参考 Zhu Lingyu等的方法并稍作修改,将小鼠前成骨细胞系MC3T3-E1细胞以2×10个/mL、每孔100 μL接种于96 孔板中,恒温培养24 h后移去原培养基,随后配制系列质量浓度梯度的多肽溶液,以每孔200 μL加入96 孔板中,在温度为37 ℃、CO体积分数为5%的恒温培养箱中连续培养48 h,空白组加入等体积培养基,采用CCK-8法测定增殖率,每组实验做4 次平行。按下式计算前成骨细胞的相对增殖率。
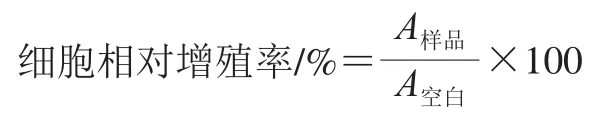
式中:为样品溶液的吸光度;为空白组溶液的吸光度。
1.4 数据处理与分析
本实验采用SPSS 22.0软件进行Duncan方差分析,设定显著性水平<0.05或<0.01,结果以平均值±标准差的形式表示;绘图软件为Origin 2016。
2 结果与分析
2.1 牦牛骨胶原蛋白肽分子质量分布
标准品分子质量的对数lg与保留时间呈现良好的线性关系(=0.979 4),说明测定结果具有较高的可信性。根据GB 31645—2018《食品安全国家标准 胶原蛋白肽》的定义,胶原蛋白肽是指以富含胶原蛋白的新鲜动物组织(包括皮、骨、筋、腱、鳞等)为原料,经过提取、水解、精制生产的,分子质量低于10 000 Da(质量分数不低于90%)的产品。如图1所示,分子质量小于3 000 Da的肽段占91.8%,其中小于1 000 Da的占69.2%,说明该批肽粉符合国家标准。
研究发现,低分子质量的牛骨胶原蛋白肽(<3 000 Da)、牦牛骨胶原蛋白肽(<3 000 Da)以及猪骨胶原蛋白肽(<1 000 Da)均能显著促进MC3T3-E1细胞增殖,发挥成骨活性。因此,本实验制备的牦牛骨胶原蛋白肽可能具有开发成为抗骨质疏松功能食品的潜在价值,故进行后续实验。
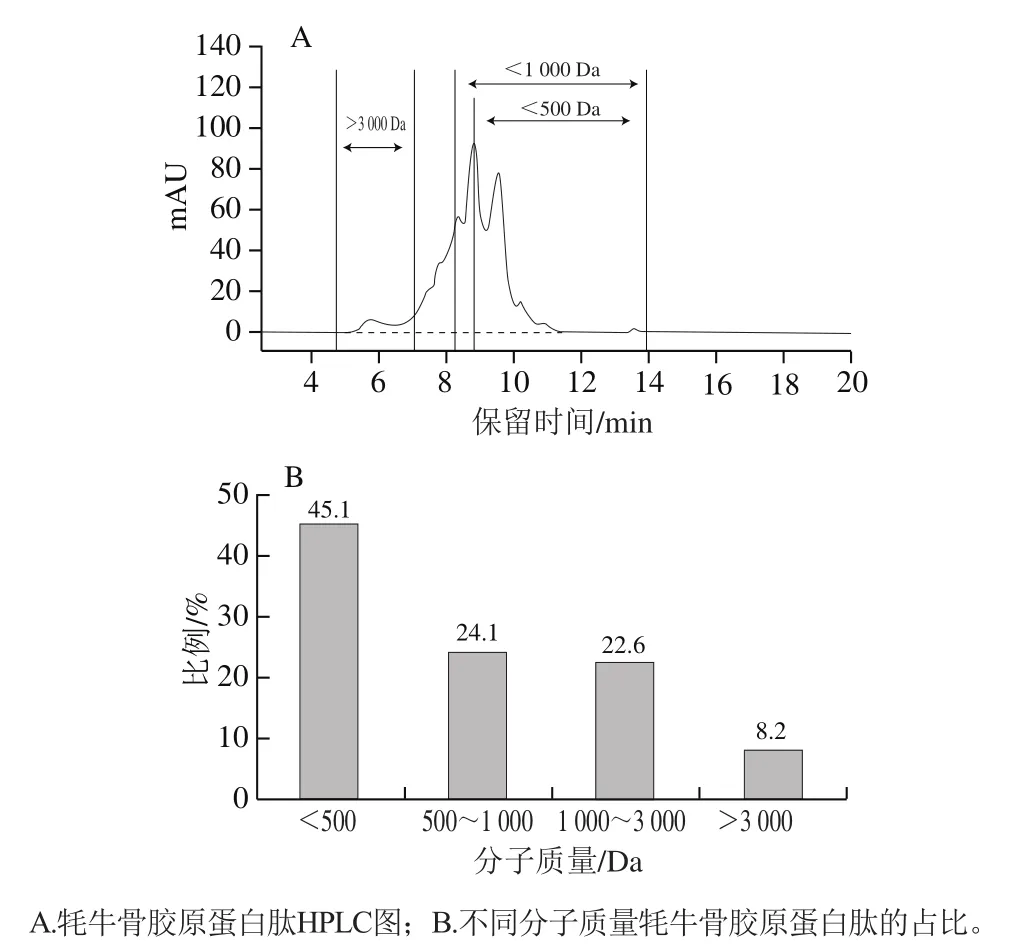
图1 牦牛骨胶原蛋白肽分子质量分布Fig. 1 Molecular mass distribution of yak bone collagen peptides
2.2 牦牛骨胶原蛋白肽序列分析
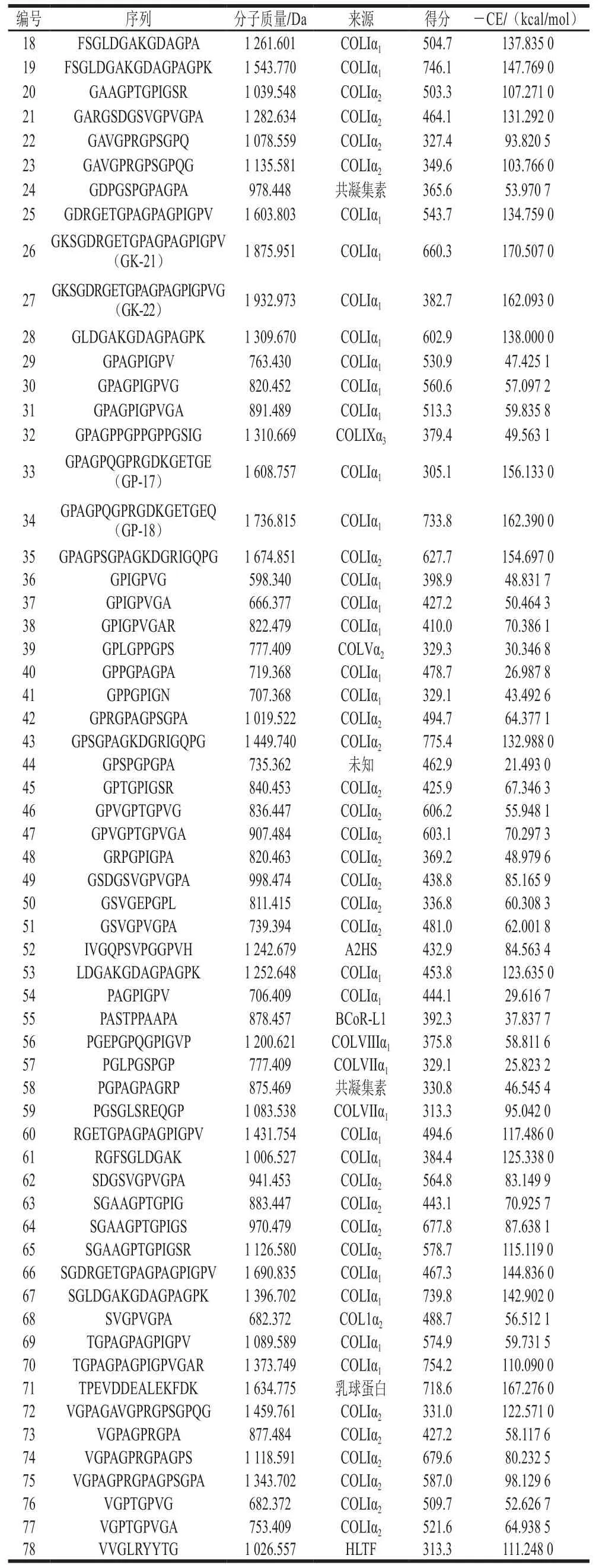
胶原蛋白呈现典型的三股螺旋结构,具有良好的生物相容性且易于加工利用。自然界中共存在28种胶原蛋白,其中I型胶原蛋白含量最高,广泛分布于动物的皮肤、骨骼和肌腱等部位。如表1所示,本实验中从牦牛骨胶原蛋白肽中共鉴定得到78 条肽段,其中I型胶原蛋白肽占比为82.0%,来源于α链和α链的肽分别占I型胶原蛋白肽总量的45.3%和54.7%,并且其序列均与胶原蛋白的(Gly-X-Y)特征序列相吻合,表明鉴定结果具有较高的可靠性。

表1 牦牛骨胶原蛋白肽序列及分子对接结果Table 1 Yak bone peptide sequences and their -CDOCKER energy(-CE) values
续表1
值得注意的是,分子质量分布测定结果表明混合肽中有大约45.1%的肽分子质量小于500 Da,根据里宾斯基五规则,分子质量小于500 Da的化合物往往具有较高的生物利用度和较好的药物代谢动力学性质,更易开发成为口服药物,但本实验鉴定的分子质量小于500 Da的肽只有一条——FSGL(422.224 Da)。导致质谱对小肽鉴定能力差的原因可能是太小的片段在分离中不容易获取,或者组分间性质差异小,无法区分。
2.3 分子对接实验结果
EGFR是受体酪氨酸激酶(receptor tyrosine kinase,RTK)家族的成员,在无配体时,EGFR胞外域的第II亚结构域和第IV亚结构域会形成分子内“铰链”,形成自抑制状态;当配体与胞外域结合后,EGFR构象改变并发生二聚化,启动下游信号通路,促进细胞增殖或分化。研究表明,以EGFR为受体,通过CDOCKER对接获得的乳铁蛋白肽ENLPEKADRDQYE、牛骨胶原蛋白肽HHGDQGAPGAVGPAGPRGPAGPSGPAGKDGR和GPAGANGDRGEAGPAGPAGPAGPR具有显著的促成骨细胞增殖活性。在小分子配体与大分子受体对接研究中,可用-CE表示受体和配体亲和力的大小,-CE越大,受体与配体结合越稳定。如表1所示,将鉴定的多肽与EGFR对接后,-CE的变化范围从21.493 kcal/mol到170.507 kcal/mol,其中阳性肽GD-18和GP-16的-CE分别为134.759 kcal/mol和132.988 kcal/mol。-CE比阳性肽高20 kcal/mol以上的多肽共有5 条,分别为GP-18(162.390 kcal/mol)、TP-14(167.276 kcal/mol)、GK-21(170.507 kcal/mol)、GK-22(162.093 kcal/mol)和GP-17(156.133 kcal/mol),除TP-14来源于-乳球蛋白以外,其余均来自于I型胶原蛋白的α链。
2.4 促成骨细胞增殖活性分析
本实验采用CCK-8法测定MC3T3-E1细胞相对增殖率,CCK-8法较其他常见的检测方法具有结果稳定、灵敏度高、重复性好等优势。如图2所示,将细胞在多肽质量浓度分别为0.1、0.5、1.0 mg/L和3.0 mg/mL条件下分别培养48 h,发现当质量浓度不低于1.0 mg/mL时,所有多肽均无显著的促MC3T3-E1细胞增殖活性,GP-17、GP-18和TP-14甚至能抑制细胞增殖;当质量浓度为3.0 mg/mL时,GK-22能显著促进MC3T3-E1细胞的增殖(相对增殖率为106%),并且表现出剂量-效应关系,说明GK-22序列可能是促进MC3T3-E1细胞增殖的特征性序列,具有潜在的研究价值。值得注意的是,GK-21的序列仅与GK-22相差一个末端Gly残基,却无显著的促增殖活性,因此末端Gly残基对GK-22的促成骨细胞增殖具有重要意义。

图2 MC3T3-E1细胞增殖率测定结果Fig. 2 Determination of MC3T3-E1 cell proliferation
2.5 不同多肽与EGFR的结合机制
配体与EGFR亲和力的差异会导致EGFR产生不同的二聚化构象,继而引发细胞增殖或分化。上皮调节蛋白(epiregulin,EREG)等弱亲和力配体会诱导细胞分化而抑制增殖;EGF等强亲和力配体作用效果相反,某些拮抗剂可以与EGFR胞外域结合,进而掩盖配体的结合位点,致使EGFR内部酪氨酸激酶激活过程受阻,细胞增殖受到抑制。如图3和表2所示,GK-22与EGFR的非键相互作用主要为氢键和疏水相互作用,可与EGFR的Lys13、Leu14和Thr15形成5个氢键(包括常规氢键和碳氢键,与Lys13和Thr15各形成2个氢键),与Leu17和His409分别形成烷基相互作用和π-烷基相互作用。同时,阳性肽GP-16也与EGFR的Lys13和Thr15形成氢键;GD-18与Thr15形成氢键,与Leu17和His409形成烷基相互作用,提示GK-22可能与两者存在相似的促成骨细胞增殖机制。而分子对接结果表明GK-21与EGFR的亲和力高于GK-22,并且可与Leu14、Thr15、Gln16、Leu17、Tyr45和Gln384形成氢键,与Leu17、Leu325、His346和His409形成疏水相互作用,除Lys13外,涵盖了GK-22与EGFR的所有结合位点,却未与GK-22一样表现出促增殖活性,原因有待进一步研究。GP-17、GP-18和TP-14与EGFR的非键相互作用除氢键和疏水相互作用外,还包括静电相互作用。GP-17与EGFR形成8个氢键、1个电荷相互作用、1个烷基相互作用;其中EGFR的Asp355残基与之形成4个氢键(含2个碳氢键、1个常规氢键、1个盐桥)、1个电荷相互作用,是两者结合的关键氨基酸残基。GP-18与EGFR形成9个氢键、1个π-烷基相互作用、1个电荷相互作用;TP-14与EGFR形成10个氢键,1个π-阳离子相互作用、1个烷基相互作用。因此,GK-22可能是EGFR的强亲和力配体,而对MC3T3-E1细胞增殖发挥抑制作用的GP-17、GP-18和TP-14可能是EGFR的弱亲和力配体,或者其作为EGFR的拮抗剂,使正常配体的结合过程受阻。综上,不同多肽对MC3T3-E1细胞增殖产生不同效应的原因可能是与EGFR的结合机制存在差异。

图3 不同多肽与EGFR的非键相互作用Fig. 3 Non-bond interactions between different polypeptides and EGFR

表2 多肽与EGFR的结合位点Table 2 Interaction sites between polypeptides and EGFR

续表2
3 结 论
骨胶原蛋白经复合酶酶解可获得低分子质量(<3 000 Da)的混合肽,但发挥促成骨细胞增殖活性的肽序列尚不明确。本研究采用nano LC-MS/MS技术测定混合肽序列,以牦牛骨胶原蛋白肽GD-18和GP-16为阳性对照,通过CDOCKER半柔性对接技术筛选获得具有潜在促成骨细胞增殖活性的牦牛骨胶原蛋白肽GP-18、TP-14、GP-17、GK-21和GK-22,体外细胞增殖培养实验进一步表明,GK-22可通过与EGFR结合,发挥促成骨细胞增殖活性。综上,基于以EGFR为受体的CDOCKER半柔性对接技术,可实现促成骨细胞增殖活性骨胶原蛋白肽的靶向筛选。
