Notch信号通路中受体及配体在胃癌组织中的表达及意义
2018-09-03黄博金国荣屈重霄马海宁丁彩云
黄博 金国荣 屈重霄 马海宁 丁彩云



摘 要 目的:检测了Notch信号通路中各受体及配体在胃癌中的表达,探讨Notch信号通路在胃癌发生发展中的作用。方法:应用实时荧光定量PCR法检测了NOTCH1/2/3/4、JAG1/2、DLL1/3/4在12 例正常胃黏膜组织中的表达情况及在胃癌组织中的异常表达情况;应用免疫印迹法检测了NOTCH1在对应胃癌/癌旁组织中的表达。结果:在正常组织中受体NOTCH2和配体JAG1的表达水平较高,其余表达水平较低;在胃癌组织中,NOTCH1/3/4和JAG2的表达水平明显提高,而其他受体和配体的表达水平变化不明显。NOTCH1蛋白在胃癌组织中的表达较癌旁组织明显增高。结论:Notch信号通路中部分受体及配体在胃癌组织中表达明显提高,Notch信號通路参与了胃癌的发生发展。
关键词 胃癌 Notch信号通路 受体 配体
中图分类号:R735.2; R730.231 文献标志码:A 文章编号:1006-1533(2018)15-0057-05
Expressions of the receptors and ligands in Notch signaling pathway in gastric cancer tissues*
HUANG Bo1**, JIN Guorong2, QU Chongxiao3, MA Haining1, DING Caiyun2
(1. Department of General Surgery, 2. Central Laboratory, 3. Department of Pathology, Shanxi Provincial Peoples Hospital, Taiyuan 030012, China)
ABSTRACT Objective: To detect the expressions of receptors and ligands in Notch signaling pathway in gastric cancer tissues and to explore the role of Notch signaling pathway in the occurrence and development of gastric cancer. Methods: The expression levels of NOTCH1/2/3/4, JAG1/2 and DLL1/3/4 in normal gastric tissues and the aberrant expression levels in gastric cancer tissues were studied by real-time RT-PCR. The expression of NOTCH1 protein in gastric cancer or adjacent non-tumor tissues was detected using Western Blotting. Results: The expressions of NOTCH2 and JAG1 were relatively high in normal gastric tissues while the others were relatively low. The expressions of NOTCH1/3/4 and JAG2 were significantly increased in gastric cancer tissues as compared with normal gastric tissues while other receptors and ligands showed little differences. The expression of NOTCH1 protein was significantly higher in gastric cancer tissues than adjacent non-tumor tissues. Conclusion: The expressions of a part of receptors and ligands in Notch signaling pathway are significantly increased in gastric cancer tissues, showing that Notch signaling pathway is involved in the occurrence and development of gastric cancer.
KEY WORDS gastric cancer; Notch signaling; receptor; ligand
胃癌是一种发生于胃黏膜的恶性肿瘤,是消化道常见的癌症之一,其病死率居常见肿瘤病死率的第3位[1]。世界胃癌患者中有超过70%来自发展中国家,其中中国的胃癌发生率最高[2]。目前外科手术是胃癌治疗的主要方法,随着化疗、放疗、免疫治疗的进步,以及以手术为主的多学科团队(MDT)的综合治疗的发展,胃癌的治疗取得了一定的进步,但并没有从根本上改变胃癌高死亡率的现状,其总体生存率和无瘤生存率仍然很低。因此,迫切需要对胃癌进行更深入的研究,寻找治疗胃癌更灵敏的分子生物标记物,为胃癌的诊断和治疗提供新的突破口。
Notch信号通路在进化上保守,参与许多细胞进程包括增殖、分化、凋亡和干细胞维持等[3]。在哺乳动物中,有四个Notch受体(NOTCH1/2/3/4)和五个配体(Jagged(JAG) 1/2,Delta-like ligand (DLL) 1/3/4),这些受体和配体的精确调控,对大多数组织的正常发育至关重要,其异常调控可引起组织发育异常,甚至导致肿瘤的发生[4]。大量研究表明Notch信号通路在癌症的发生发展过程中有重要作用,但是其在胃癌发生发展进程中的作用尚存在争议。有研究表明NOTCH1在胃癌中表达较正常组织明显上调,并与肿瘤的大小、分化程度、浸润程度显著相关[5]。NOTCH1配体JAG1表达上调的胃癌患者预后差、生存率低[6]。单因素生存分析结果发现,NOTCH1阳性组预后较阴性组差,多因素生存分析结果显示,NOTCH1表达是影响胃癌预后的独立因素[7]。但仍有另外研究表明NOTCH1在胃癌中可能发挥抑癌作用,NOTCH1在胃癌组织中表达下调,NOTCH1的表达对胃癌的预后有积极作用[8]。因此,目前对Notch信号通路在胃癌中的作用没有得到完全阐明。本研究选择Notch信号通路为研究对象,检测了Notch信号通路各受体及配体在胃癌中的表达及作用,以期获得更多Notch信号通路参与胃癌的证据,为胃癌的早期诊断和靶向治疗提供分子依据。
1 材料与方法
1.1 一般资料
收集山西省人民医院2016年6月至2016年10月间胃癌根治术所获得的胃癌及癌旁组织标本12组。所有胃癌患者均经病理检查证实为胃部恶性肿瘤,并排除并发其他疾病,且术前均未接受任何形式的放化疗及靶向治疗,患者均为散发病例,无家族史。其中男9例,女3例,平均年龄(57.6±11.6)岁。组织学分化等级为低分化5例,中低分化4例,中分化3例。同时选择切缘部癌旁组织为对照,均经病理证实为正常胃黏膜组织。
1.2 主要试剂和仪器
RNA提取试剂盒(柱式总RNA抽提试剂盒,上海生工工程有限公司);反转录试剂盒(PrimeScript? RT Master Mix (Perfect Real Time),宝生物工程(大连)有限公司);实时荧光定量PCR试剂盒(SYBR? Premix Ex Taq? II (Tli RNaseH Plus),宝生物工程(大连)有限公司);组织蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE电泳试剂盒、ECL显影试剂盒(博士德生物)。PCR使用的引物由华大基因合成,引物序列见表1。NOTCH1抗体(ab52627,美国Abcam公司)。实时荧光定量PCR仪(CFX96,美国Bio-Rad公司)。
1.3 实时荧光定量PCR


1.4 蛋白质印迹法
将组织标本于液氮中速冻后进行研磨,使用RIPA裂解液进行裂解,离心后取上清即为组织蛋白。使用BCA法在多功能读数仪上测定蛋白浓度。制备5%浓缩胶、10%分离胶的SDS-PAGE凝胶,取50 μg蛋白上样进行SDS-PAGE凝胶电泳。然后,使用电转仪将凝胶上的蛋白转印至PVDF膜。使用5%脱脂奶粉封闭PVDF膜。使用NOTCH1抗体、GAPDH抗体一抗孵育过夜,TBS洗涤5 min×3次。使用偶联辣根过氧化物酶的二抗孵育1 h,TBS洗涤5 min×6次。最后,使用增强化学发光法(ECL)显色,在成像系统(ChemiDoc XRS+,美国BioRad公司)中摄影。
1.5 统计学分析
2 结果
2.1 Notch信号通路受体及配体在正常组织及胃癌组织中的表达量比较
实时荧光定量PCR的结果显示:在正常组织中,与β-actin相比,Notch信号通路各受体及配体的表达参差不齐,其中4个受体中NOTCH2的表达水平较高,其余表达水平较低;5个配体中,JAG1的表达水平较高,JAG2的表达水平较低,其余居中(图1)。
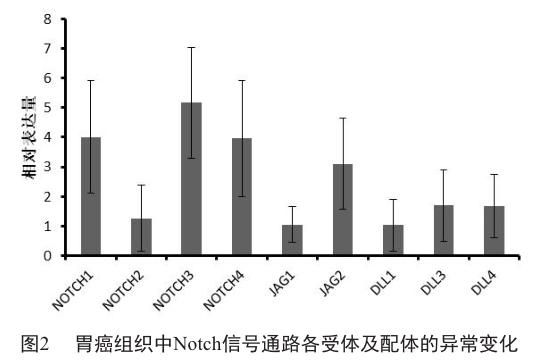
在胃癌组织中,与正常组织相比,Notch信号通路各受体及配体的表达发生了不同程度的变化。其中3个受体(NOTCH1/3/4)的表达水平明显提高,而NOTCH2的表达水平变化不明显。配体中JAG2的表达水平明显提高,而其他配体的表达水平的变化不明显(图2)。在正常胃组织中表达比较高的基因,在胃癌发生后,其变化不很明显;但是在正常胃组织中表达较低的基因,在胃癌发生后其表达却显著提高。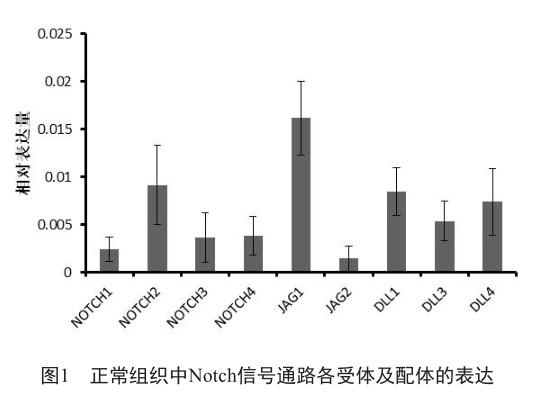
2.2 NOTCH1在胃癌/癌旁组织中的表达
使用蛋白质印记法进一步验证NOTCH1蛋白在胃癌、癌旁组织中的表达。结果显示:在6对胃癌/癌旁组织中,NOTCH1在其中4例胃癌组织中的表达均明显高于相应的癌旁组织(P2、P4、P5、P6),在2例胃癌组织中的表达与相应的癌旁组织没有明显差异(P1、P3)(图3)。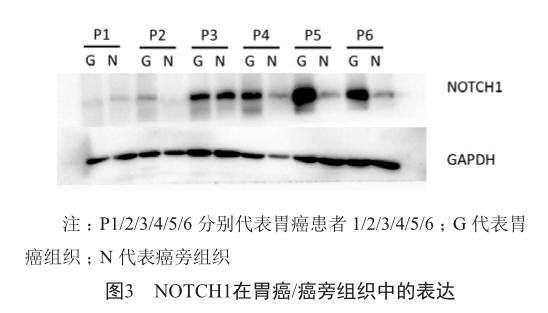
使用荧光定量PCR法证实NOTCH1在胃癌组织中的表达明显高于癌旁组织,差异具有统计学意义(P<0.05)(图4)。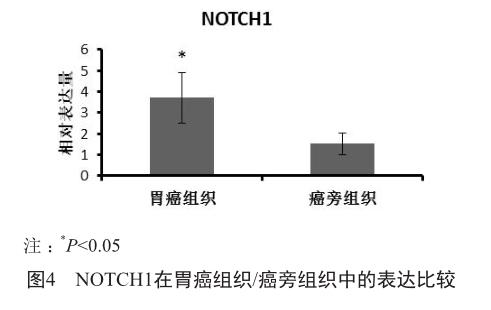
3 讨论
1991年,NOTCH1在人急性T淋巴细胞白血病中被鉴定出来,首次提示Notch信号通路与肿瘤相关[10]。越来越多的证据表明Notch信号通路不仅是血液系统恶性肿瘤的原因,其在实体瘤如乳腺癌、结肠癌、胰腺癌、前列腺癌等中也起着关键作用[4]。研究发现,Notch信号通路在胃癌的发生发展中也发挥着重要作用[11]。来自不同的研究表明,Notch信号通路各受体及配体在胃癌的进程中发挥不同的作用。例如,对876个胃癌病人长达20年的随访研究发现,NOTCH1/2/3/4的高表达与总生存期存在负相关[12]。NOTCH1在胃癌中的表达越高,其分化程度越低[13]。此外,NOTCH1的高表达还与胃癌的肿瘤浸润深度、淋巴结转移、Lauren分型有关[5]。JAG1被认为是胃癌独立的预后预测因子,它的阳性表达提示與预后不良有关[14]。JAG2和NOTCH3的表达在肠型胃癌中明显升高,其表达升高不仅与胃癌的发展有关,还与肠/腺型分化有关[15]。DLL1在胃癌中出现异常甲基化和高表达[16]。DLL4的过表达促进了胃癌干细胞的自我更新能力同时还与临床结局有关[17]。
本研究發现,在正常胃黏膜组织中,Notch信号通路中的各受体和配体的表达参差不齐,其中NOTCH2和JAG1表现出较高的表达水平。但有趣的是,在正常胃组织中表达比较高的NOTCH2和JAG1,在胃癌组织中的表达水平相当,没有发生明显变化;反而是在正常胃组织中表达较低的NOTCH1/3/4和JAG2,在胃癌发生后其表达显著提高,说明NOTCH1/3/4和JAG2在胃癌进程中发挥重要作用。但是Notch信号通路中各受体及配体之间如何相互调节,不同的受体及配体又如何调控胃癌的发生发展还需要进一步的研究。目前关于NOTCH1在胃癌中的作用研究较多,但仍然存在两种不同的结论。大部分研究结果支持NOTCH1在胃癌发展中发挥癌基因的作用,但是仍有部分研究表明NOTCH1在胃癌中表达降低,认为NOTCH1在胃癌中发挥抑癌基因的作用[8]。本研究进一步验证了NOTCH1在胃癌及癌旁组织中的表达,结果证实NOTCH1在胃癌组织中表达明显提高,提示NOTCH1在胃癌的发生发展过程中起到促进作用。
综上,本研究发现Notch信号通路中的配体和受体在正常胃组织中的表达具有差异性,在胃癌组织中受体NOTCH1/3/4和配体JAG2的表达明显提高,提示其参与了胃癌的发生发展。对NOTCH1蛋白的表达研究进一步证实了NOTCH1在胃癌中发挥癌基因的作用。但是Notch信号通路中受体和配体的相互作用以及Notch信号通路下游分子如何参与胃癌的发生发展需要进一步的研究,以期为胃癌的早期诊断和靶向治疗提供分子依据。
参考文献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Lin Y, Ueda J, Kikuchi S, et al. Comparative epidemiology of gastric cancer between Japan and China[J]. World J Gastroenterol, 2011, 17(39): 4421-4428.
[3] Koch U, Radtke F. Notch and cancer: a double-edged sword[J]. Cell Mol Life Sci, 2007, 64(21): 2746-2762.
[4] Ranganathan P, Weaver KL, Capobianco AJ. Notch signaling in solid tumors: a little bit of everything but not all the time[J]. Nat Rev Cancer, 2011, 11(5): 338-351.
[5] Luo DH, Zhou Q, Hu SK, et al. Differential expression of Notch1 intracellular domain and p21 proteins, and their clinical significance in gastric cancer[J]. Oncol Lett, 2014, 7(2): 471-478.
[6] Xiao HJ, Ji Q, Yang L, et al. In vivo and in vitro effects of microRNA-124 on human gastric cancer by targeting JAG1 through the Notch signaling pathway[J]. J Cell Biochem, 2018, 119(3): 2520-2534.
[7] Zhang H, Wang X, Xu J, et al. Notch1 activation is a poor prognostic factor in patients with gastric cancer[J]. Br J Cancer, 2014, 110(9): 2283-2290.
[8] Zhou W, Fu XQ, Zhang LL, et al. The AKT1/NF-kappa B/ Notch1/PTEN axis has an important role in chemoresistance of gastric cancer cells[J/OL]. Cell Death Dis, 2013, 4: e847. doi: 10.1038/cddis.2013.375.
[9] Kenneth JL, Thomas DS. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DDCT method[J]. Methods, 2001, 25(4): 402-408.
[10] Ellisen LW, Bird J, West DC, et al. TAN-1, the human homolog of the Drosophila notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms[J]. Cell, 1991, 66(4): 649-661.
[11] Yao Y, Ni Y, Zhang J, et al. The role of Notch signaling in gastric carcinoma: molecular pathogenesis and novel therapeutic targets[J]. Oncotarget, 2017, 8(32): 53839-53853.
[12] Wu X, Liu W, Tang D, et al. Prognostic values of four Notch receptor mRNA expression in gastric cancer[J/OL]. Sci Rep, 2016, 6: 28044. doi: 10.1038/srep28044.
[13] Hu S, Chen Q, Lin T, et al. The function of Notch1 intracellular domain in the differentiation of gastric cancer[J]. Oncol Lett, 2018, 15(5): 6171-6178.
[14] Du X, Cheng Z, Wang YH, et al. Role of Notch signaling pathway in gastric cancer: a meta-analysis of the literature[J]. World J Gastroenterol, 2014, 20(27): 9191-9199.
[15] Kang H, An HJ, Song JY, et al. Notch 3 and Jagged 2 contribute to gastric cancer development and to glandular differentiation associated with MUC 2 and MUC5AC expression[J]. Histopathology, 2012, 61(4): 576-586.
[16] Shen CH, Tung SY, Tseng MJ, et al. Inverse correlation between methylation and expression of the delta-like ligand 1 gene in gastric cancer[J]. Chin J Physiol, 2018, 61(2): 65-74.
[17] Miao ZF, Xu H, Xu HM, et al. DLL4 overexpression increases gastric cancer stem/progenitor cell self-renewal ability and correlates with poor clinical outcome via Notch-1 signaling pathway activation[J]. Cancer Med, 2017, 6(1): 245-257.
