CD73 调控肥胖相关乳腺癌肿瘤免疫微环境
2022-07-27孙圣荣
张 尊 孙圣荣
武汉大学人民医院乳腺甲状腺外科 湖北 武汉 430060
根据最新全球癌症统计,每年乳腺癌新发病例数约226 万,超越肺癌成为世界上最常见的恶性肿瘤[1]。尽管乳腺癌综合治疗效果不断提升,但是其高度的分子异质性仍然是精准治疗和预后监测的重要挑战。近年来,生活习惯等社会行为因素与肿瘤发生发展的关联引起了重大关切。Picon-Ruiz等[2]综述了肥胖对乳腺癌的风险、死亡率、生存率、不同亚型之间的影响,提示肥胖显著增加乳腺癌患病风险并赋予其恶性侵袭能力。值得注意的是,多项研究[3,4]表明,肥胖会增加乳腺癌中最具侵袭性的亚型——三阴性乳腺癌的患病风险和不良预后。因此,在本研究中,我们着重探讨肥胖促进乳腺癌发生发展的病理生理机制。
作为肿瘤或癌症干细胞生长的细胞环境,免疫细胞、血管、细胞外基质(ECM)、成纤维细胞、淋巴细胞、骨髓衍生的炎性细胞和信号分子共同构成的肿瘤微环境是癌症生长转移的重要基础。免疫细胞作为肿瘤基质的重要组成部分,通过其表型和构成比例的变化形成了利于癌症生长扩散的肿瘤免疫微环境[5]。肿瘤浸润淋巴细胞(TIL)和肿瘤相关巨噬细胞(TAM)是乳腺癌中研究最多的免疫细胞[6]。在乳腺肿瘤中表达最多的免疫抑制细胞[7]是调节性T 细胞(Treg)和髓源性抑制细胞(MDSC),除此之外,自然杀伤(NK)细胞、巨噬细胞、中性粒细胞、树突状细胞以及T 和B 淋巴细胞也可以在乳腺癌的肿瘤免疫微环境中表达。Pingili 等[8]探讨了肥胖影响乳腺癌中免疫系统的分子机制。这些研究发现提示了肥胖可能通过影响免疫系统,从而促进乳腺癌的恶性进展。
CD73 又称胞外-5'-核苷酸酶(Ecto-5'-Nucleotidase,EC3.1.3.5,ecto-5'-NT),是一种由NT5E 基因编码的糖基磷脂酰肌醇(GPI)锚定蛋白[9],广泛地表达在免疫细胞、基质细胞和癌细胞的表面。在胞外,CD73 能够将一磷酸腺苷(AMP)转化为腺苷,从而调节传递到免疫细胞的嘌呤能信号的持续时间、数量和化学性质[10]。肿瘤微环境中的腺苷可以作为信号分子与Treg 细胞A2AR 受体结合帮助Treg 细胞抑制并关停免疫活性,肿瘤细胞表面表达的肿瘤来源的CD73 是肿瘤发生免疫逃逸的原因之一[11]。在乳腺癌中,一些研究提示较高的CD73 表达水平与较差的预后相关[12,13],但在另外一些研究中,CD73 表达水平增加与较好的预后相关[14]。面对这些有争议的结果,需要我们提供更多的循证医学证据,阐释CD73 表达水平与乳腺癌组织微环境中的免疫状态以及乳腺癌患者预后的相关性。
本研究通过收集武汉大学人民医院乳腺甲状腺外科临床乳腺癌患者的组织标本和相关临床信息,发现了CD73 表达水平增加与体质量指数(BMI)显著正相关。此外我们发现在肥胖相关乳腺癌组织中CD73 表达水平显著上调。我们应用CIBERSORT[15]整体分析CD73 表达水平相关的肿瘤浸润免疫细胞的表达水平,研究结果发现CD73高表达组中Treg 和活化NK 细胞的比例较高,而低表达组中CD8+T 细胞、γδ+T 细胞和单核细胞的浸润率较高。因此本研究着重从肥胖相关乳腺癌入手,从免疫微环境的角度探讨CD73 的表达水平与乳腺癌发展的相关性。
1 材料与方法
1.1 生物信息学分析方法
1.1.1探索CD73 在乳腺癌不同亚型中表达水平以及相关信号通路 应用GOBO 在线平台[16]“Gene Set Analysis”模块分析CD73 mRNA 在乳腺癌不同亚型中的表达情况,进一步筛选和评估与CD73 表达变化显著相关的信号通路。
1.1.2探索CD73 mRNA 在乳腺癌不同亚型中的预后 应用Kaplan-Meier plotter 在线平台[17]分析CD73 mRNA 的表达水平与患者预后的相关性,计算与总生存期(OS)的log rankP值和危险因素(HR)。将CD73 表达阈值设定为50%,高于该阈值即为高表达,低于该阈值为低表达。
1.1.3探索CD73 mRNA 表达水平与乳腺癌组织免疫浸润的相关性 下载癌症基因组图谱[18](TCGA)的乳腺癌组织的转录组数据,数据格式为“FPKM”,计算并分析CD73 mRNA 表达水平与乳腺癌组织中免疫微环境的相关性。将上述转录组数据按照CD73 mRNA 的四分位数划分为CD73 高表达组和低表达组;CIBERSORT[15]为一款用于针对标准化的基因表达谱数据,量化分析免疫细胞浸润比例的分析软件,我们采用的是CIBERSORT 在线分析平台[15],定量分析组织样本中的免疫细胞组分。
1.2 实验方法
1.2.1病例收集 收集2010 年2 月至2017 年10月,在武汉大学人民医院接受手术治疗的50 例乳腺癌患者的组织标本,标本经过4%多聚甲醛固定并进行石蜡包埋。所有患者均为女性。所有纳入研究的患者均签署知情同意书,项目研究获得武汉大学人民医院机构伦理委员会批准。收集患者的相关临床资料,并进行定期随访,本项目随访评价的终点为患者出现复发或远处转移。
1.2.2免疫组化 免疫组化(IHC)染色由两名独立的病理学家进行,通过ImageJ IHC Profilier 计算CD73 表达阳性率。受试者工作特征(ROC)分析用于确定与生存率相关的所有表达水平的最佳截断值。一抗抗体为抗CD73 抗体(orb197830,Biorbyt,美国)。
1.2.3统计学分析 采用SPSS 26.0 软件(IBM Corporation,Armonk,NY,USA) 和 GraphPad Prism 8.0 软件(GraphPad software Inc,San Diego,CA,USA)进行统计分析,独立样本t检验分析两组间的显著差异。对独立样本采用单因素方差分析(ANOVA)进行组间比较。采用卡方检验评价CD73 表达水平与乳腺癌患者基线临床特征的相关性。采用Kaplan-Meier 法计算患者生存概率,logrank 检验评估各预后因素在生存资料中的异质性。采用Cox 比例风险模型评估乳腺癌的独立预后因素。采用Pearson 相关分析评估蛋白表达水平之间的相关性。P<0.05 为差异具有统计学意义。
2 结果
2.1 CD73 mRNA 表达水平在乳腺癌Basal-like亚型中上调比较分析不同亚型乳腺癌中胞外-5'-核苷酸酶CD73 基因(NT5E)的mRNA 表达水平,结果表明,与HER2+、LumA、LumB 三个亚型相比,CD73 mRNA 表达水平在乳腺癌Basal-like 亚型中增高(图1)。三阴性乳腺癌亚型是乳腺癌临床治疗效果最差一个类型,基于该类型组织的免疫组化临床病理特点与分子分型(PAM50)中的Basal-like 亚型高度重合,这一结果提示CD73 表达水平增加可能和恶性程度较高的三阴性乳腺癌的发生发展密切相关。
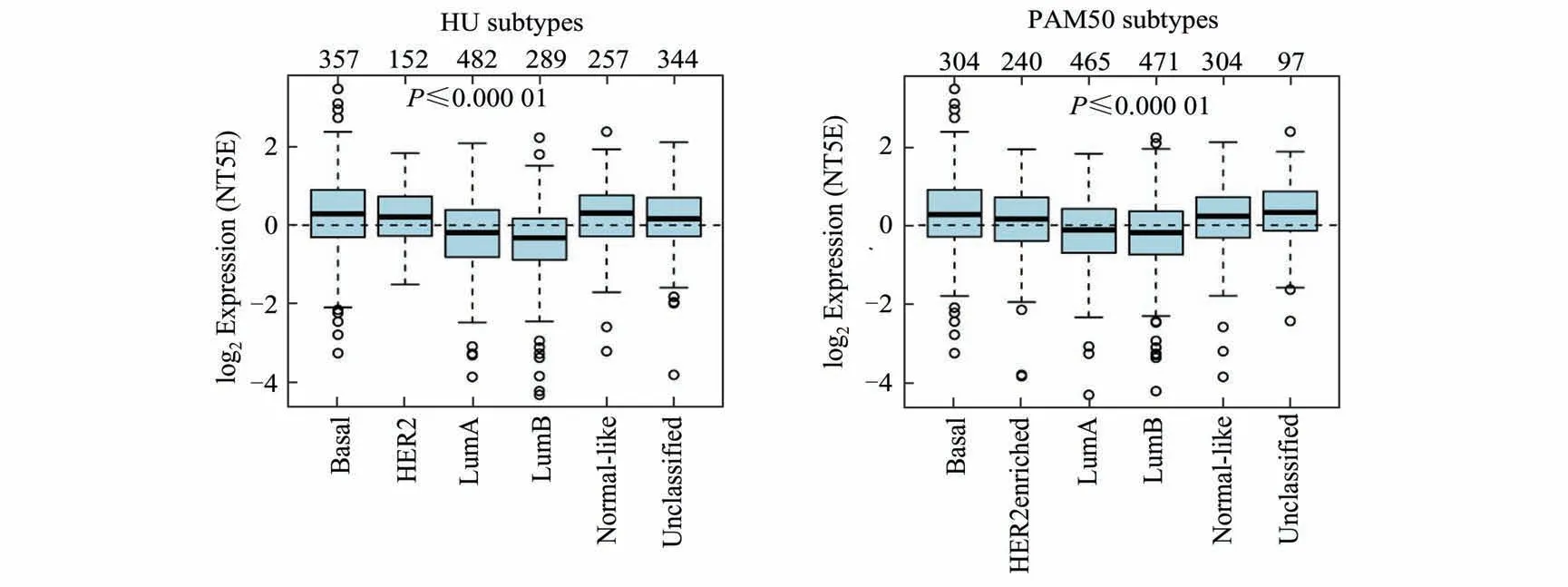
图1 不同乳腺癌亚型中CD73 mRNA 表达水平
2.2 CD73 mRNA 表达水平与免疫微环境和脂质代谢密切相关通过GOBO 平台筛选CD73 mRNA 表达水平显著相关的信号通路,结果提示CD73 mRNA 表达水平升高与乳腺癌组织微环境基质、脂质代谢以及免疫应答显著正相关(图2)。另外一方面,与固醇类代谢显著负相关(图2)。这一发现提示CD73 可能是通过参与脂质代谢、免疫微环境等途径发挥促进乳腺发展的作用。

图2 CD73 mRNA 表达相关信号通路
2.3 CD73 mRNA 表达水平与不同亚型乳腺癌患者预后的相关性Kaplan Meier 生存分析显示不同亚型乳腺癌患者中,CD73 表达水平与患者预后的相关性:CD73 低表达与三阴性乳腺癌和Luminal-A型乳腺癌的OS 显著延长(P=0.026 和0.048,图3A、3C)。另外一方面,HER2+型乳腺癌和Luminal-B 型乳腺癌中CD73 表达水平与生存率无显著相关性(P=0.22 和0.14;图3B、3D)。
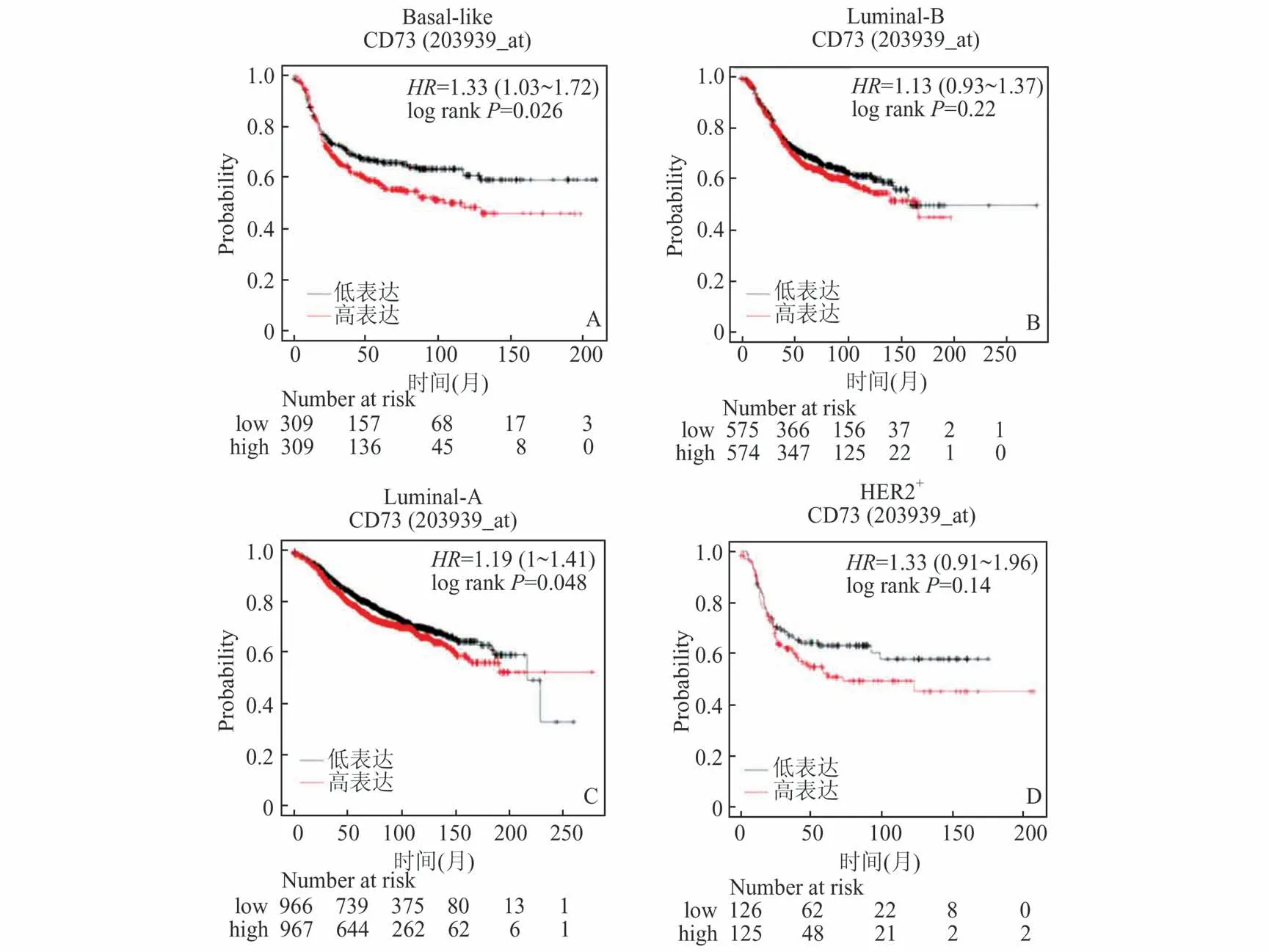
图3 CD73 mRNA 表达水平与不同亚型乳腺癌患者预后相关性
2.4 CD73 蛋白表达水平与乳腺癌分期分级无相关性我们采用免疫组化分析了50 例临床乳腺癌标本中CD73 的蛋白表达水平,结果显示,在乳腺癌细胞中,CD73 蛋白表达阳性有19 例,CD73 蛋白表达阴性有31 例。此外,除了在乳腺癌细胞中,在间质中也可以观察到CD73 的阳性表达(图4A)。
将CD73 的蛋白表达水平与临床病理数据做相关性分析,结果显示,CD73 蛋白表达水平与乳腺癌患者的年龄、肿瘤大小、TNM 分期、ER、PR、HER2、Ki67 水平均无显著的相关性(表1)。但是,与组织中CD73 的蛋白表达水平低组患者的生存率相比较,乳腺癌组织中CD73 的蛋白表达水平高组患者的生存率显著降低(P=0.000 2,图4B)。
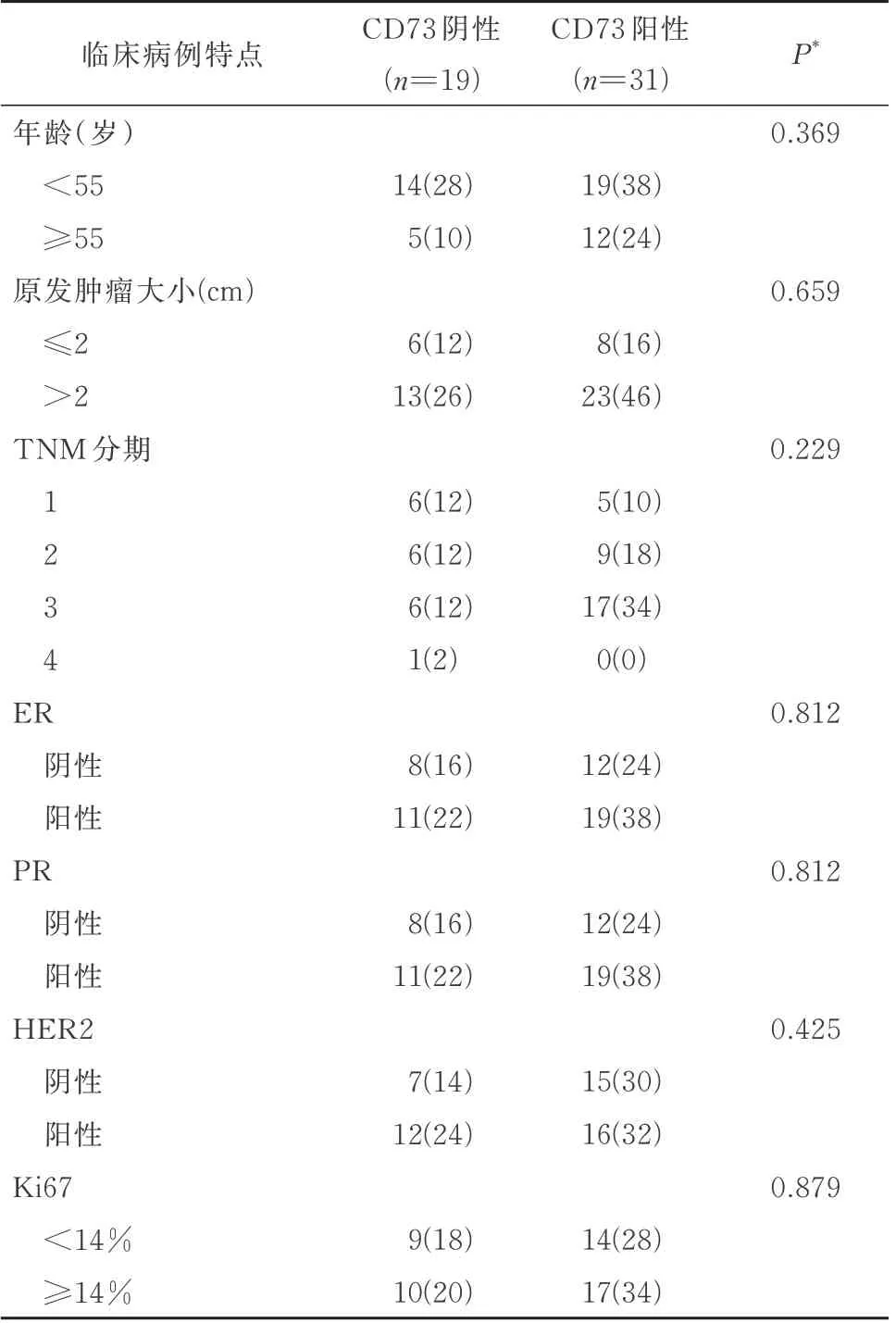
表1 CD73 表达与患者临床特点相关性[例(%)]
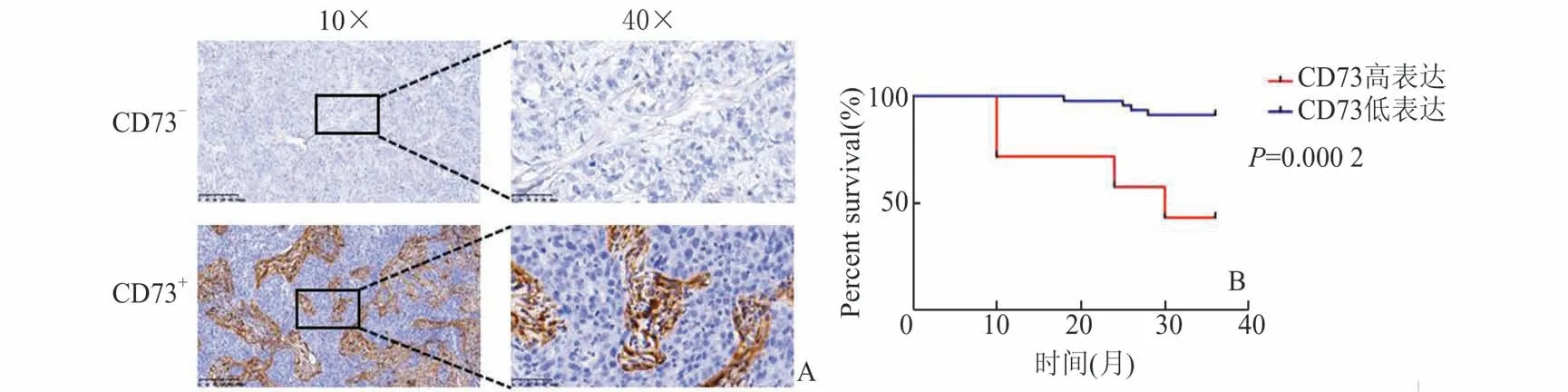
图4 乳腺癌组织CD73 蛋白表达情况及预后相关性
2.5 CD73 蛋白表达水平与患者BMI 的相关性尽管CD73 与患者的肿瘤大小、TNM 分期等临床病理特征无显著相关性,我们发现患者乳腺癌组织中CD73 的表达水平与患者的BMI 存在正相关(P=0.021 4,图5A),在肥胖(BMI>24 kg/m2)的乳腺癌患者中CD73 的表达水平要高于正常或过轻的乳腺癌患者(图5B)。同时我们发现在肥胖病人中,靠近脂肪细胞的乳腺癌细胞附近可以发现更多的CD73 阳性细胞聚集(图5C)。这一结果表明CD7 的表达与肥胖性乳腺癌密切相关,CD73 可能作为肥胖性乳腺癌的促癌因子发挥作用。
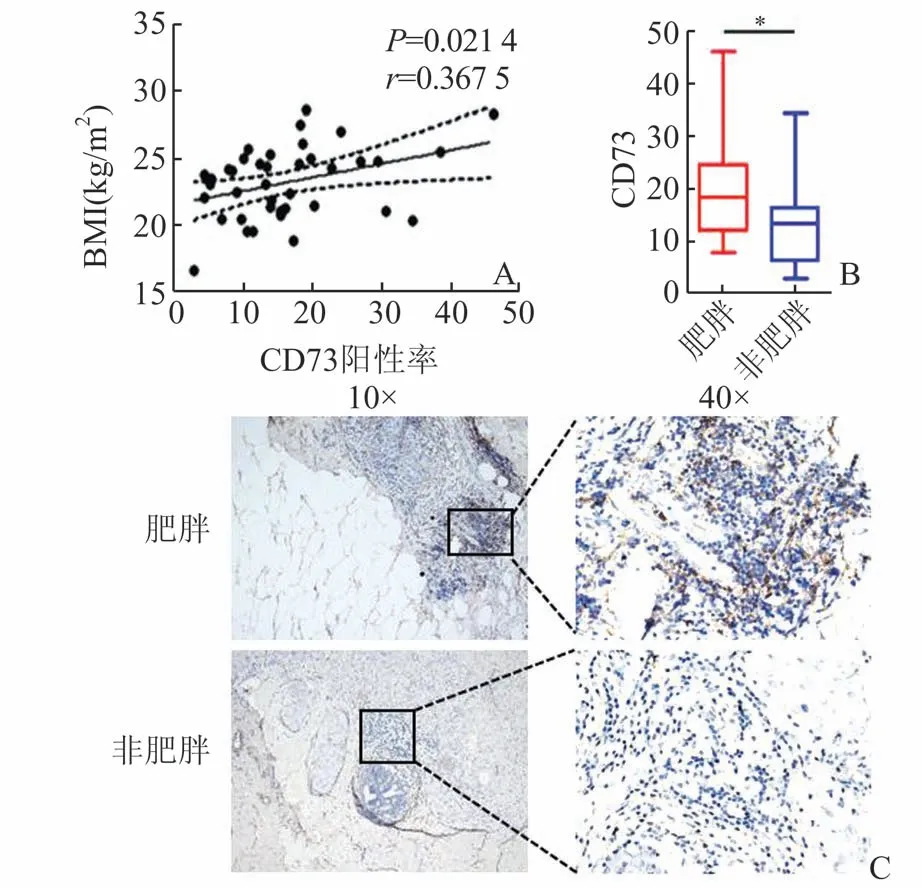
图5 CD73 蛋白表达水平与患者BMI 的相关性
2.6 CD73 通过脂代谢相关的基因调控肥胖相关乳腺癌为了探究CD73 通过何种途径参与肥胖相关乳腺癌的调节。本研究通过生物信息学手段并借助GeneMANIA 蛋白互作数据库,结果发现CD73 可能通过参与脂肪代谢蛋白FTO 等的调节[19],进而调控肥胖相关的乳腺癌。
2.7 CD73 调节乳腺癌肿瘤免疫微环境本研究分析CD73 表达与调控乳腺癌肿瘤免疫微环境的可能机制。在执行CIBERSOFT 算法后,TCGA 队列中1 053 个肿瘤样本的P<0.05,数据均合格。将CD73 表达水平的下四分位数表达定义为低表达组,将CD73 表达水平上四分数表达定义为高表达组。结果发现,高表达组中Treg 比例较高,而低表达组中CD8+T 细胞、γδ+T 细胞的浸润率较高(均P<0.05,图7)。这些结果提示,CD73 表达水平变化可能调节乳腺癌组织中的免疫浸润,特别是CD8+T 细胞和γδ+T 细胞的减少,会促进乳腺癌细胞的免疫逃逸。
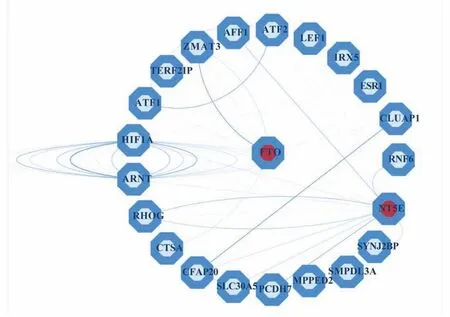
图6 CD73 蛋白互作网络
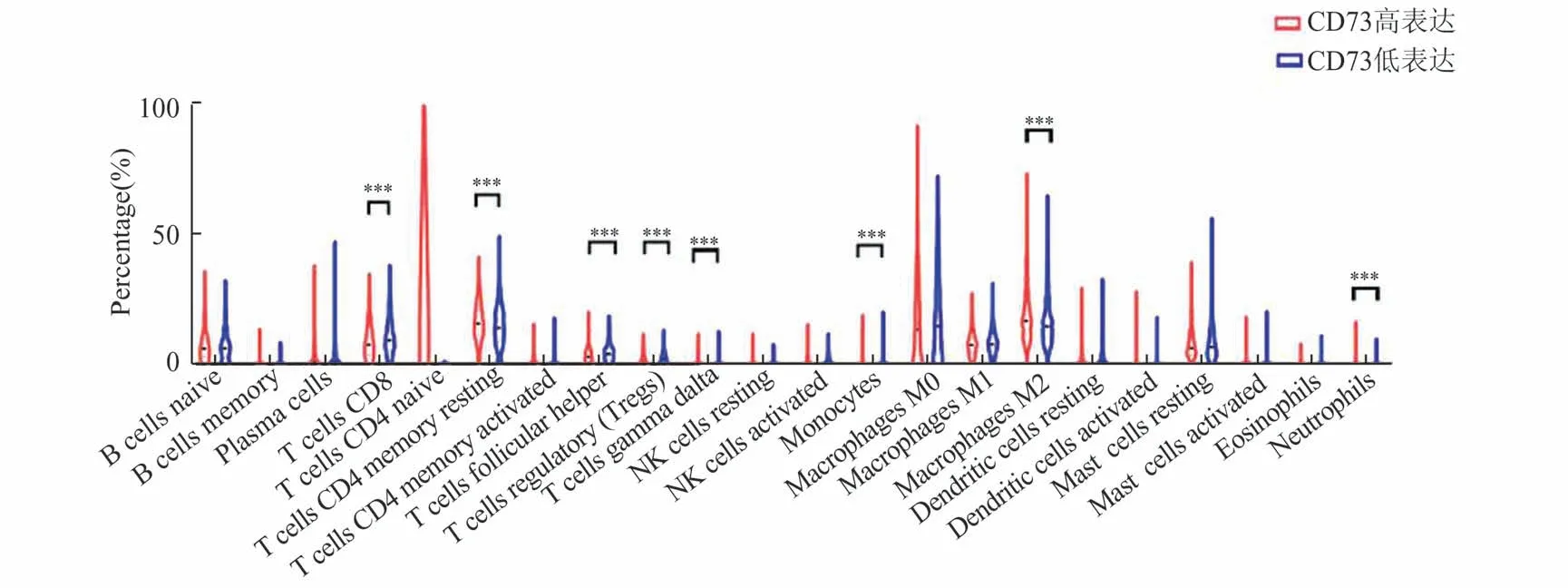
图7 CD73 不同表达水平下乳腺癌肿瘤免疫微环境特点
3 讨论
在本研究中,我们首先采用在线表达数据库中乳腺癌相关数据,采用生物信息学数据挖掘工具,系统分析了CD73 mRNA 表达水平与乳腺癌发生发展的关系,发现与乳腺癌HER2+、LumA、LumB三个亚型相比,CD73 mRNA 表达水平在Basal-like亚型中增高;并且在三阴型和LumA 型乳腺癌患者在CD73 表达水平越高,预后越差。通路分析结果显示,CD73 表达水平变化与脂质代谢和免疫密切相关,更重要的是,通过我们收集的50 例乳腺癌组织样本,免疫组化分析显示乳腺癌组织中CD73 蛋白表达水平增加与患者的BMI 水平增加之间存在正相关。生理状态下CD73 会通过脂肪细胞分泌的脂肪小体释放,将细胞外AMP 转化为腺苷,抑制甘油三酯分解,从而协助脂肪组织的脂质储存[20]。但在肿瘤发生发展时,脂肪组织参与构成的肿瘤微环境中更高的CD73 水平可能反而为肿瘤的生长和免疫逃逸提供了帮助。结合肥胖作为一种常见的代谢症群,被证实与多种癌症的发生密切相关[2]。并且BMI 的增加与乳腺癌发病率的增加之间存在明显的联系[21]。CD73 可能是肥胖相关乳腺癌发生的关键驱动因子。因此本研究重点分析CD73 表达水平变化与乳腺癌组织免疫微环境的相关性,从此角度探索肥胖在乳腺癌发生发展中的可能机制。
CD73 在肿瘤微环境中的积累被认为是癌症免疫逃逸的一种机制[22]。为了研究CD73 对乳腺癌中肿瘤浸润免疫细胞的影响,我们使用CIBERSORT比较CD73 高表达组和低表达组组织样本之间22 种不同的免疫细胞浸润差异。结果显示,CD73 高表达组乳腺癌组织中CD8+T 细胞和γδ+T 细胞的浸润程度显著降低,这可能是CD73 参与免疫抑制、诱导免疫逃逸的重要环节。首先CD8+T 细胞对于针对肿瘤的保护性免疫至关重要。在乳腺癌中,肿瘤微环境中CD8+T 细胞的浸润与总生存期延长正相关[23],因此,CD8+T 细胞浸润的丰度对预后和治疗策略具有重要意义。其次,γδ+T 细胞作为先天免疫和适应性免疫之间的桥梁,是包含T 细胞受体(TCR)γ 和δ 链的T 细胞亚群。它能够通过刺激巨噬细胞和DCs 产生具有抗肿瘤效应的细胞因子如IFN-γ 和TNF-α 来对抑制肿瘤细胞增殖,并且能够识别肿瘤细胞的抗原而没有主要的组织相容性复合物限制。高表达CD73 抑制乳腺癌组织微环境中的CD8+和γδ+T 细胞浸润最终导致肿瘤免疫逃逸,促进肿瘤的生长与转移。
综上所述,本研究结合生物信息学技术及临床标本检测,分析CD73 表达水平在乳腺癌发生发展中的作用。结果提示乳腺癌发生过程中,肥胖患者脂肪组织为肿瘤微环境提供了更高的CD73 水平,其产物腺苷可以与CTL 细胞上的A2AR 受体结合,引起c-AMP 在细胞内积累,结合调节亚基PKA,抑制T 细胞受体结合的促炎症信号,阻止高效的CTL活化、扩增和IFN-γ 产生,使细胞毒性抗肿瘤免疫力失去作用,并导致肿瘤微环境血管形成和免疫抑制细胞浸润等促进肿瘤生长的副作用,最终导致免疫逃[24]。靶向CD73-腺苷信号通路可能成为肥胖相关乳腺癌临床治疗新的靶点。
本研究仍然存在一些局限性,比如,临床样本来自单中心非随机数据库,肥胖人群临床患者纳入数量有待进一步累积;此外,CD73 作用的分子机制有待更深入的实验结果论证,以进一步明确肥胖与嘌呤能信号通路间的具体联系,及其在促进肥胖相关乳腺癌进展中的作用。
