内质网应激相关凋亡信号在肥胖小鼠盆底肌损伤中的作用
2022-07-27李素廷郝梦磊黄筱雨
陈 珏 洪 莉 李素廷 王 治 郝梦磊 陈 茂 肖 雅 黄筱雨
武汉大学人民医院妇产科 湖北 武汉 430060
女性压力性尿失禁(stress urinary incontinence,SUI)是常见于中老年妇女的慢性疾病,我国女性压力性尿失禁总体发病率为18.9%[1]。研究表明体质量增加和肥胖是女性压力性尿失禁发生的独立危险因素[2,3]。多项流行病调查研究证实了肥胖与SUI 的 相 关 性[4-7],体 质 量 指 数(BMI)每 增 加5 kg/m2,SUI 发生风险增加20%~70%[4,6],且减重可有效改善SUI 症状[8,9]。肥胖加重女性SUI 发生发展的主要观点之一是肥胖引起的慢性腹内压增加会对盆底产生病理性压力,研究表明女性BMI 每增加1 kg/m2或腹围增加2 cm,将导致腹压增加0.4 cmH2O 左右[10],通过影响盆底肌的结构和力量削弱尿道周围支持组织[11]。另有研究表明饱和脂肪酸对于肌肉细胞的直接损伤作用,如棕榈酸酯导致神经酰胺和甘油二酯等有毒的脂质中间体在细胞中的聚集,通过抑制蛋白质合成及阻遏PKB/Akt等信号通路传导,导致肌肉萎缩[12,13]。当盆底肌受损时,使尿道受压的吊床结构层力量将不足以在腹压增高时维持尿道闭合压,从而发生漏尿。肥胖与SUI 固然相关,但肥胖患者的盆底肌中的病理生理学变化却不明确,高游离脂肪酸对于盆底肌肉的直接损伤作用及作用机制有待进一步探究。
本研究通过对公共基因芯片数据库(Gene Expression Omnibus,GEO)中 基 因 表 达 数 据 集GSE6766 进行分析,筛选出棕榈酸处理小鼠C2C12肌管后的差异基因和重要相关信号通路,并在小鼠体内和体外验证相关基因和蛋白的表达。构建高脂饮食诱导的肥胖小鼠模型及棕榈酸(palmitic acid,PA)处理的小鼠成肌细胞C2C12 肌管,观察盆底肌的横截面积变化,检测盆底肌及C2C12 肌管中内质网应激相关蛋白的表达,以期揭示肥胖状态下盆底肌的变化及游离脂肪酸升高导致盆底肌损伤的机制。
1 材料与方法
1.1 材料
1.1.1细胞及动物 小鼠成肌细胞C2C12 购于南京科佰生物有限公司。7~8 周龄雌性处鼠购于武汉大学实验动物中心,动物许可证号:SCXK(鄂)2017-0012,体质量18~20 g,平均体质量(19.13±0.87)g。
1.1.2试剂 CHOP 抗体(66741-1-Ig,Proteintech);Laminin 抗 体(23498 -1 -AP,Proteintech);DDIT3(DNA Damage Inducible Transcript 3)、GRP78(Glucose regulatory protein 78)及β-actin 引物购于生工生物工程(上海)公司,DDIT3及GRP78引物序列见表1;棕榈酸钠(palmitic acid sodium)购于Sigma公司;牛血清白蛋白BSA-Ⅴ(不含脂肪酸)购于索莱宝生物技术公司;DMEM 培养基、胎牛血清、马血清、青-链霉素及胰酶购自Gibco(美国);TRIzol(code No.9108,宝日新生物公司);HifairTMⅡ1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus,11123ES)、HieffTM qPCR SYBR Green Master Mix(Low Rox Plus,11202ES)及PAGE 凝胶快速制备试剂盒购自上海翊圣生物公司。

表1 RT-qPCR 引物序列
1.1.3仪器 新正置荧光显微镜(Olympus Corp,日本东京),ChemiDoc 成像系统及荧光定量PCR 检测系统(BIO-RAD)。
1.2 方法
1.2.1生物信息学分析 在GEO 数据库中下载GSE6766 高通量测序数据集,使用数据库中的GEO2R 在线分析工具筛选出差异基因,筛选标准为P<0.05 且倍数变化(fold change,FC)对数值的绝对值|log2FC|>2。使用R 语言软件分析差异表达基 因(Differentially Expressed Genes,DEGs),ggplot2 和pheatmap 程序可视化生成热图与火山图,clusterprofiler 程序对DEGs 进行基因本体论(Gene ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析,得到DEGs 的细胞组分、生物过程和分子功能以及高脂诱导C2C12 细胞的关键通路。
1.2.2PA 的配制 于100 ℃金属浴中将一定量PA 溶解于去离子水中,配置成0.2 mol/L 溶液。在60 ℃水浴中将BSA 溶解于DMEM 培养基配制2%的BSA 溶液。将上述PA 溶液与BSA 溶液按1∶99的体积比趁热混匀,配成2 mmol/L 的PA 储存液。
1.2.3实验动物分组及处理 选取SPF 级健康7~8 周龄的C57BL/6 雌性处鼠10 只,将雌性处鼠随机分为2 组,分别为普通饲养组和高脂饲养组,每组5 只,组间小鼠周龄、体质量差异均无统计学意义(P<0.05)。使用普通饲料(12 kCal%脂肪,协同生物)和高脂饲料D12492(60 kcal%脂肪,华阜通)连续喂养20 周构建肥胖小鼠模型。以上小鼠饲养于武汉大学人民医院实验动物中心,本研究符合动物保护、动物福利和伦理原则以及国家实验动物伦理福利的相关规定,并获得武汉大学人民医院伦理委员会批准。
采用颈椎脱位法处死小鼠之前取眼球放血,分离周围组织暴露肛提肌,沿骨盆及脊柱周围用手术刀小心剥离盆底肌组织,具体步骤参照本课题组之前的研究[14]。取一侧盆底肌置于4%多聚甲醛中固定24 h,用石蜡包埋;另一侧盆底肌保存于-80 ℃,后续提取组织蛋白进行检测。
1.2.4细胞培养与研究设计 将C2C12 小鼠成肌细胞均匀铺种至6 孔板中,在37 ℃、含5% CO2的培养箱中培养。使用含10%胎牛血清及1%青-链霉素的高糖DMEM 培养基促进C2C12 小鼠成肌细胞增殖,当细胞密度达到80%~90%后更换含2%马血清及1%青霉素-链霉素的高糖DMEM 培养基,诱导C2C12 细胞分化。待分化第4~5 天时细长多核肌管形成时,使用不同浓度PA(0、250、500、750 μmol/L)干预24 h 后,提取细胞蛋白及RNA 进行检测。
1.2.5免疫荧光染色 石蜡包埋的盆底肌组织切片经60 ℃烘片2 h,二甲苯分别脱蜡30 min 和10 min,浓度梯度乙醇复水,枸橼酸钠抗原修复液及微波加热进行抗原修复,3% 双氧水避光封闭15 min;山羊血清37 ℃温箱封闭30 min;然后用稀释比为1∶200 的Laminin β1 一抗于4 抗湿盒内封闭过夜,1∶150 稀 释 的FITC-羊 抗 兔 二 抗37 ℃孵 育30 min,DAPI 室温复染核5 min,滴加抗荧光淬灭封片剂封片,最后于正置显微镜下观察拍照。
1.2.6蛋白质提取及浓度测定 提取组织蛋白时,将盆底肌组织从-80 ℃取出,采用液氮研磨法将组织 磨 成 粉 末,加 入cocktail 与RIPA 比 例 为1∶100 的混合蛋白裂解液,裂解20 min。冰上超声30 s,12 000 r/min 离心10 min,取上清。提取细胞蛋白时,将6 孔板内液体完全吸干,每孔加入50 μL 混合蛋白裂解液,然后用细胞刮匙将细胞轻柔刮下,冰上裂解超声。采用BCA 法检测各组样品蛋白浓度,按比例加入5×蛋白上样缓冲液,混匀后100 ℃金属浴加热8 min,制备好的蛋白样品置于-4 ℃短暂保存。
1.2.7Western Blot (WB) 使用PAGE 凝胶快速制备试剂盒配置凝胶,上样,电泳:在电压80 V 恒压条件下约20 min 跑完浓缩胶;120 V 约1 h 跑完分离胶。电转:于电流200 mA 恒流冰水混合低温条件下电转80 min,将蛋白从凝胶转印至PVDF 膜上。5%脱脂奶粉常温封闭30 min,稀释比为1∶1 000 的一抗CHOP(Proteintech,66741-1-Ig)于4 ℃摇床上过夜孵育,二抗常温孵育1 h,ECL 化学发光液显像,最后于BioRad 化学发光仪上显色。
1.2.8实时荧光定量PCR 使用TRIzol 提取细胞中的总RNA,测定RNA 浓度及纯度,使用HifairTM1stStrand cDNA Synthesis SuperMix for RTqPCR 将样品RNA 逆转为cDNA,使用HieffTMqPCR SYBR Green Master Mix(Low Rox Plus)进行实时荧光定量PCR 反应。每个实验重复3 次,以β-actin 为参考基因,2-ΔΔCt法计算基因表达水平。
1.2.9统计学分析 用Image Lab 软件获取WB条带灰度值,Image J 软件统计肌纤维横截面积,GraphPad Prism 7.0 软件进行数据分析。t检验进行两组间比较,单因素方差分析进行多组间样本均数分析。检验标准为α=0.05,P<0.05 视为差异有统计学意义。
2 结果
2.1 棕榈酸处理C2C12 肌管后的DEGs 分析对数据集GSE6766 进行处理分析,鉴定出468 个DEGs,其中上调基因273 个(58.3%),下调基因195个(41.7%)(图1A)。差异基因表达以热图形式可视 化,其 中 CRELD2、HSPA1B、HERPUD1、MANF、SDF2L1 在未折叠蛋白质反应中起作用(图1B)。对DEGs 进行GO 富集分析发现,DEGs的细胞组成主要富集在细胞外基质、胶原和内质网腔(图2A);分子功能主要富集在细胞外基质结构成分、受体配体活性和细胞因子活性等(图2B);生物过程主要富集在对拓扑错误蛋白质的反应、对氧化应激的反应及对内质网应激的反应(图2C);KEGG信号通路主要富集于IL-7 信号通路、谷胱甘肽代谢和内质网中的蛋白质加工(图2D)。
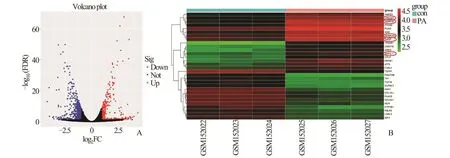
图1 数据集GSE6766 中DEGs 的表达情况
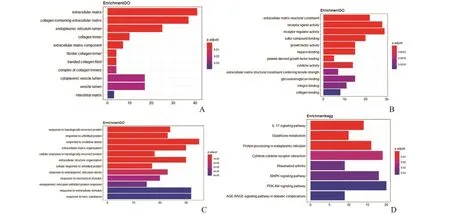
图2 数据集GSE6766 中DEGs 的富集分析
2.2 高脂饮食诱导小鼠盆底肌萎缩及CHOP 蛋白表达增加在相同环境下,分别用普通饲料和高脂饲料连续饲养小鼠20 周,诱导肥胖小鼠模型。取小鼠盆底肌进行石蜡包埋切片后,使用层黏连蛋白对肌肉切片染色,镜下观察肌肉形态并用Image J 软件对肌纤维横截面积(CSA)进行统计。结果发现与普通饲养组相比,高脂饲养组小鼠的盆底肌横截面积减小(图3A),差异具有统计学意义(P<0.000 1)(图3B)。取小鼠盆底肌于液氮下研磨,提取组织蛋白进行免疫印迹分析,结果发现高脂组小鼠盆底肌中CHOP 蛋白表达增加(图3C),差异具有统计学意义(P<0.05)(图3D)。
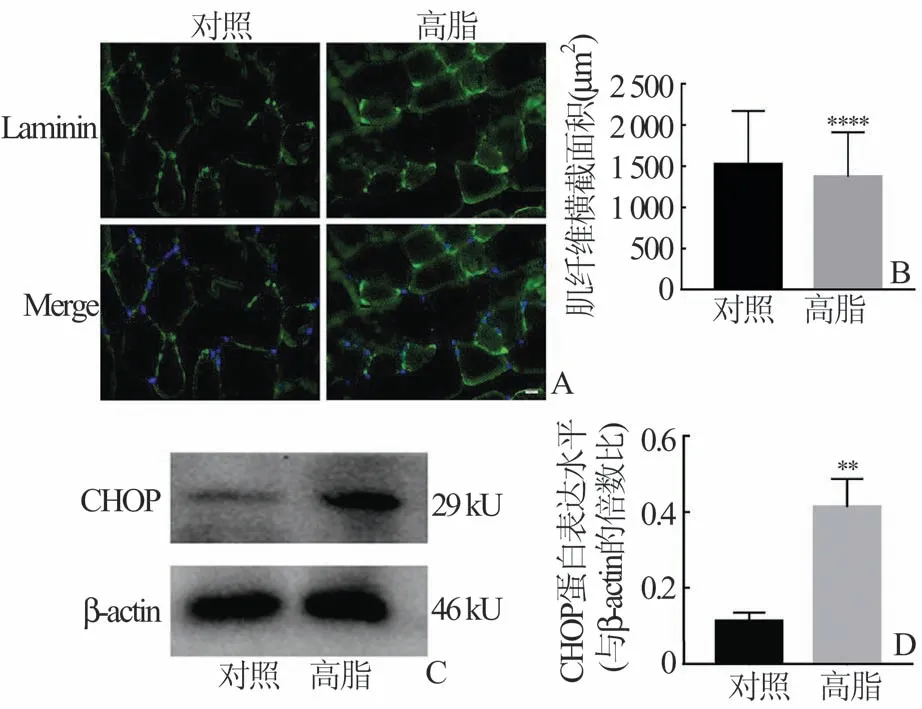
图3 小鼠盆底肌层黏连蛋白染色及CHOP 蛋白表达
2.3 PA 处理的C2C12 细胞中内质网应激相关基因及蛋白表达增加取小鼠C2C12 成肌细胞分化第4~5 天时形成成熟的肌管,用浓度分别为0、250、500 与750 μmol/L 的PA 处 理 肌 管24 h 后,提 取 细胞RNA 及蛋白质进行分析。主要测量指标为内质网应激相关的凋亡蛋白CHOP 以及编码CHOP 蛋白的基因DDIT3 mRNA 表达水平。结果发现PA诱导肌管中CHOP 蛋白表达升高(图4A),升高趋势呈剂量依赖性,用药剂量达到500 μmol/L 时蛋白表达具有差异性(图4B)。PA 诱导肌管中CHOP 及GRP78 的基因表达升高,用药剂量达到500 μmol/L时蛋白表达具有差异性(图4C)。
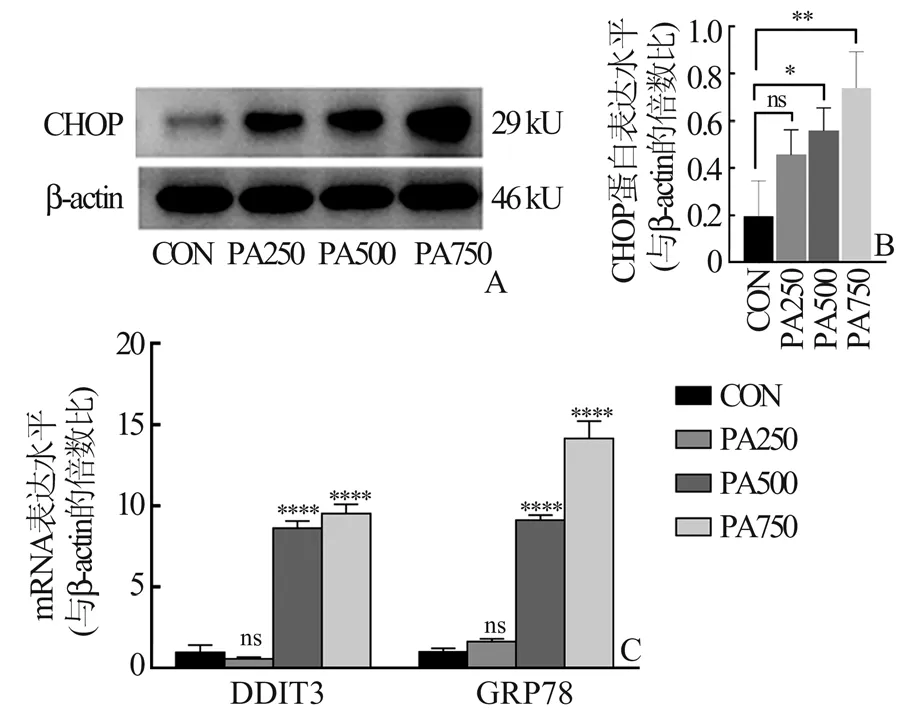
图4 浓度梯度的PA 处理后小鼠C2C12 肌管中CHOP 蛋白、CHOP 及GRP78 mRNA 表达
3 讨论
近几十年来,由于社会生活方式变化及生活压力增加,导致食品供应结构及质量的改变如高能量食物摄入过多,以及生活方式改变如运动减少[15],能量正平衡引起脂肪堆积,将导致腹型肥胖的形成[16,17]。 从1975 年 到2016 年,全 球 女 性 超 重(BMI≥25 kg/m2)的流行率由24%增至约40%,女性 肥 胖 患 病 率(BMI≥30 kg/m2)由7% 增 加 到16%[18]。肥胖是多种慢性疾病的危险因素,肥胖引起的压力性尿失禁随着肥胖人群的增多,日益成为社会不可忽视的健康问题。
盆底肌是维持盆底功能的强大支撑结构,若盆底肌肉薄弱或发生功能障碍,导致盆底支持结构缺陷时,将无法维持膀胱和尿道的正常解剖位置,从而导致压力性尿失禁[19]。研究表明压力性尿失禁患者的盆底肌形态学改变为肌纤维密度降低、排列紊乱、结缔组织填充取代、炎性细胞浸润等改变[20]。探究肥胖状态下高游离脂肪酸对盆底肌产生的损伤及其机制,以期对其中的病理生理学过程进行干预,有助于改善患者的症状,提高患者的生活质量。
骨骼肌中具有复杂的内质网结构,是蛋白质合成、折叠与分泌的重要位点,可帮助骨骼肌应对日常的机械及代谢压力。内源或外源刺激会导致内质网的蛋白错误折叠、未折叠蛋白在内质网腔内聚集以及Ca2+平衡紊乱,所引起的细胞应激状态被称为内质网应激(endoplasmic reticulum stress,ERS)。细胞通过非折叠蛋白反应(unfolded protein response,UPR)来清除内质网中错误折叠蛋白并维持内质网稳态,即从内质网向核内发出信号转导的自身保护性机制,被称为ERS 反应[21]。非应激状态下,ERS 信号传导的3 个内质网跨膜效应蛋白:肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α),ER驻 留 的PKR 类eIF2α 激 酶(ER-resident PKR-like eIF2α kinase,PERK)以及活化的转录因子(activated transcription factor,ATF6)与GRP78 结合,活性受到抑制;而当内质网应激状态超过内质网处理能力时,GRP78 与IRE1α、PERK 及ATF6 分离,三个效应蛋白活化,进而触发ERS 的信号传导[22],清除错误折叠蛋白。若内质网应激无法逆转,内质网跨膜效应蛋白的持续表达将上调CHOP 等凋亡相关的基因的表达[23]。CHOP 信号可改变参与细胞凋亡和氧化应激的基因的转录,其次通过解除PERK介导的翻译抑制来介导细胞死亡信号,从而增强促凋亡蛋白的翻译[24]。
在本研究中,首先通过生物信息学分析发现PA 刺激小鼠C2C12 肌管可诱导内质网应激相关基因的表达及通路富集;然后构建高脂饮食诱导的肥胖小鼠模型进行体内验证,发现高脂喂养的肥胖小鼠盆底肌横截面积减小,盆底肌中内质网应激相关凋亡蛋白CHOP 表达增加;最后采用PA 处理的小鼠C2C12 肌管的细胞模型,发现CHOP 蛋白、编码CHOP 蛋白的DDIT3 基因以及GRP78 基因的mRNA 表达与PA 存在剂量反应效应。
既往研究表明肥胖状态下脂质的过度负荷可破坏内质网的稳态,引起内质网功能紊乱[25],生物信息学分析结果也将研究方向聚焦于内质网应激相关信号通路。PA 与GRP78 及DDIT3 基因表达的剂量反应效应,一方面表明游离脂肪酸会激活细胞的内质网应激,另一方面随着游离脂肪酸的浓度增加,内质网应激状态超过生理调控能力,将通过CHOP 凋亡信号介导细胞死亡,产生不利后果。肥胖小鼠盆底肌萎缩、横截面积减小、CHOP 蛋白表达增加,表明高脂饮食诱导的肥胖对小鼠盆底肌的损伤作用可能是由于高游离脂肪酸诱导肌肉细胞产生无法逆转的ERS,最终引发细胞死亡。综上结果可说明ERS 相关凋亡参与了肥胖小鼠盆底肌的损伤过程,调控ERS 信号转导相关通路对肥胖引起的压力性尿失禁具有积极的防治意义。
