REM 睡眠剥夺对帕金森病大鼠识别记忆损害的影响及与AQP4 蛋白表达的相关性
2022-07-27黄朝云
徐 敏 沈 磊 黄朝云 杨 英
1武汉大学中南医院综合医疗科 湖北 武汉 430071;2武汉大学第二临床学院 湖北 武汉 430071;3暨南大学附属第一医院神经内科 广东 广州 510630
帕金森病(Parkinson's disease,PD)是以黑质多巴胺能神经元变性为病理特征的神经退行性疾病。研究发现,α-突触核蛋白的过度沉积和毒性是导致多巴胺能神经元变性的主要原因[1]。流行病学数据显示,约25%的初诊PD 患者存在轻度认知损害,80%的PD 患 者 最 终 发 展 为 痴 呆[2,3]。黑 质 内α-突触核蛋白(α-synuclein)的沉积以运动障碍为主要表现,而黑质外α-突触核蛋白的聚集和沉积与PD 的非运动症状相关[4]。因此,减少α-突触核蛋白的聚集与沉积可能是延缓和预防PD 相关认知损害的重要靶点。
水通道蛋白-4(aquaporin-4,AQP4)是类淋巴通路清除中枢神经系统代谢废物的重要通道蛋白[5-7]。睡眠对类淋巴通路清除神经毒性蛋白如淀粉样蛋白-β 的影响已在阿尔茨海默病动物模型中得到证实,睡眠状态下类淋巴通路的清除效率明显高于觉醒状态[5,8-10]。然而,睡眠与PD 相关认知损害的关系尚不明确。既往研究中,快速眼动(rapid eye movement,REM)睡眠剥夺(REM sleep deprivation,REMSD)对PD 患者认知功能的影响结论不一[11-14]。本研究建立PD 大鼠模型及应用REMSD干预,观察REMSD 对PD 大鼠认知功能的影响;并进一步探讨REMSD 与PD 大鼠海马和皮层中α-突触核蛋白及AQP4 蛋白表达的关系,旨在为PD 相关认知损害的治疗提供新的思路。
1 材料与方法
1.1 实验动物体重200~230 g 雄性Sprague-Dawley 大鼠,在室温22~25 ℃,光照条件为黑暗12∶12(即晚8 点关灯至早8 点开灯)的环境下饲养,大鼠笼内自由获取水和食物。
1.2 实验设计单侧立体定向黑质内注射6-羟多巴 胺(6-OHDA)建 立PD 大 鼠 模 型[15],假 手 术 组(sham)以同样方法立体定向注射抗坏血酸盐溶液。定向注射后4 周(第28 天),采用旋转试验评估PD模型是否成功。第29 天,以REMSD 干预1 周或维持正常睡眠并分为4 组:(1)假手术组(sham,n=6);(2)REMSD+假手术组(sham+REMSD,n=6);(3)正常睡眠的PD 大鼠组(PD,n=6);(4)REMSD干预的PD 大鼠组(PD+REMSD,n=6)。第35 天,所有大鼠进行新物体识别(novel object recognition,NOR)实验。实验结束后取脑行蛋白质印迹和免疫荧光分析检测大鼠海马和皮层中α-突触核蛋白及AQP4 蛋白的表达水平。
1.3PD 建模将大鼠以 10% 水合氯醛(350 mg/kg,i.p.)麻醉后固定于立体定位架,选择左侧黑质致密物(SNc)为靶部位行立体定位注射(图1),坐标为前囟后(5.0±0.2)mm,矢状线左侧(1.7±0.1)mm,颅骨表面下(7.6±0.1)mm[16]。以1 μL/min 速 度 泵 控 注 射4 μL 6-OHDA 5 min(2 μg/μL,8 μg 6-OHDA 溶解于4 μL 0.02%抗坏血酸盐溶液)(n=12),假手术以同样方法注射4 μL 0.02%抗坏血酸盐溶液(n=12)。

图1 大鼠颅内定位注射6-OHDA 部位示意图
1.4 PD 模型评价立体定向注射6-OHDA 后4 周(第28 天),皮下注射阿扑吗啡(0.1 mg/kg)诱导大鼠的旋转行为,10 min 后待大鼠旋转稳定,记录30 min 内大鼠向毁损对侧连续旋转的次数。每周测定1 次共4 周,以平均转数大于7 r/min 的SD 大鼠视为建模成功,同时观察其是否伴有震颤、活动迟缓、竖毛等异常行为。
1.5 REMSD采用改良多平台法[17]进行:在装有15 个直径6.5 cm 圆柱形平台的水槽(127 cm×44 cm×45 cm)中加水至平台高出水面约1 cm,将大鼠随机置于平台上,水和食物置于水箱顶部的网格上。大鼠在平台上站立可进入NREM 睡眠,当进入REM 睡眠时,全身骨骼肌张力显著降低、颈部肌张力降低引起节律性低头、触水,从而无法进入REM 睡眠,上述过程训练1 周。
1.6 NOR 实验立体定向注射5 周后(第35 天),采用NOR 实验评估大鼠的识别记忆,其特点是与熟悉的物体(样本物体)相比,大鼠更倾向于与新物体互动[18](如图2A)。NOR 实验在安静的低亮度条件下进行,实验装置为白色敞口箱(50 cm×40 cm×40 cm),要辨别的物体是白色的斑点杯和彩色的玻璃瓶。正式测试前,让所有大鼠熟悉装置环境以减少它们对新环境(实验箱装置环境)的压力。适应过程中,允许大鼠在装置内无物体的情况下自由探索周围环境,每次10 min,连续2 d。第2 天熟悉环境结束后,装置内加入两个相同的物体,再次将大鼠置于实验装置中,允许其对这两个相同的物体进行10 min 探索。间隔1 h 后,将两个样本物体取出,将其中一个样本物体清洗干净后放回原处,另一相同位置处用一新物体替换。然后将大鼠放回装置中进行5 min 探索。用秒表测量探索每个物体的时间和探索两个物体的总时间。每次试验后,这些物体都用70%的乙醇彻底清洗。安装在测试箱上方天花板上的摄像机记录大鼠的行为。大鼠在2 cm以内的距离将鼻子指向物体和/或用鼻子触摸物体被视为探索,辨别率定义为TN/(TN+TF),其中TN 为探索新物体的时间,TF 为探索样本物体的时间。
1.7 组织准备NOR 实验后,所有大鼠用10%水合氯醛溶液腹腔注射进行麻醉(350 mg/kg,i.p.)。断头取脑,分离出皮层和海马组织并置于液氮中冷冻,并在-80 ℃保存用于免疫印迹分析。免疫组化分析时,大鼠麻醉后经心脏快速灌注生理盐水将血液从心脏血管中清除,然后用4%多聚甲醛(稀释于0.1 mol/L 磷酸盐缓冲盐水,pH 7.4)继续灌注对脑组织进行内固定,取出脑组织并立即在4%多聚甲醛中固定至少24 h。然后将样品脱水并包埋于石蜡中,最后进行石蜡切片(从前到后冠状面切片),切片厚度5 μm。
1.8 蛋白质免疫印迹按蛋白提取试剂盒说明书操作,从海马和皮层组织中提取蛋白质。取蛋白质样品(约20 μg)用12%SDS-PAGE 凝胶电泳分离,在200 mA 下转印到0.45 μm PVDF 膜上1 h,用丽春红染色以确定转膜效果。室温下,将转印后的PVDF 膜浸置于浓度为5% 的脱脂牛奶[用含0.1%Tween20 的Tris 缓冲盐水(TBST)稀释]中封闭1 h。随后将膜与一抗在4 ℃下孵育过夜。一抗为 抗α-synuclein 抗 体(Abcam,Cambridge,MA,USA;1∶1 000 稀释)和抗β-actin 抗体(Santa Cruz,Dallas,USA,TX,1∶2 000 稀释)。之后在过氧化物酶偶联的二抗(抗小鼠抗体1∶10 000 TBST 稀释,KPL,Gaithersburg,MD,USA)中孵育30 min 后,应用化学发光法观察印迹,通过光学密度仪对胶片上的免疫反应条带进行半定量分析。
1.9 免疫荧光石蜡切片经3%H2O2室温淬灭后,在45 ℃1 mol/L HCl 中 孵 育30 min 使DNA 变 性,置于10 mmol/L 柠檬酸钠缓冲液(pH=6)中,92~98 ℃保存20 min,用于抗原提取。加入一抗(抗AQP4,Abcam,1∶200;或 抗α-synuclein,Abcam,1∶200)在4 ℃下孵育过夜,然后用过氧化物酶偶联的山羊抗小鼠或山羊抗兔二抗(1∶200)在37 ℃下孵育30 min。切片暴露于DAB 和苏木精染色,同时制备阴性和阳性对照品,用光学和荧光显微镜观察切片。采用Image J 图像分析软件获得AQP4 或α-突触核蛋白免疫染色阳性细胞的平均光密度(IOD)值。
1.10 统计学分析所有数据以均数±标准误表示,应用GraphPad Prism 5.0 软件进行统计分析,P<0.05 为有统计学差异。采用双因素方差分析评价NOR 实验中各组大鼠对样本物体或新物体探索时间的差异,然后采用Bonferroni 法进行多组比较。采用单样本t检验来确定辨别率是否与概率(50%)有显著差异。所有其他数据均采用单向方差分析后再应用Bonferroni 检验。
2 结果
2.1 REMSD 对4 组大鼠识别记忆的影响4 组大鼠在训练结束1 h 内探索新物体的时间均长于探索样本物体的时间,只有假手术组(sham)大鼠探索新物体和样本物体时间的差异有统计学意义(sham组,P<0.01;PD+REMSD 组,P=0.076)(如图2B)。4 组大鼠对新物体辨别率的差异如图2C 所示,sham 组和PD+REMSD 组大鼠对新物体的辨别率显著高于50%(sham 组和PD+REMSD 组,P<0.05;sham+REMSD 组,P=0.07)。

图2 REMSD 对各组大鼠识别记忆的影响
2.2 REMSD 对4 组大鼠皮层与海马中α-突触核蛋白表达的影响蛋白质免疫印迹(图3)和免疫荧光分析(图4)结果显示,PD 组大鼠皮层(cortex,图3B 和4B)与海马(hippocampus,图3C&4C)中α-突触核蛋白的表达水平均显著高于sham 组(P<0.01)。PD+REMSD 组大鼠皮层(cortex,图3B,P<0.01;图4B,P<0.05)和 海 马(hippocampus,图3C,P<0.05;图4C,P=0.052 3)中α-突触核蛋白的表达水平明显低于PD 大鼠;而sham 组与sham+REMSD 组大鼠皮层和海马中α-突触核蛋白的表达水平无统计学差异(P>0.05)。
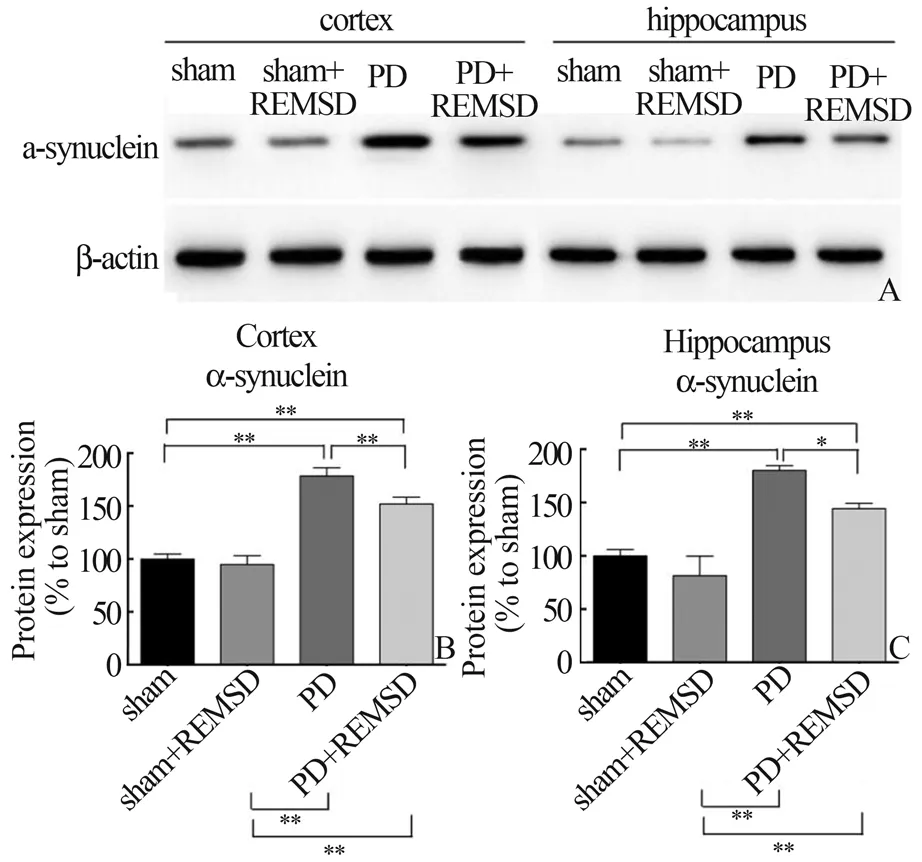
图3 REMSD 对各组大鼠皮层与海马中α-突触核蛋白表达的影响
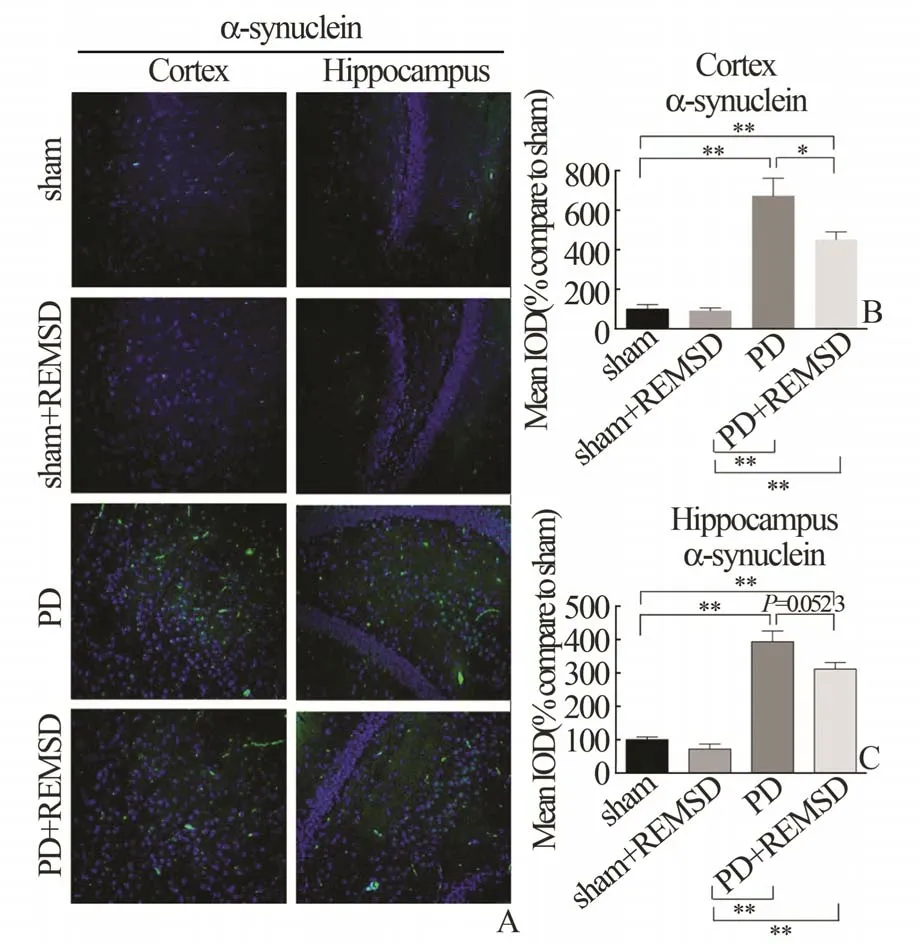
图4 免疫荧光分析REMSD 对各组大鼠皮层与海马中α-突触核蛋白表达的影响
2.3 REMSD 对4 组大鼠皮层与海马中AQP4 表达的影响如图5 所示,REMSD 干预后的PD 大鼠皮层(cortex)和海马(hippocampus)中AQP4 蛋白的表达水平明显高于正常睡眠的PD 大鼠(图5B 和5C,P<0.05);而sham 组 与sham+REMSD 组 大 鼠 的皮层和海马中AQP4 蛋白的表达水平无统计学差异(P>0.05)。

图5 REMSD 对各组大鼠皮层与海马中AQP4 蛋白表达的影响
3 讨论
本研究发现,REMSD 干预后的PD 大鼠其识别记忆优于正常睡眠的PD 大鼠;REMSD 干预后的PD 大鼠皮层和海马中α-突触核蛋白的沉积明显少于正常睡眠的PD 大鼠。同时,REMSD 干预后的PD 大鼠皮层和海马中AQP4 蛋白的表达水平明显高于正常睡眠的PD 大鼠。
α-突触核蛋白是分子质量约14~20 kU 的内源性蛋白,定位于突触前多巴胺能神经元内[1]。研究显示,α-突触核蛋白的聚集与沉积可致多巴胺能神经变性[1],PD 相关的认知损害与黑质外α-突触核蛋白的聚集与沉积有关[4]。本研究中,6-OHDA 处理后的大鼠皮层与海马中α-突触核蛋白的表达水平明显高于假手术组,提示PD 大鼠建模成功。同时,PD 大鼠的识别记忆明显差于假手术组,与既往研究的结果一致[19],表明α-突触核蛋白的过度聚集与沉积与PD 相关的认知损害有关。
睡眠可调节海马区神经元的可塑性与神经发生,与记忆的编码和巩固密切相关[20,21]。本研究中,REMSD 干预后的健康大鼠的识别记忆较正常睡眠的健康大鼠差,但该差异无统计学意义;而REMSD干预后的PD 大鼠的识别记忆优于正常睡眠的PD大鼠。睡眠对认知的影响在阿尔茨海默病动物模型中已得到证实,但REM 睡眠与PD 相关认知损害的关系仍存在争议。有研究[11]报道,REMSD 和多巴胺D2 受体可调节和改善PD 大鼠的识别记忆;也有研究报道,REMSD 通过阻断多巴胺D2 受体导致PD 动物模型产生认知损害[12,14]。本研究的结果提示,REMSD 对PD 和健康脑认知功能的影响可能存在差异,REMSD 对PD 认知功能的影响程度可能与不同的认知任务有关。
本研究中REMSD 干预后的PD 大鼠的识别记忆损害程度轻于正常睡眠的PD 大鼠,与皮层和海马中α-突触核蛋白的沉积减少、AQP4 蛋白的表达增加有关。如前所述,α-突触核蛋白的过度聚集与沉积与PD 相关的认知损害有关。研究证实,睡眠可影响类淋巴通路对神经系统毒性代谢产物的清除[5-10]。睡眠对类淋巴系统清除神经毒性蛋白聚集(如淀粉样蛋白-β)的影响,在阿尔茨海默病动物模型中已得到证实。AQP4 表达于星形胶质细胞终足,是类淋巴通路中清除神经系统毒性产物(如淀粉 样 蛋 白-β,tau 蛋 白)的 重 要 通 道 蛋 白[5-7,9,10]。REMSD 是否通过AQP4 启动类淋巴通路清除α-突触核蛋白改善PD 相关的认知损害尚需进一步研究。
综上所述,REMSD 可降低PD 相关认知损害,与皮层和海马中α-突触核蛋白表达减少及AQP4 蛋白表达增加相关。REM 睡眠及AQP4 蛋白表达的调控对改善PD 相关认知损害的作用与机制有待进一步研究阐明,可能为延缓PD 相关认知损害的进展提供新的治疗靶点。
