丙泊酚通过激活Nrf2/HO-1 减轻脓毒症小鼠脑损伤
2022-07-27付湘云刘方燕刘永芳刘志刚
罗 涛 付湘云 黄 蕊 刘方燕 刘永芳 刘志刚
武汉大学人民医院麻醉科 湖北 武汉 430060
脓毒症(sepsis)是由感染引起的全身炎症反应综合征,严重时常伴有危及生命的器官功能障碍,是全世界ICU 入院和死亡的主要原因[1]。中枢神经系统是脓毒症进程中最容易受损的系统之一,临床表现为脓毒症相关性脑病(sepsis associated encephalopathy,SAE),可导致脓毒症患者急性和慢性认知功能障碍,并且增加死亡率[2]。因此寻找能有效减轻脓毒症导致的脑损伤的药物,对于降低脓毒症患者的死亡率和改善预后具有重要意义。
丙泊酚作为一种代谢迅速、无蓄积的静脉麻醉药,广泛用于临床麻醉和重症监护室患者的镇静。除镇静和催眠作用外,已有研究报道丙泊酚对脓毒症导致的肺、肝、肾等多器官损伤具有保护作用[3-5]。核因子E2 相关因子2/血红素加氧酶-1(Nrf2/HO-1)是机体发挥内源性抗氧化作用的关键通路之一,先前的研究表明Nrf2/HO-1 通路与脓毒症脑损伤关系密切,激活Nrf2 抗氧化信号通路,能够减轻脓毒症小鼠的血脑屏障损伤和认知功能障碍[6]。此外,有研究发现丙泊酚可激活Nrf2/GSH 信号通路,减轻脓毒症急性肺损伤[7]。然而,丙泊酚是否能减轻脓毒症导致的脑损伤及其具体机制尚不清楚,因此本研究拟探讨丙泊酚对脓毒症小鼠脑损伤的影响及其与Nrf2/HO-1 通路的关系。
1 材料与方法
1.1 实验动物C57BL/6 小鼠购自武汉大学人民医院动物实验中心,SPF 清洁级,雄性,6~8 周,体质量18~20 g。所有动物在本院动物房中常规饲养1 周,采用昼夜交替光照,相对湿度50%~60%,温度保持约22~25 ℃,小鼠自由摄食、饮水,定期更换垫料。本实验经本院动物实验伦理委员会审核批准(编号:WDRM20191004 号)。
1.2 主要试剂和仪器脂多糖(O111:B4),纯度98%,批号:L2630,购自美国Sigma 公司;丙泊酚注射液(批号:RJ816),英国AstraZenec 公司;脂肪乳注 射 液(GM2007029),广 州Baxter 公 司;ML385(abs819623),二甲基亚砜(abs9187),上海absin 公司;小鼠肿瘤坏死因子(TNF)-α ELISA 试剂盒(ml002095),小鼠白细胞介素(IL)-6 ELISA 试剂盒(ml002293),上海酶联生物技术公司;总超氧化物歧 化 酶(SOD)活 性 检 测 试 剂 盒(WST -8 法)(S0101S),脂质氧化检测试剂盒(S0131S),BCA 蛋白浓度测定试剂盒(P0012),上海碧云天公司;兔源Nrf2 一抗(16396-1-AP),兔源HO-1 一抗(10701-1-AP),山羊抗兔二抗(SA00001-2),美国Proteintech公司;兔源β-actin 一抗(GB11001),RIPA 裂解液(G2002),武汉Servicebio 公司等。
1658001 型电泳仪、荧光定量PCR 仪和Chemi-Doc MP System 型全能型成像系统均购自美国Bio-Rad 公司;EnSight 多功能酶标仪购自Perkin Elmer公司;CX43 型光学显微镜购自日本奥林巴斯公司;低温高速离心机购自德国Eppendorf 公司。
1.3 实验方法
1.3.1动物分组和造模 选取60 只C57BL/6 小鼠,采用随机数字表法分为对照(Con)组、脓毒症(LPS)组、脂肪乳(Lip)组、丙泊酚(PF)组、丙泊酚(PF)+Nrf2 抑制剂(ML385)组,每组12 只。参照文献[8]和[9]中ML385 的使用方法,PF+ML385组于造模前1 周开始,每天腹腔注射抑制剂ML385 30 mg/kg,每天一次,连续7 d。除Con 组注射等剂量生理盐水外,LPS、Lip、PF 和PF+ML385 组小鼠均采用腹腔注射LPS 10 mg/kg 构建脓毒症小鼠脑损伤模型[10]。参照文献[4]和预实验结果,本研究选择丙泊酚50 mg/kg 进行实验。注射LPS 30 min后,PF 组小 鼠腹腔注射50 mg/kg 丙泊酚,Lip 组注射等体积的脂肪乳,Con 组和LPS 组注射等体积的生理盐水,12 h 后重复给药一次。
1.3.2小鼠神经行为评分 注射LPS 24 h 后,分别采用耳廓反射、捏尾反射、角膜反射、逃避反射、翻正反射对小鼠神经功能进行评分,正常为2 分,反射减弱(10 s<间隔时间≤30 s)为1 分,反射丧失(间隔时间>30 s)为0 分,最高评分为10 分[11]。
1.3.3HE 染色观察脑组织病理变化 注射LPS 24 h 后,各组选取3 只小鼠,腹腔注射10%水合氯醛0.1 mL 麻醉小鼠后立即处死,分离出完整脑组织,4%多聚甲醛4 ℃浸泡后依次经梯度乙醇脱水、石蜡包埋、组织切片、脱蜡后HE 染色,置于400 倍光学显微镜下观察海马CA1 区损伤情况。
1.3.4ELISA 法 检 测 血 清TNF-α 和IL-6 水 平注射LPS 24 h 后,各组随机选取6 只小鼠,麻醉后经左心室取血0.5~1.0 mL,置于低速离心机中3 000 r/min 离心10 min,取上清液,按照试剂盒的说明操作,采 用ELISA 法 检 测 血 清 中TNF-α 和IL-6 的 含量。处死小鼠取海马组织,于-80 ℃备用。
1.3.5检测脑组织中SOD 和丙二醛(MDA)活性 取出备用的海马组织,加入预冷的RIPA 裂解液制备成10% 的组织匀浆,12 000 r/min 离心15 min 后取上清液,严格按照试剂盒操作说明。
1.3.6Western Blot 法检测Nrf2 和HO-1 蛋白表达 取适量海马组织,加入预冷的RIPA 裂解液,提取出总蛋白后,用BCA 法测蛋白浓度,分别取20 μg蛋白与5×上样缓冲液混匀并煮沸,经SDS-PAGE凝胶电泳分离后,转移到PVDF 膜上,5%脱脂牛奶室温封闭1 h,依次加入一抗兔抗Nrf2(1∶1 000)、兔抗HO-1(1∶2 000)和兔抗β-actin(1∶1 000),4 ℃孵育过夜。然后加入HRP 标记的山羊抗兔二抗室温孵育1 h,洗膜后加入增强化学发光液ECL,采用凝胶成像系统拍照并用ImageJ 软件分析蛋白条带灰度值。以各条带灰度值与内参β-actin 条带灰度值的比值,为目的蛋白的相对表达量。
1.3.7RT-PCR 检测Nrf2 和HO-1 基因表达 用TRIzol 法提取小鼠海马组织总RNA。逆转录试剂盒合成cDNA,再使用绿色荧光定量PCR 试剂盒检测待测基因的相对表达量。引物由南京金斯瑞设计 及 合 成。Nrf2:Forward 5'-CCAGTTGGTAACAATGCCATGT - 3',Reverse 5' - CCTTCTGGAGTTGCTCTTG-3',扩 增 产 物 长 度191 bp;HO-1:Forward 5'-ACAGCCCCACCAAGTTC-3',Reverse 5'-GGCGGTCTTAGCCTCTTC-3',扩 增产物长度101 bp;内参β-actin:Forward 5'-GGCTGTATTCCCCTCCATCG-3',Reverse 5'-CCAGTTGGTAACAATGCCATGT-3',扩 增 产 物 长 度154 bp。PCR 扩增程序:95 ℃5 min;95 ℃10 s,60 ℃30 s(40 个循环);72 ℃10 min。按2-ΔΔCT法计算目的基因的相对表达量,实验重复3 次。
1.3.8统计学方法 采用GraphPad Prism 8.0 软件进行统计学分析。正态分布的计量资料以均数±标准差(±s),组间比较采用单因素方差分析,并采用LSD 法进行组间的两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 丙泊酚对小鼠神经功能评分的影响与Con组相比,LPS 组小鼠的神经功能评分降低(P<0.05);与LPS 组相比,Lip 组差异无统计学意义(P>0.05),PF 组小鼠的神经功能评分升高(P<0.05);相较于PF 组,PF+ML385 组的神经功能评分降低(P<0.05)。见表1。
表1 各组小鼠神经功能评分结果(n=6,±s)

表1 各组小鼠神经功能评分结果(n=6,±s)
与Con 组比较,aP<0.05;与LPS 组比较,bP<0.05;与PF 组比较,cP<0.05
神经功能评分10.00±0.00 5.42±0.79a 5.25±0.87 7.75±1.14b 5.58±0.90c组别Con LPS Lip PF PF+ML385
2.2 丙泊酚减轻脓毒症小鼠海马CA1 区损伤Con 组小鼠海马CA1 区神经元结构正常,排列整齐,细胞核清晰;LPS 组和Lip 组小鼠海马CA1 区神经元神经元排列紊乱,细胞核皱缩,结构不清晰;与LPS 组相比,PF 组小鼠上述病理改变减轻;与PF 组相比,PF+ML385 组海马CA1 区神经元病理改变加重。见图1。

图1 各组小鼠海马CA1 区病理变化(HE×400)
2.3 丙泊酚对脓毒症小鼠血清TNF-α 和IL-6 的影响与Con 组比较,LPS 组小鼠血清TNF-α、IL-6显著增加(P<0.05)。与LPS 组相比,Lip 组小鼠TNF-α、IL-6 含量无明显变化(P>0.05),PF 组小鼠TNF-α、IL-6 含量明显降低,差异有统计学意义(P<0.05);与PF 组 相 比,PF+ML385 组 小 鼠TNF-α、IL-6 含量增高(P<0.05)。见表2。
表2 各组小鼠炎症因子和氧化应激指标的比较(n=6,±s)
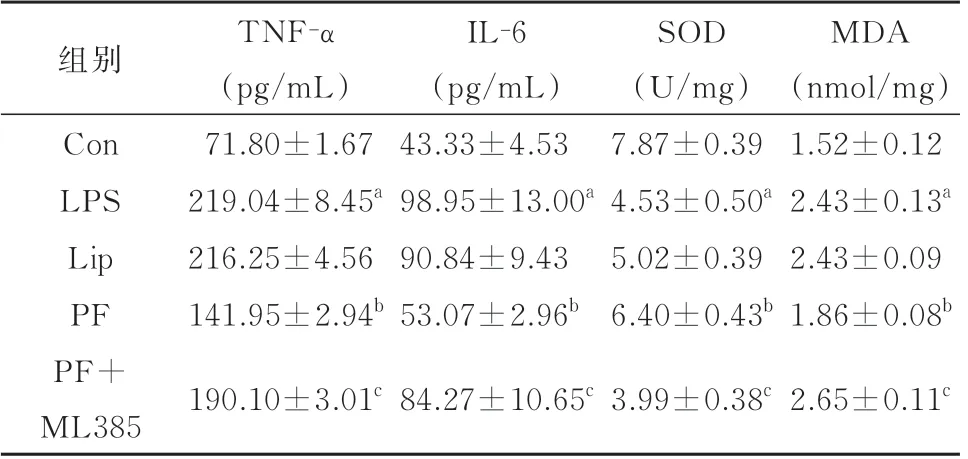
表2 各组小鼠炎症因子和氧化应激指标的比较(n=6,±s)
与Con 组比较,aP<0.05;与LPS 组比较,bP<0.05;与PF 组比较,cP<0.05
组别Con LPS Lip PF PF+ML385 TNF-α(pg/mL)71.80±1.67 219.04±8.45a 216.25±4.56 141.95±2.94b 190.10±3.01c IL-6(pg/mL)43.33±4.53 98.95±13.00a 90.84±9.43 53.07±2.96b 84.27±10.65c SOD(U/mg)7.87±0.39 4.53±0.50a 5.02±0.39 6.40±0.43b 3.99±0.38c MDA(nmol/mg)1.52±0.12 2.43±0.13a 2.43±0.09 1.86±0.08b 2.65±0.11c
2.4 丙泊酚对脓毒症小鼠海马SOD 和MDA 含量的影响与Con 组相比,LPS 组小鼠海马中SOD 活性显著降低,而MDA 含量显著增加(P<0.05)。与LPS 组 相 比,Lip 组 小 鼠SOD 活 力 和MDA 含 量 无显著性差异(P>0.05),PF 组小鼠海马SOD 活力明显升高,MDA 含量明显降低(P<0.05);与PF 组相比,PF+ML385 组 小 鼠 海 马SOD 活 力 降 低,MDA含量增高(P<0.05)。见表2。
2.5 丙泊酚对脓毒症小鼠Nrf2 和HO-1 蛋白水平的影响与Con 组相比,LPS 组小鼠Nrf2 和HO-1蛋白表达增高(P<0.05);与LPS 组相比,Lip 组无明显变化(P>0.05),PF 组Nrf2 和HO-1 进一步升高(P<0.05);相较于PF 组,PF+ML385 组Nrf2 和HO-1 明显降低(P<0.05)。见图2。
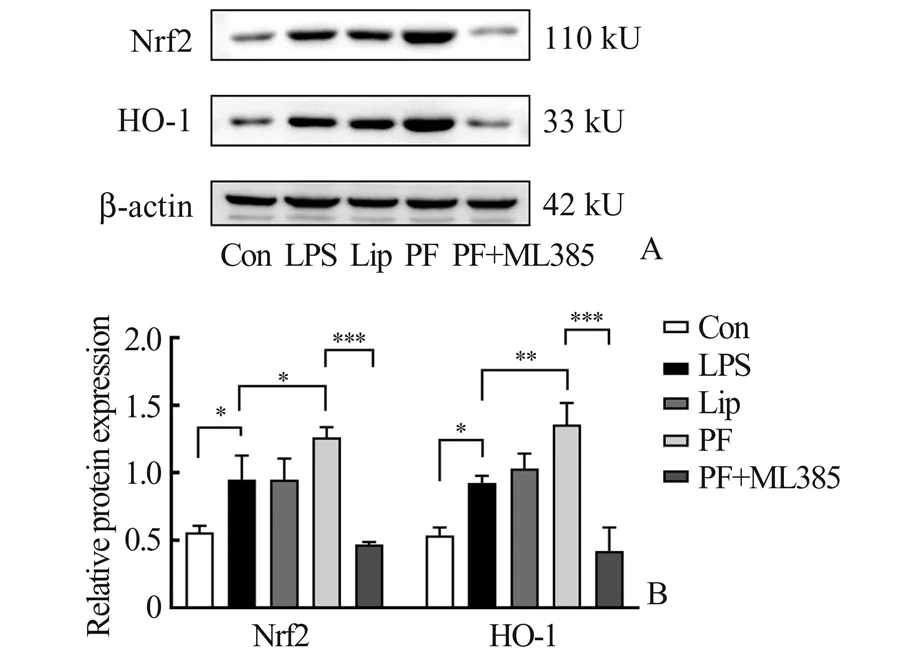
图2 各组小鼠海马组织Nrf2 和HO-1 蛋白表达情况
2.6 丙泊酚对脓毒症小鼠Nrf2 和HO-1 mRNA 表达的影响与Con 组相比,LPS 组小鼠Nrf2 和HO-1 mRNA 表达上调(P<0.05);与LPS 组相比,Lip组无明显变化(P>0.05),PF 组中Nrf2 和HO-1 mRNA 明显上调(P<0.05);相较于PF 组,PF+ML385 组小鼠Nrf2 和HO-1 mRNA 表达明显下调(P<0.05)。见表3。
表3 各组小鼠海马组织Nrf2 和HO-1 的mRNA 表达水平(n=6,±s)
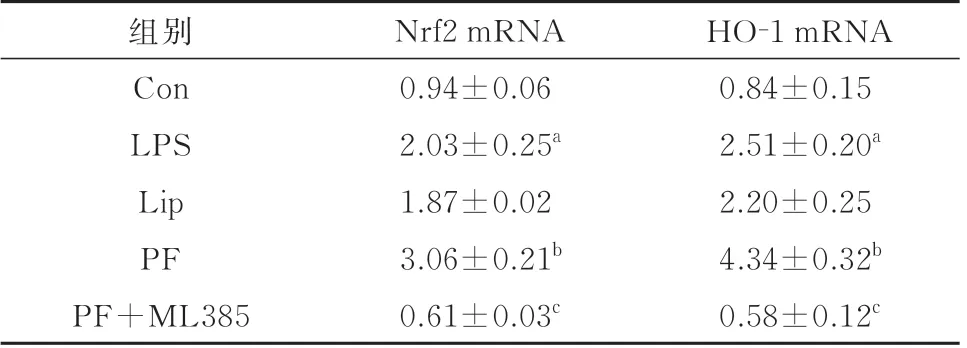
表3 各组小鼠海马组织Nrf2 和HO-1 的mRNA 表达水平(n=6,±s)
与Con 组比较,aP<0.05;与LPS 组比较,bP<0.05;与PF 组比较,cP<0.05
HO-1 mRNA 0.84±0.15 2.51±0.20a 2.20±0.25 4.34±0.32b 0.58±0.12c组别Con LPS Lip PF PF+ML385 Nrf2 mRNA 0.94±0.06 2.03±0.25a 1.87±0.02 3.06±0.21b 0.61±0.03c
3 讨论
本研究参照文献[9]采用腹腔注射LPS 的方法制备脓毒症小鼠脑损伤模型。结果表明,造模24 h后小鼠出现精神萎靡、竖毛、呼吸频率加快、眼角脓性分泌物、拒食或少食等症状,神经功能评分降低,病理学结果显示神经元排列紊乱、核固缩、结构不清晰,提示脓毒症小鼠脑损伤模型制备成功。
脓毒症脑损伤是脓毒症常见的临床并发症之一,可引起意识水平的改变和急、慢性认知功能障碍,严重影响脓毒症患者的预后。海马是边缘系统学习记忆的关键部位,其中CA1 区是缺血损伤和氧化应激的敏感脑区,CA1 区神经元损伤会严重影响认知功能[12]。本研究采用HE 染色观察小鼠海马CA1 区的病理变化,结果显示,脓毒症小鼠的海马CA1 区神经元排列紊乱、核固缩、结构不清晰,而丙泊酚能明显减轻脓毒症小鼠海马CA1 区的神经元损伤,说明丙泊酚对脓毒症脑损伤具有保护作用。
过度的炎症反应和氧化应激被认为是脓毒症脑损伤的潜在机制。TNF-α 和IL-6 作为早期促炎细胞因子,可激活TLR4/NF-κB 信号通路及损伤内皮细胞功能,增加血脑屏障的通透性,导致神经毒性因子和炎性细胞进入脑组织,在易受损伤的脑区诱导神经元凋亡[13]。本研究发现,丙泊酚可明显降低脓毒症小鼠血清TNF-α 和IL-6 水平,表明丙泊酚具有较强的抗炎作用,可抑制脓毒症小鼠的全身炎症反应。另外,脓毒症过程中大量中性粒细胞和巨噬细胞激活,发生呼吸爆发,过量产生的活性氧(ROS)能攻击生物膜中的多不饱和脂肪酸引发脂质过氧化[14]。与Zhu 等[15]研究结果一致,本研究发现脓毒症小鼠海马中脂质过氧化物MDA 含量增加,抗氧化酶SOD 活性降低,而丙泊酚能显著抑制脑组织中MDA 产生,增强SOD 活性,说明丙泊酚能抑制脓毒症小鼠脑组织氧化应激反应,进而发挥抗氧化保护作用。
Nrf2 作为机体抵抗外界氧化刺激的关键转录因子,生理情况下Nrf2 与Kelch 样ECH 相关蛋白1(Keap1)结合存在于细胞质中,当受到外界氧化应激因子或亲核物质刺激后,Nrf2 和Keap1 解离,Nrf2转位进入细胞核,与抗氧化反应元件(antioxidant response element,ARE)结合来激活下游靶蛋白的转录,调控Ⅱ相解毒酶(phase Ⅱdetoxifying enzymes)及抗氧化酶的表达,以清除ROS 等有害物质,维持氧化 还原平衡[16]。HO-1 是参与Nrf2-ARE 抗氧化系统的主要抗氧化酶之一,通过胆绿素还原酶降解血红素为胆绿素、一氧化碳(CO)和亚铁,构成内源性保护物质来调节多种细胞活动[17]。胆绿素与胆红素是机体内源性的强氧化剂,可抑制细胞脂质过氧化,清除氧自由基,直接发挥抗氧化应激的效应;CO 有强大的抗炎作用,可选择性抑制LPS 诱导的TNF-α 和IL-6 等 炎 性 因 子 产 生,促 进IL-10 等 抗 炎因子产生[18]。以上说明HO-1 及血红素降解产物具有抗炎、抗氧化应激及调控细胞凋亡等生物学作用,靶向调控Nrf2 及下游的HO-1 也许能减轻脓毒症所致器官功能障碍。
在LPS 刺激的巨噬细胞中,激活Nrf2/HO-1 通路能减少促炎因子释放及活性氧的产生,而HO-1选择性抑制剂或使用siRNA 沉默HO-1 可消除这种抗炎和抗氧化作用,提示Nrf2/HO-1 通路是调节机体免疫反应的重要靶点[19]。Yu 等[20]研究发现,激活Nrf2/HO-1 通路可升高脓毒症肺组织抗氧化蛋白SOD 和CAT 水平,同时降低MDA 和炎性因子含量,提高小鼠存活率,而敲除Nrf2 可消除氢气对脓毒症小鼠的肺保护作用。上述研究说明激活Nrf2/HO-1 通路可上调如SOD、CAT 等抗氧化酶水平,同时抑制活性氧及促炎因子释放,发挥内源性保护作用。目前有文献[21]报道,丙泊酚能通过调节GSK-3β/Nrf2/HO-1 通路减轻心肌缺血再灌注损伤,但尚未见关于丙泊酚对脓毒症脑损伤及Nrf2/HO-1 的影响的相关报道。本研究结果显示,脓毒症小鼠脑组织中Nrf2 和HO-1 表达增加,而丙泊酚可进一步激活Nrf2 和HO-1 表达,增加SOD 含量同时抑制TNF-α、IL-6 和MDA 水平,说明丙泊酚可能通过上调Nrf2/HO-1 表达来发挥抗氧化应激和抗炎作用。为进一步明确Nrf2/HO-1 通路与丙泊酚发挥脑保护作用的关系,我们使用Nrf2 特异性抑制剂ML385 进行干预。结果显示,ML385 能明显下调Nrf2/HO-1 相关蛋白的表达,拮抗丙泊酚对脓毒症小鼠的脑保护作用,进一步证实丙泊酚减轻脓毒症小鼠脑损伤的机制可能与激活Nrf2/HO-1 通路有关。杨博等[22]实验发现丙泊酚预处理可抑制脓毒症大鼠中枢和外周的炎症反应,减轻大鼠的认知障碍,但其具体的分子机制尚未明确。与该研究不同,本实验研究的是丙泊酚后处理对脓毒症小鼠认知功能的影响并对可能的作用机制进行了探讨,临床上由于脓毒症事件的不可预知性限制了药物预处理的应用,因而药物后处理更具有临床意义。
综上所述,丙泊酚通过抑制炎症反应和氧化应激进而减轻脓毒症小鼠脑损伤,其机制与激活Nrf2/HO-1 通路有关。
