运动对颗粒物暴露幼鼠呼吸道p38MAPK 通路的影响
2022-07-27吴杰妍凌钦亮
吴杰妍 凌钦亮
广州中医药大学第三附属医院 广东 广州 510378
近10 年来,国内的婴幼儿哮喘累及发病率增加超过50%,患病率增加超过50%,严重影响婴幼儿的生长发育[1,2]。悬浮于空气的颗粒物(particulate matter,PM)是大气污染的罪魁祸首,颗粒物具有颗粒小及表面积大的特点,可引起呼吸道病变,随着病程的进展,气道可产生不可逆的重塑或缩窄,严重时可引起呼吸困难。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,p38MAPK 是MAPKs 家族中的主要成员,p38MAPK 通路受到炎性因子、细菌病原体或应激刺激等胞外刺激而被激活,通过磷酸化转录因子调节细胞因子效应基因表达,如激活转录因子、蛋白激酶或核内蛋白质等,影响RNA 转录及蛋白合成,进而调节特定基因表达,引起系列生物学反应而参与细胞生长、发育、分化及凋亡等过程。研究显示与呼吸道病变的气道炎症 与 气 道p38MAPK 通 路 活 化 有 关[3,4]。本 研 究 将幼鼠暴露于模拟的颗粒物环境,分析颗粒物对幼鼠呼吸道的影响及对p38MAPK 通路的调控作用,为婴幼儿呼吸疾病研究提供参考。
1 材料与方法
1.1 实验动物SPF 级健康幼年SD 大鼠(以下简称幼鼠),雌雄各半,购自南方医科大学实验动物中心,合格证号:4402102032,体质量(180±15)g,年龄4~5 周。适应性饲养1 周后开展试验。本研究获我院动物实验伦理委员会批准,实验过程符合科技部制定的《善待实验动物的指导性原则》。
1.2 试剂及药物PM 标准品(SRM1649a),成分为多环芳烃类及多氯联苯类,颗粒直径6.7~100 μm,均值24.4 μm,购自美国商务部国家标准技术委员会;白细胞介素(interleukin,IL)-1、IL-6、IL-10、肿瘤坏死因子(tumor necrosis factors,TNF)-α 与C 反应蛋白(C reactive protein,CRP)酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海济宁酶有限公司;lysis buffer A、DAB 显色试剂盒、BCA 蛋白质浓度测量试剂盒、聚丙烯酰胺凝胶电泳试剂盒、蛋白质提取试剂盒均购自上海生工生物技术有限公司。兔抗鼠P-p38MAPK、p38MAPK(美国Abcam 公司)。Heraeus 型贺力氏台式高速冷冻离心机(美国索福公司原杜邦离心机部和德国贺利氏仪器公司);6010 型紫外可见分光光度仪(美国Agilent Technology 公司);AE200 电子分析天平(上海天平仪器厂)。
1.3 建模方法将幼鼠分为4 组:对照组、PM 暴露组、PM 暴露+运动干预1 组和PM 暴露+运动干预2 组,每组10 只,雌雄各半。将SRM1649a 置于灭菌的磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,使用前采用超声仪超声5 min,采用多功能雾化器,密闭环境的PM 剂量为(150±10)μg/m3,每天将PM 暴 露 组、PM 暴 露+运 动 干 预1 组 和PM 暴露+运动干预2 组的幼鼠置于雾化器中6 h(9:00—12:00,14:00—17:00),连续雾化12 周。对照组同期给予PBS 液雾化吸入。
1.4 运动对PM 暴露+运动干预1 组和PM 暴露+运动干预2 组在雾化同期进行运动干预,运动为纵跳和游泳:PM 暴露+运动干预1 组大鼠纵跳跳箱和电刺激箱作为大鼠纵跳的练习平台。跳跃第1天至第3 天的跳跃高度为10 cm,第4 天开始每天升高2 cm,直至24 cm,每天跳跃20 次,4 d/周;第1 天游15 min,连续3 d,第4 天游20 min,连续3 d,第8天开始每天游泳30 min,水温(29±l)℃,游泳池水深40 cm,4 d/周。PM 暴露+运动干预2 组在运动1 组基础上,次数或时间增加1 倍,即每天跳跃40 次,第1 天游30 min,连续3 d,第4 天游40 min,连续3 d,第8 天开始每天游泳60 min。所有运动均持续12 周,雾化结束,运动干预结束。对照组、PM 暴露组不给予运动干预。
1.5 指标检测
1.5.1体质量 雾化及运动结束后,称重各组幼鼠。
1.5.2气道反应性 雾化及运动结束后,采用Buxco 系统检测幼鼠气道的反应性。采用戊巴比妥钠腹腔注射,全麻幼鼠,气管插管并依次雾化吸入盐 酸 组 胺,浓 度 分 为0、0.01、0.02、0.04、0.08 及0.16 mg/mL,各持续20 s,以盐酸组胺0 mg/mL 的阻力值为基础值1.0,换算其余浓度的阻力值。
1.5.3炎症因子 雾化及运动结束后,全麻幼鼠,开腹,吸取腹主静脉血5 mL,置于非抗凝管。取一硬硅胶管固定在左主支气管内,用37 ℃无菌生理盐水对左肺行支气管肺泡冲洗得到支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),将静脉血和BALF 分别离心得血清和BALF 上清,采用酶联免疫吸附法测定血清BALF 中的IL-1、IL-6、IL-10、TNF-α 与CRP 水平。
1.5.4肺、脾和胸腺的脏器指数、HE 染色 安乐处死各组幼鼠,取幼鼠的肺脏、胸腺和脾脏,称重,计算脾脏和胸腺的脏器指数,脏器指数=(幼鼠脏器质量/幼鼠体质量)×100%。取气道,置于中性甲醛溶液中固定48 h,HE 染色,镜下观察。
1.5.5p38MAPK 通路相关蛋白 用Western Blot法测定气道p38MAPK 通路相关蛋白质。取1.5.4项下气道,加组织完全裂解液lysis buffer A 在冰上超声混匀,以打破组织,离心弃去上清,用PSB 溶液重悬,室温孵育,离心收集上清,用BCA 法测定蛋白浓度,经SDS-PAGE 电泳分离蛋白,转至PVDF 膜上,封闭并加兔抗鼠p38MAPK 一抗、兔抗鼠p-p38MAPK 抗体与兔抗鼠β-actin 一抗,4 ℃孵育过夜,加辣根过氧化物酶标记二抗孵育,显影,用QuantityOne 5.0 软 件 得 到 P-p38MAPK 及p38MAPK 相对表达,p38MAPK 激活程度=P-p38MAPK/p38MAPK。
1.6 统计学方法采用SPSS 17.0 进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNQ检验,检验水平α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 各组幼鼠的体质量、肺指数、胸腺指数和脾脏指数比较与对照组比,PM 暴露组体质量明显降低(P<0.05),肺指数、胸腺指数和脾脏指数均明显增高(P<0.05);与PM 暴露组比,PM 暴露+运动干预1 组和PM 暴露+运动干预2 组体质量明显增高(P<0.05),肺指数、胸腺指数和脾脏指数均明显降低(P<0.05),且与运动干预量呈依赖性趋势,见表1。
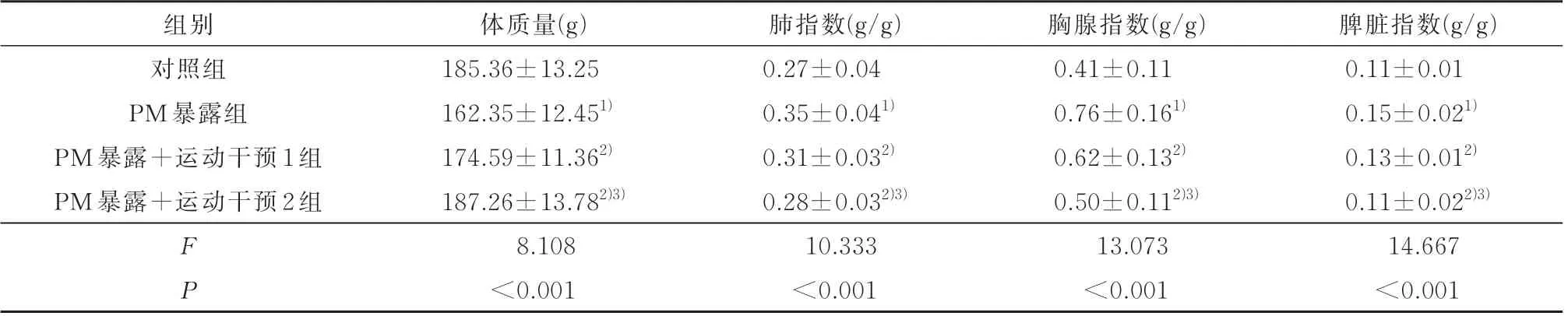
表1 各组幼鼠的体质量、肺指数、胸腺指数和脾脏指数比较
2.2 各组幼鼠的气道反应性比较与对照组比,PM 暴露组气道反应性明显增高(P<0.05);与PM暴露组比,PM 暴露+运动干预1 组和PM 暴露+运动干预2 组气道反应性明显降低(P<0.05),且与运动干预量呈依赖性趋势,见表2。
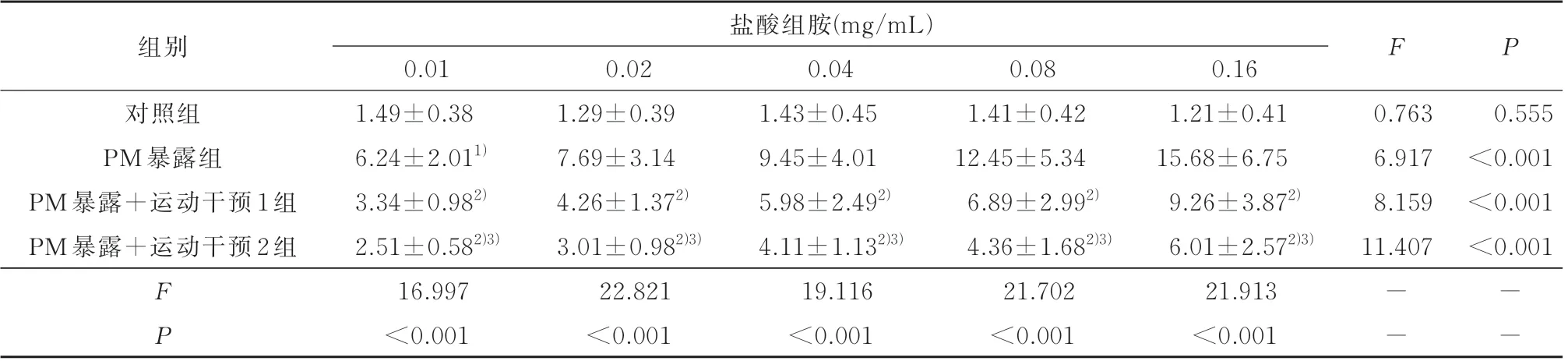
表2 各组幼鼠的气道反应性(cmH2O/(mL·s)
2.3 各组幼鼠血清和BALF 中炎症因子比较与对照组比,PM 暴露组 血清和BALF 的IL-1、IL-6、IL-10、TNF-α 和CRP 均 明 显 增 高(P<0.05);与PM 暴 露 组 比,PM 暴 露+运 动 干 预1 组 和PM 暴露+运动干预2 组血清和BALF 的IL-1、IL-6、IL-10、TNF-α 和CRP 均明显降低(P<0.05),且与运动干预量呈依赖性降低趋势,见表3 和表4。
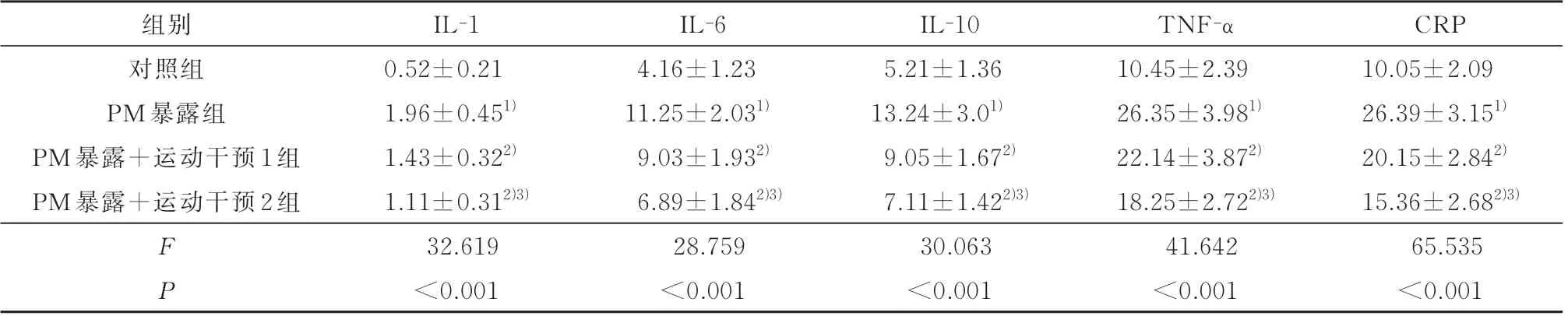
表3 各组幼鼠血清炎症因子比较(ng/mL, n=10)
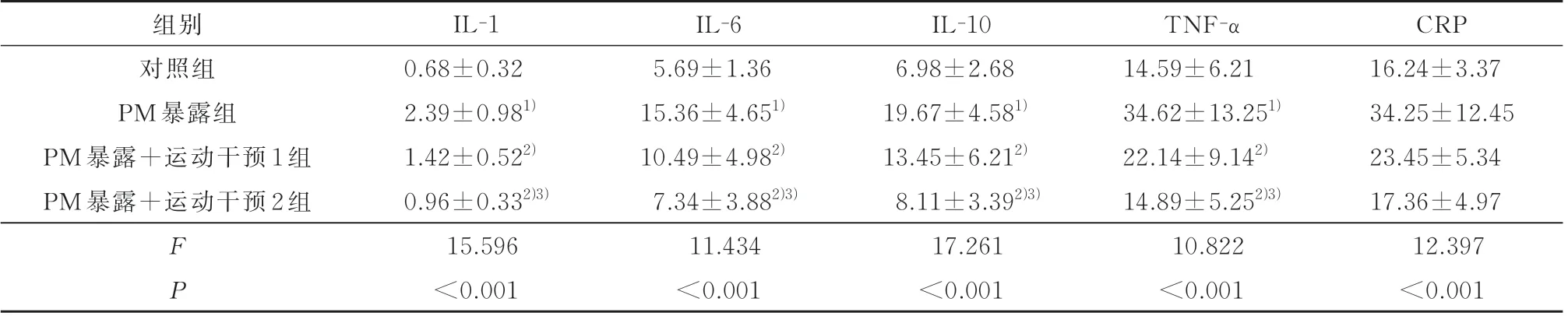
表4 各组幼鼠BALF 炎症因子比较(ng/mL, n=10)
2.4 各组幼鼠气道的HE 比较正常组的气道结构正常,细胞排列紧密,PM 暴露组的气道存在明显的凹陷,气道周围炎性细胞浸润明显,运动干预组的气道存在轻微凹陷,气道周围存在部分炎性细胞浸润,且与运动干预量呈依赖性降低趋势,见图1。
2.5 各组幼鼠气道p38MAPK 通路相关蛋白及激活程度比较P-p38MAPK 与p38MAPK 主要表达在细胞核及细胞质。与对照组比,PM 暴露组气道P-p38MAPK、 p38MAPK 和 P-p38MAPK/p38MAPK 均明显增高(P<0.05);与PM 暴露组比,PM 暴露+运动干预1 组和PM 暴露+运动干预2 组 P-p38MAPK、p38MAPK 和 P-p38MAPK/p38MAPK 均明显均明显降低(P<0.05),且与运动干预量呈依赖性降低趋势,见表5、图1 和图2。
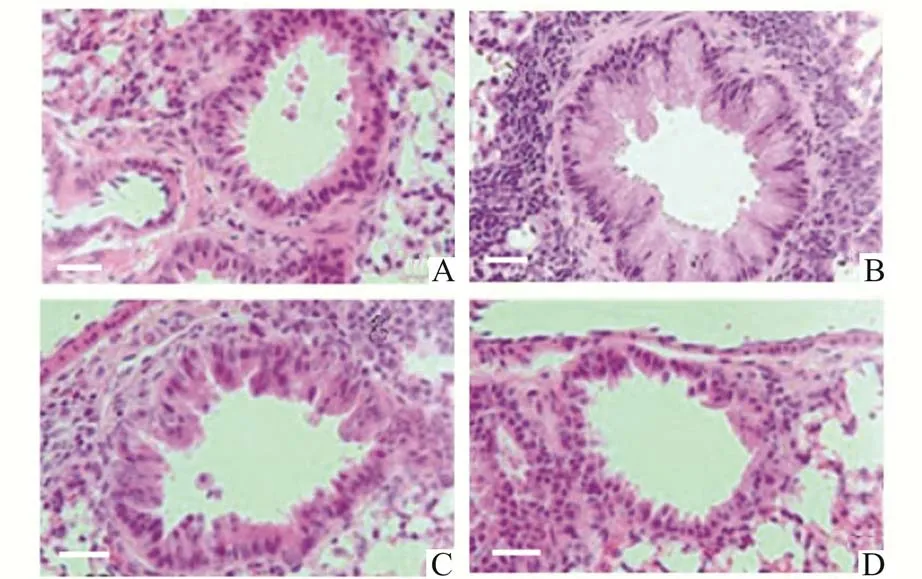
图1 各组幼鼠气道组织HE 染色(×200,标尺:50 μm)
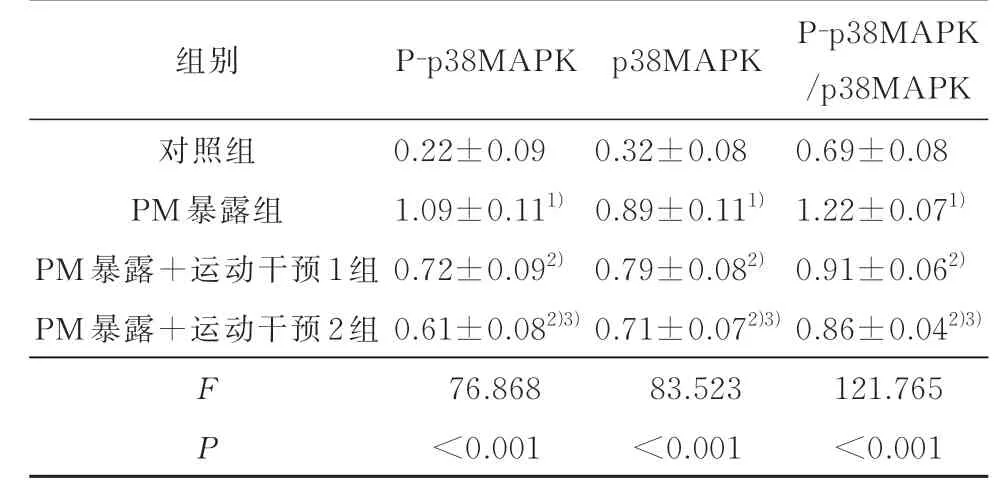
表5 各组幼鼠气道p38MAPK 通路相关蛋白及激活程度比较
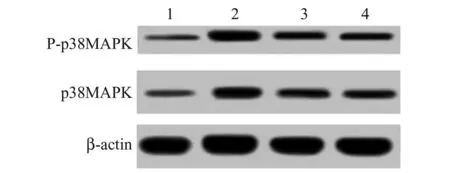
图2 各组幼鼠气道p38MAPK 通路相关蛋白及激活程度比较(Western Blot 法)
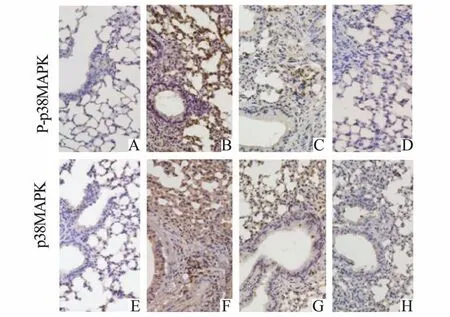
图3 各组幼鼠气道p38MAPK 通路相关蛋白表达(×200)
3 讨论
与健康成人相比,婴幼儿的呼吸道、肺、胸腺及脾等呼吸及免疫器官的发育尚未完全,对空气污染物的敏感性较高,更易产生负面的健康效应,增加了婴幼儿的呼吸系统疾病的发病率[5]。本实验也显示,与对照组比,PM 暴露组经12 周持续的模拟大气PM 雾化,气道已显出炎症反应,肺、脾和胸腺指数增大,提示大气PM 污染可引发气道慢性炎症。
MAPK 是存在于细胞内的一类丝氨酸/苏氨酸蛋白激酶,通过将细胞外的刺激传入细胞核并引起生物学反应。p38MAPK 是MAPKs 家族中的主要成员,由360 个氨基酸构成的蛋白质,参与“刺激信号-活 化 因 子-MAPKKK-MAPKK (MAKK)-MAPK(P38MAPK)-底 物”的 酶 促 级 联 反 应。P-p38MAPK 可激活T 环上三肽基“TXY”中邻近的T(酪氨酸)与Y(苏氨酸)的双重磷酸化,作为p38MAPK 的活化形式,即p38MAPK 通过磷酸化转录因子来调节细胞因子效应基因的表达,P-p38MAPK 改变蛋白构象,激活各种底物,参与多种 反 应,P-p38MAPK/p38MAPK 越 高,p38MAPK活化程度越高。炎性因子或应激刺激等多种因素可激活p38MAPK 通路,被激活的p38MAPK 可作用下游特定的效应器,如激活转录因子、蛋白激酶或核内蛋白质等,影响RNA 转录及蛋白合成,调节特定基因表达[6]。
呼吸道病变的最大病理特征在于炎症反应。研究发现呼吸道病变与炎症相关的通路较多,如NLRP3/IL-1β/TGF-β1、IRF7-IFN-α 和MAPK,其中研究较多较成熟的是MAPK 信号通路[7]。如本研究结果显示,与对照组比,PM 暴露组气道反应性明显增高,且外周血及BALF 中的IL-1、IL-6、IL-10、TNF-α 和CRP 水 平 明 显 增 高,同 时p38MAPK 信号转导通路相关蛋白p38MAPK 和P-p38MAPK 表 达 增 高,P-p38MAPK/p38MAPK 也增高,提示PM 暴露可刺激炎症反应,激活p38MAPK 信号通道,p38MAPK 信号转导通路的激活与炎症反应密切相关,该结果与文献报道类似。如Huang 等[8]研究显示,颗粒物可以通过氧化应激和炎症反应引起肺损伤,氧化应激和炎症反应可激活p38MAPK 通路。Zhen 等[9]认为颗粒物诱导细胞凋 亡 和MAPK 通 道,MAPK 信 号 通 路 在PM2.5 诱导的皮肤损伤中起关键作用。
研究显示,运动可显著减轻炎症反应,可能与运动调控气道的p38MAPK 信号通道相关[10]。运动可通过抑制p38MAPK 信号通道减轻疾病严重程度,如龚彦豪等[11]发现运动通过调控MAPK 信号通道的ERK 和p38MAPK 水平达到保护急性力竭心脏损伤;Baghaiee 等[12]认为早期运动干预通过降低心脏组织p-p38 MAPK 蛋白表达改善心脏组织的重塑病变;王洋等[13]对雄性SD 大鼠给予运动干预,结果显示运动通过调控p38MAPK 蛋白表达增加了骨骼肌总蛋白的合成,预防骨骼肌萎缩。但也有研究[14,15]显示,过度运动可促进炎症反应,诱发哮喘或其他病变,如李改新[16]研究表明对哮喘儿童进行不同方式一次运动均可使外周白细胞、中性粒细胞、淋巴细胞、单核细胞计数增高;郑妩媚等[6]研究显示,过度运动或高强度运动可上调心肌组织的p38MAPK 表达,增强炎症反应,给予p38MAPK 抑制剂SB203580 可显著降低炎症反应;Zhang 等[17]研究认为,运动可用于预防血压升高和改善血管功能,与运动调控p38MAPK 通道进而调控血管平滑肌细胞表型转换相关。本课题设定了2 种不同量的运动干预,大量指标显示出运动量相关的趋势变化,可见本研究的运动剂量尚未达到过度的程度,而且运动在调控p38MAPK 存在双向效应,因此下一步研究有必要考察运动强度、持续时间及运动间隔等与p38MAPK 通路的关联。
综上,颗粒物可激活幼鼠呼吸道的p38MAPK通路,给予运动干预可降低p38MAPK 通路的P-p38MAPK、p38MAPK 蛋白表达,降低炎性反应,改善肺、脾和胸腺的脏器指数。长期暴露在大气污染的环境可激活呼吸道的p38MAPK 通路,引发炎症反应,适当运动可抑制p38MAPK 通路活性,降低炎症,改善肺功能及免疫功能。
