外周血粒细胞集落刺激因子、肿瘤坏死因子-α水平对未足月胎膜早破并宫内感染的诊断价值
2022-07-27马莱超隋红梅
方 雪,马莱超,隋红梅
(天津市北辰区中医医院 妇产科,天津300400)
胎膜早破(premature rupture of fetal membranes,PROM)是围产期常见的并发症之一,指临产前胎膜自然破裂的情况,临床通常将<37孕周的PROM称为未足月(preterm PROM,PPROM)[1]。积极的保胎是PPROM的主要干预手段,但仍有超过一半的患者在破膜后1周内分娩,且可并发宫内感染(13%-60%),从而增加围生儿病死风险[2]。因此对PPROM患者发生宫内感染情况及早做出判断,采取有效的干预措施,对于改善围生结局有重要意义。粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)主要由炎症因子及内毒素活化的单核细胞和巨噬细胞产生,其水平的异常升高与机体的炎症程度有关[3-4]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种涉及系统性炎症的细胞因子,也是引起急性相反应的众多细胞因子中的一员,能够活化单核细胞及巨噬细胞,是炎症性感染疾病的常用辅助判断指标[5]。本研究探讨外周血G-CSF及TNF-α水平与PPROM并发宫内感染的关系,为疾病的防治提供参考,以改善PPROM并发宫内感染患者的围生结局。
1 资料与方法
1.1 临床资料
90例PPROM患者为2018年12月-2020年12月来天津市北辰区中医医院就诊患者,纳入标准:符合《胎膜早破的诊断与处理指南(2015)》[6]中对胎膜早破的诊断;胎膜早破发生至入院时间<72 h;活产妊娠。排出标准:高龄产妇;伴有机体重要器官功能障碍及恶性肿瘤者;先天性子宫畸形。将PPROM患者作为研究组,年龄21-34岁,平均(27.56±3.45)岁;孕周29-37周,平均孕周(33.45±3.21)周;其中初产58例,经产32例。另从同期按时来院产检的正常健康孕妇中选取90例为对照组,年龄22-34岁,平均(27.40±3.20)岁;孕周28-37周,平均孕周(33.60±3.01)周;其中初产53例,经产37例。2组研究对象的年龄、孕周、产次比较差异无统计学意义(P>0.05),具有可比性。本研究在实施前已获医院伦理委员会批准通过,且受试者均签署知情同意书。
1.2 外周血G-CSF和TNF-α水平检测入院后进行常规产检,抽取肘部静脉血6 ml,3 000 r/min速度离心15 min,离心半径12 cm,以酶联免疫吸附试验双抗体夹心法检测G-CSF水平,放射免疫分析法检测TNF-α水平,试剂盒购于上海碧云天生物技术有限公司,严格按照试剂盒操作说明书实施各项操作步骤。
1.3 患者宫内感染诊断参照《中华妇产科学》[7]中对绒毛膜羊膜炎实验室诊断标准:外阴常规消毒后,以窥阴器扩张,使用一次性无菌注射器抽取羊水约5 ml进行病理学诊断,高倍镜下观察,其中中性粒细胞>5个/高倍镜视野即可诊断为绒毛膜羊膜炎(宫内感染)。
1.4 资料收集根据研究组患者是否发生宫内感染,分为感染组与未感染组,统计患者的一般临床资料,除G-CSF和TNF-α水平外,包括年龄、BMI、孕周、产次、流产/引产史、是否单胎、破膜后阴道镜检查次数、羊水过少、生殖道感染、妊娠期糖尿病、妊娠合并贫血、胎位异常、白细胞计数(white blood cell,WBC)、C反应蛋白(C-reactive protein,CRP)水平。
1.5 统计学分析

2 结果
2.1 研究组与对照组患者外周血G-CSF和TNF-α水平
研究组的外周血G-CSF、TNF-α水平均高于对照组,差异有统计学意义(P<0.05),见表1。
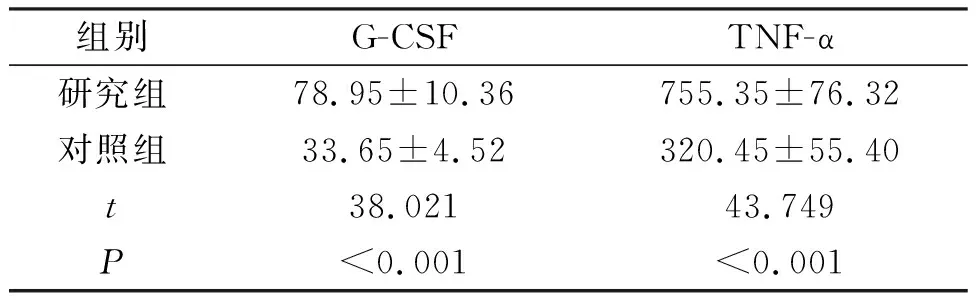
表1 2组患者外周血G-CSF和TNF-α水平(n=90,ng/L)
2.2 感染组与未感染组患者的临床资料
PPROM患者中有43例发生宫内感染。感染组非单胎、羊水过少、生殖道感染占比及外周血G-CSF和TNF-α水平均高于未感染组(P<0.05)。2组患者年龄、BMI、孕周、产次、流产/引产史、妊娠期合并糖尿病、妊娠合并贫血、破膜后阴道镜检查次数、胎位异常、WBC和CRP比较,差异无统计学意义(P>0.05),见表2。

表2 感染组与未感染组患者的一般临床资料
2.3 Logistic回归分析影响PPROM患者并宫内感染的危险因素
将感染组与未感染组患者有统计学差异的因素作为自变量,包括单胎、羊水过少、生殖道感染、G-CSF、TNF-α,是否发生宫内感染为因变量纳入Logistic回归分析,结果显示:羊水过少、生殖道感染、外周血G-CSF和TNF-α水平均是影响PPROM患者的危险因素(P<0.05),见表3。
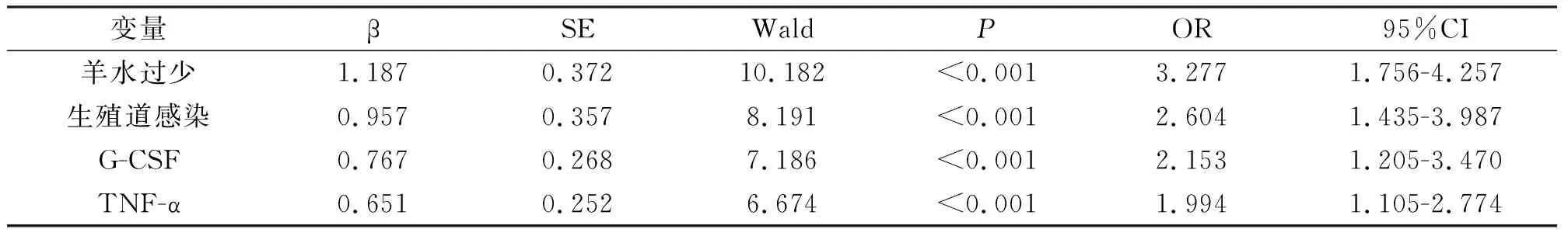
表3 Logistic回归分析影响PPROM患者的危险因素
2.4 外周血G-CSF、TNF-α水平对PPROM合并宫内感染的诊断价值
G-CSF与TNF-α分别以71.516 ng/L、763.65 ng/L为最佳截断点,诊断PPROM合并宫内感染的AUC为0.799(95% CI:0.758-0.906)、0.736(95% CI:0.633-0.824)、约登指数分别为0.500、0.462,二者联合(即两种方式均为阳性结果则判定为阳性结果)的AUC与约登指数分别为0.862(95% CI:0.773-0.926)和0.552,见表4。
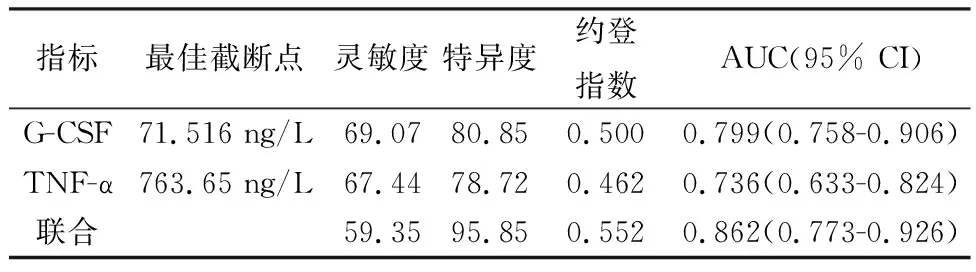
表4 外周血G-CSF和TNF-α对PPROM合并宫内感染的诊断价值

图1 外周血G-CSF和TNF-α水平诊断PPROM并发宫内感染的ROC曲线
3 讨论
PPROM在发生后细菌可逆行进入羊膜腔,造成急性绒毛膜炎,即宫内感染,且受胎膜破裂时间长、羊水流出量少或破口小等因素影响,部分患者可无明显的临床症状,导致治疗延迟,增加患者凝血机制改变风险,导致早产、流产、死产、胎儿宫内窘迫、新生儿感染等不良妊娠结局[8-9]。既往临床对于宫内感染的判断主要是根据胎盘组织细菌培养及病理诊断,因诊断周期长、实验条件要求高等缺陷无法快速作出判断[10]。因此寻找更加安全、方便、灵敏的外周血相关指标及早对PPROM后的宫内感染做出诊断具有重要意义。
本研究结果中与对照组正常孕妇比较,研究组的外周血G-CSF、TNF-α水平更高,说明G-CSF、TNF-α水平与PPROM的发生有关。G-CSF是具有多种生物作用的因子,有调节粒系组细胞增值、分化和成熟,以及维持血液循环中白细胞数量的作用,且与胎盘细胞的生长有关[11]。研究发现[12],妊娠期早孕期和分娩时,绒毛膜绒毛和母体的蜕膜组织可分泌G-CSF,但其早孕期水平更高,而PPROM患者以孕中后期为主,提示PPROM者水平异常。TNF-α作为机体重要的炎症因子,在机体炎性疾病发生发展的过程中有重要的参与和介导作用,能被绒毛膜细胞、滋养层细胞、单核巨噬细胞和中性粒细胞释放,参与机体的液体循环,其表达的升高能抑制胶原合成,促进胎膜细胞的凋亡,导致PPROM的发生,因此,TNF-α可作为PPROM发生的生物学标志物[13-14]。PPROM的发生不仅与机械性刺激、创伤、胎膜发育障碍等因素有关,亦与感染互为因果,因此存在G-CSF、TNF-α水平升高的情况。
本研究对PPROM患者宫内感染组与未感染组的临床资料进行统计,发现二组在非单胎、生殖道感染、羊水过少、外周血G-CSF、TNF-α水平方面存在差异,进一步实施Logistic回归分析结果显示羊水过少、生殖道感染、外周血G-CSF、TNF-α水平均是影响PPROM患者宫内感染的危险因素。机体在受到内毒素、抗原及炎症等刺激下,可刺激G-CSF与TNF-α的生成,增强外周血液循环中粒细胞的数量,而感染与PPROM的发生可相互促进,因此G-CSF与TNF-α水平的升高可影响宫内感染的发生,能够作为宫内感染的参考标记物[15]。王杰等[16]研究结果显示:非单胎、破膜孕周及破膜后阴道镜检查次数亦与PPROM并宫内感染的发生有关,与本研究结果存在差异,分析原因可能为本研究选取病例非单胎较少,且严格控制不必要的阴道镜检查次。此外本研究中以ROC曲线评价外周血G-CSF与TNF-α水平对PPROM并宫内感染发生的诊断价值,结果显示二者分别以71.516 ng/L、763.65 ng/L为最佳截断点,其诊断宫内感染的AUC为0.799、0.736,约登指数为0.500、0.462,而联合的AUC与约登指数分别为0.862和0.552,说明二者均对PPROM并宫内感染发生有一定的诊断价值,而联合应用的价值更好。
综上所述,PPROM患者外周血G-CSF和TNF-α水平异常升高,且是影响宫内感染发生的危险因素,二者联合检测可作为诊断PPROM并宫内感染发生的标记物。
