山羊溶血性曼氏杆菌病的诊断
2022-07-26蒋小刚广西壮族自治区畜牧研究所吴翠兰彭昊李军广西壮族自治区兽医研究所广西兽医生物技术重点实验室
文│蒋小刚(广西壮族自治区畜牧研究所) 吴翠兰 彭昊 李军(广西壮族自治区兽医研究所,广西兽医生物技术重点实验室)

溶血性曼氏杆菌为变形菌门、γ-变形菌纲、巴氏杆菌目、巴氏杆菌科、曼氏杆菌属的成员,是一种革兰氏阴性短杆菌的条件性致病菌,通常寄居在动物上呼吸道中。溶血性曼氏杆菌能感染山羊、绵羊、牛、鹿、狗、猫、鳄鱼等多种动物。羊感染溶血性曼氏杆菌通常引起肺炎、新生羔羊急性败血症,给养殖行业造成重大经济损失。2022年3月,广西某羊场发生一起溶血性曼氏杆菌病的病例,现将诊断结果报道如下。
一、临床症状和病理变化
广西某羊场存栏山羊约100头,已按照既定免疫程序免疫口蹄疫灭活疫苗、小反刍兽疫弱毒疫苗和三联四防疫苗,定期在饲料中添加驱寄生虫药。2022年3月,该养殖场从外县购买30头羊,购买10天后,部分羊只开始出现精神沉郁、采食减少,随后表现为咳嗽、流鼻涕、发烧、呼吸困难等症状,发病率为36.7%(11/30)。对病死山羊进行剖检,剖检发现肺脏有出血,胸腔和腹腔有积液,肝、脾无明显变化。
二、病料采集
无菌采集病死山羊的肺、胸腔积液及腹腔积液。
三、病原检测
1.细菌分离。用接种环挑取采集的肺、胸腔积液、腹腔积液,在血琼脂平板、胰蛋白胨大豆琼脂平板上进行接种,37℃培养24小时后挑取单个菌落进行纯培养,然后再挑取纯化后的菌落进行革兰氏染色、光学显微镜下镜检。细菌分离结果显示,胰蛋白胨大豆琼脂平板上出现光滑、圆润的细小菌落,而血平板上出现β溶血的细小菌落,镜检为革兰氏阴性短杆菌。
2.支原体分离。将采集的肺和积液充分研磨,混匀后取上清,一部分置于-20℃备用,一部分用0.45微米滤器过滤。再将滤液加入到支原体培养基上放置于含有5% CO2的培养箱中37℃培养4~5天。连续传2代后,再用接种环划线接种于支原体固体培养基上,放置于含有5%CO2的培养箱中37℃培养4~5天,观察菌落生长情况。结果显示,支原体液体培养基无明显变色,固体培养基上也未有菌落生长,说明无支原体生长。
3.分离菌生化鉴定。采用细菌微量生化反应管对分离菌株进行生化指标测定,将纯化的菌落接种于葡萄糖、氧化酶、甘露醇、山梨醇、木糖、麦芽糖、山梨糖、海藻糖、甘露糖和脲酶的生化鉴定管中,放置于37℃培养箱中培养24小时,观察细菌生化特性。生化试验结果显示,该菌能发酵葡萄糖、氧化酶、甘露醇、山梨醇、木糖和麦芽糖;而山梨糖、海藻糖、甘露糖和脲酶为阴性反应。此结果与陆承平《兽医微生物学》(第三版)的溶血性曼氏杆菌的特性相符合,初步判断该分离株为溶血性曼氏杆菌。
4.PCR检测。
(1)反应模板制备。以上述组织上清液和分离菌为样本,按照细菌基因组DNA提取试剂盒说明提取组织上清和分离菌的DNA,然后-20℃保存,备用。
(2)PCR引物。参考吴翠兰等文献合成绵羊肺炎支原体、丝状支原体山羊亚种、多杀巴氏杆菌、化脓隐秘杆菌、溶血性曼氏杆菌的引物,引物由生工生物工程(上海)股份有限公司合成。
(3)PCR鉴定。分别以上述组织上清液和分离菌的DNA为模板,以绵羊肺炎支原体、丝状支原体山羊亚种、多杀巴氏杆菌、化脓隐秘杆菌、溶血性曼氏杆菌特异性引物为引物进行PCR扩增,反应程序为95℃预变性5分钟;然后进行30个循环95℃变性30秒、49~53℃退火40秒、72℃延伸30秒;最后72℃延伸10分钟。扩增结束后,取7微升PCR产物在1.5%的琼脂糖凝胶上进行电泳,观察电泳结果。
(4)电泳结果。电泳结果发现,组织上清液模板和分离菌的DNA模板均扩出溶血性曼氏杆菌目的条带,表明该病原为溶血性曼氏杆菌,该结果与前述生化鉴定结果相符合。而羊肺炎支原体、丝状支原体山羊亚种、多杀巴氏杆菌、化脓隐秘杆菌特异性引物均未扩出相应条带。
5.动物致病性试验。将10只健康的昆明鼠随机分成1个试验组和1个对照组,试验组每只小鼠腹腔注射分离菌(1×109CFU/毫升)0.3毫升,另一组每只小鼠则注射同等剂量的生理盐水作为对照组,观察小鼠的身体状况,记录结果。试验组小鼠在注射后6小时开始出现行动缓慢、精神沉郁,在24小时内已有60%(3/5)的小鼠出现死亡。对死亡小鼠进行剖解,发现肺肿胀、充血。从小鼠肺中回收分离到的细菌。
6.药物敏感性试验。取100微升纯培养的细菌均匀涂在胰蛋白胨大豆琼脂平板上,然后用无菌镊子分别夹取23种药敏纸片贴在平板上,置于37℃培养24小时,测量各种药敏纸片的抑菌圈直径并判断药敏结果。结果显示,该分离菌对罗红霉素、头孢噻肟、阿米卡星、头孢他啶、卡那霉素、壮观霉素等6种药物敏感;对头孢曲松、利福平、青霉素、四环素、林可霉素、恩诺沙星、氧氟沙星、环丙沙星、链霉素、氨苄西林、复方新诺明等17种药物耐药,药敏试验结果见表1。
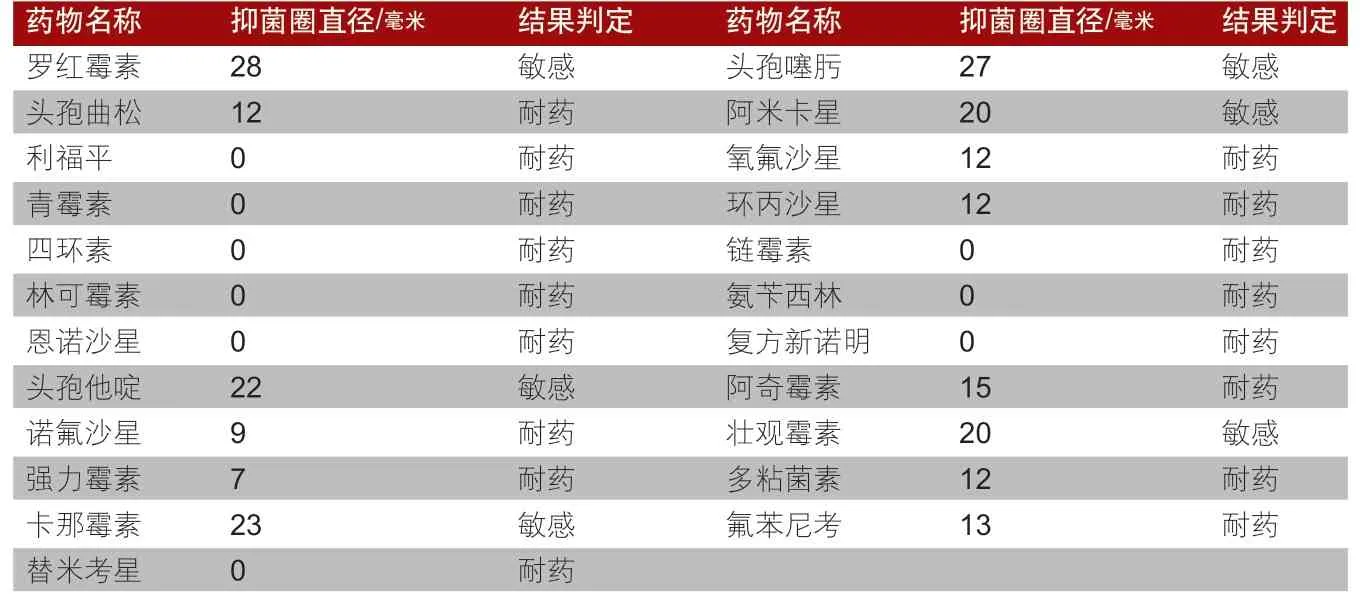
表1 药敏试验结果
四、诊治结论
根据临床症状、病理变化、细菌分离培养、支原体分离、分离株生化鉴定、PCR检测、动物致病性试验等,确定该起病例是由溶血性曼氏杆菌引起的。
关于该病的治疗,首先对病羊进行隔离,对污染的羊圈和场地进行消毒处理。其次,采用敏感药物卡那霉素和头孢噻肟进行治疗。再次,加强饲养卫生管理,消除各种诱发因素,防止寄生虫侵袭,增强体质。经过治疗后羊只病情逐渐好转。
五、预防措施
羊病预防措施主要包括提高羊只抗病能力、做好环境卫生和消毒、疫苗接种、药物预防和定期驱虫。
1.提高羊只抗病能力。及时补饲,特别是正在发育的幼龄羊、怀孕和哺乳期的成年母羊进行合理补饲尤为重要。坚持自繁自养和严进严出的原则,不仅减少入场检疫的工作量,还可有效避免因羊只引入而带入新的传染源。羊只只能从非疫区购入,经当地兽医部门检疫并签发检疫合格证明。到达该场后再经本场所在地的兽医检疫,隔离观察42天,确认为健康者,经药浴、驱虫、消毒方可与原有羊群混养。
2.搞好环境卫生和消毒。净化养殖场周边环境,减少病原微生物的滋生和疫病传播,对羊圈、活动场地及用具要经常清扫,保持洁净、干燥。及时清除粪便和污物,堆积发酵。饲草饲料要尽量保持新鲜、清洁和干燥,防止发霉变质。羊场要建立切实可行的消毒制度,定期对羊舍、用具、地面土壤、粪便、污水、皮毛等进行消毒。
3.传染病的预防接种。疫苗接种能激发羊只产生抗体,使其对该种疫病由敏感转为不敏感。羊场应根据自身制定合理的免疫程序。
4.药物预防和定期驱虫。药物预防是指定期将适量药物拌入饲料中,或溶解在饮水中进行群体药物预防。但长期使用药物预防容易产生耐药菌株,影响药物的预防效果,因此,要经常进行药敏试验,选择有高度敏感性的药物用于防治,最好是将几种药物交替使用,这样可以延缓耐药性菌株的产生速度。此外羊体内或体表会存在一些寄生虫,因此,还要定期驱虫。
六、讨论
溶血性曼氏杆菌是引起山羊呼吸道疾病的重要病原之一,其致病率较高,发病率达50%左右。溶血性曼氏杆菌病的发生往往是由于气候变化、长途运输等应激因素引起的,还可能是支原体等病原入侵机体而引起的继发感染。该研究从调运的山羊中分离出1株具有致病性的溶血性曼氏杆菌,进一步证实山羊受应激时容易引起溶血性曼氏杆菌病。

在动物致病性试验中,小白鼠在攻毒分离菌6小时后开始出现行动缓慢、精神沉郁的情况,在24小时内已有60%的小鼠出现死亡。剖解死亡小鼠发现肺肿胀、充血,同时,从小鼠肺中分离到该菌。说明该分离株具有很强的致病性。相关研究发现,溶血性曼氏杆菌的致病性与血清分型及毒力因子息息有关。目前溶血性曼氏杆菌共有12种血清型,分别为A1、A2、A5、A6、A7、A8、A9、A12、A13、A14、A16和A17,其中流行最广的血清型是A1、A2、A6,其次为A7、A9、A11和A12。在相关报道中,羊溶血性曼氏杆菌的优势血清为A1和A2,Fodor等对匈牙利山羊溶血性曼氏杆菌进行血清型分析,发现A2血清型占比为94%;郝敏等对四川省某羊场分离到的19株绵羊源溶血性曼氏杆菌进行血清型分型,结果显示,7株为A1型,11株为A2型;江金欢等对西藏地区某养殖场分离出的1株绵羊源溶血性曼氏杆菌进行血清型分型,结果显示,该分离株为A2型;Abay等对山羊源溶血性曼氏杆菌进行血清型分型,发现A1血清型占比最高,为43.5%,其次为A2和A7;王晨骁等发现陕西某奶山羊养殖场分离出的溶血性曼氏杆菌为A2型。而本次分离菌株属于哪一种血清型还有待进一步确定。溶血性曼氏杆菌的毒力因子较多,如白细胞毒素、脂多糖、外膜蛋白、荚膜、黏附素等。白细胞毒素主要作用于反刍动物白细胞,引起白细胞的凋亡和坏死,还可引起溶血和血小板集聚。而本研究分离到的菌株有溶血现象,推测该分离株可能含有白细胞毒素。
本研究采用临床上比较常用的23种药物进行药敏试验,结果显示,该分离菌对罗红霉素、头孢噻肟、阿米卡星、头孢他啶、卡那霉素、壮观霉素等6种药物敏感;对头孢曲松、利福平、青霉素、四环素、林可霉素、恩诺沙星等17种药物耐药。由此可见,该菌株耐药性较为严重。试验结果前人报道的不太一致,说明不同地区、不同物种分离到的菌株其耐药性存在差异,这可能与不同地区的免疫程序和用药情况不同有关。因此,通过药敏试验可以筛选出敏感性药物,进而对溶血性曼氏杆菌病进行预防与治疗,避免该类疾病的过度传染,造成重大经济损失。
七、结语
本试验从调运过程中发病的山羊体内分离出革兰氏阴性短杆菌,经过鉴定为溶血性曼氏杆菌,并对小白鼠具有致死性。经药敏试验发现,该分离株对多种药物耐药,只对少量药物敏感,研究结果对该场治疗山羊感染的溶血性曼氏杆菌用药提供了参考。
