重组大肠杆菌产卤代烷脱卤酶的发酵条件优化
2022-07-25名晓东郭自涛陈剑雄顾正华辛瑜孙海彦关彦明张梁
名晓东,郭自涛,陈剑雄,顾正华,辛瑜,孙海彦,关彦明,张梁*
1(江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)2(中国热带农业科学院热带生物技术研究所,海南 海口,571101)3(中国食品发酵工业研究院有限公司,北京,100015)
工农业生产过程中会产生大量的卤代化合物,这些化合物具有高毒性、持久性以及生物浓缩性,对人类健康以及生态环境构成了巨大的危害[1-2]。传统的化学消解、焚烧等处理方法在处理过程中会产生新的有毒副产品。同时,这些化学试剂大多属于有毒试剂,使用时或使用后会产生新的环境污染问题。因此,迫切需要开发安全、绿色的处理方法[3]。生物酶处理法具有温和、环保、无毒、无腐蚀的特点,逐渐成为治理环境污染物的研究热点。
卤代烷脱卤酶(EC3.8.1.5,HLDs)是一类能够催化卤代烷烃化合物碳-卤键断裂的水解酶,可以将底物转化为相应的醇、卤素离子与质子,整个酶促反应过程中仅需水作为唯一的辅助因子,不需要辅酶/辅基或者氧的参与[4]。此外,其底物谱比较广泛,可以催化氯代、溴代、碘代烷烃、环烷烃、酯、醚、环氧化物等化合物的水解[5]。基于其底物的多功能性,HLDs在多种领域具有应用潜力,例如工业催化、环境污染物的降解、化学过程副产品的回收、环境污染物的生物传感以及蛋白分析与分子成像等[4,6-8]。DhaA是最具有代表性的卤代烷烃脱卤酶之一,该基因最早从RhodococcusrhodochrousNCIMB 13064中分离出来[9],DhaA不仅对工业副产品三氯苯酚有降解作用[10],同时对糜烂性毒剂芥子气也有一定的降解作用[11]。然而,其广泛的应用目前主要受限于酶的稳定性与产量方面[12]。目前,对于此酶的研究主要通过定点突变提高酶的催化效率及热稳定性[13-15];通过固定化的手段提高酶的温度、pH、金属离子、有机溶剂耐受性以及储藏稳定性[16-18]。然而,对于提高其表达量的研究较少。因此,在提升其稳定性的同时,提高酶的表达量将促进其生产应用。
本研究中,对已构建好的重组大肠杆菌BL21(DE3)/pET28a-DhaA在摇瓶中进行发酵培养基与发酵工艺的优化,并在5 L发酵罐中进行了工艺放大验证。本研究将为DhaA的进一步放大生产奠定基础,同时也将为其他种类HLD的发酵生产提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 菌种
重组大肠杆菌BL21(DE3)/pET28a-DhaA,本实验室保存。
1.1.2 培养基
种子培养基(LB)(g/L):蛋白胨10,酵母粉5,NaCl 10。
基础培养基(TB)(g/L):甘油5,酵母粉24,蛋白胨12,KH2PO42.31, K2HPO412.54。
发酵培养基(g/L)(pH 7.0):甘油10,酵母粉23,蛋白胨14,MgSO4·7H2O 1.3,ZnSO4·7H2O 0.1。
1.2 实验仪器
JY92-IIDN超声细胞破碎仪,宁波新芝生物科技有限公司;T&J Atype 5 L玻璃发酵罐,上海迪比尔生物工程有限公司;V-1200可见分光光度计,上海美普达仪器公司;MQD-B3R摇床,上海旻泉仪器有限公司;Spark全自动酶标仪,TECAN公司;数显恒温水浴锅,上海博讯实业有限公司。
1.3 实验方法
1.3.1 种子活化
将保存于-70 ℃冰箱的菌种在固体LB培养基进行划线,在37 ℃恒温培养箱培养14~16 h;挑取单菌落于装有15 mL LB培养基的50 mL三角瓶中37 ℃培养12~13 h作为一级种子液;按2%(体积分数,下同)接种量接种于装有50 mL LB培养基的250 mL三角瓶中培养9 h(对数中后期)作为二级种子液。
1.3.2 粗酶液的收集
将发酵后的菌体转移至离心管进行收集,使用0.1 mol/L的Gly-NaOH(pH 8.6)缓冲液将菌体洗涤2遍后进行超声破碎。破碎完毕离心去除细胞碎片,上清液即为粗酶液。
1.3.3 酶活力的测定
酶活力定义:在一定条件下,1 min催化底物产生1 μmol Cl-所需的酶量定义为1个酶活力单位。
酶活力测定方法:双(2-氯乙基)醚作为底物,总反应体系500 μL,缓冲液为0.1 mol/L Gly-NaOH,底物的终浓度为10 mmol/L,加酶量为10 μL粗酶液。40 ℃反应20 min后,吸取200 μL加入装有20 μL 30%(体积分数)HNO3离心管中终止反应,之后加入55 μL Hg(SCN)2溶液和110 μL NH4Fe(SO4)2溶液,混匀静置10 min后取200 μL加入96孔板中,使用酶标仪测量在460 nm下的吸光度[16,19]。
1.3.4 SDS-PAGE
将发酵取样的菌体浓度稀释至同一水平,0.1 mol/L的Gly-NaOH(pH 8.6)缓冲液洗涤2遍后进行超声破碎,离心去除细胞碎片,上清液即为粗酶液。取20 μL的上清液,加入5 μL上样缓冲液,沸水浴10 min后,离心,上样量均为10 μL。电泳结束后,进行染色脱色处理。
1.4 初始培养方法
以2%接种量将二级种子液接种于50 mL基础培养基中(250 mL三角瓶),37 ℃培养至OD600=0.8时加入终浓度为0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)25 ℃诱导13 h。
1.5 培养基优化
1.5.1 单因素实验
以OD600与酶活力为指标,依次以碳源种类、碳源浓度、氮源种类、氮源浓度、磷酸盐浓度、无机盐种类、无机盐浓度、金属离子种类以及金属离子浓度为影响因素进行单因素实验。
1.5.2 Plackett-Burman(PB)实验
在单因素的基础上进行PB实验设计,对培养基成分进行关键因素的筛选,各因素选取2个水平,高水平为低水平的1.5倍,以酶活力作为实验响应值进行实验。实验水平设计见表1。

表1 PB实验设计的因素与水平 单位:g/LTable 1 Factors and levels of PB experimental design
1.5.3 Box-Behnken实验
以PB实验筛选出的3个显著影响因素(酵母粉浓度、蛋白胨浓度、MgSO4·7H2O浓度)为实验因素进行Box-Behnken实验设计,各因素设置3个实验水平,以酶活力作为响应值。实验水平设计见表2。

表2 Box-Behnken实验设计的因素与水平 单位:g/LTable 2 Factors and levels of Box-Behnken experimental design
1.6 摇瓶发酵条件优化
在优化的最佳培养基的基础上,对发酵条件中的诱导时机、接种量、诱导温度、诱导剂浓度、装液量进行优化。
1.7 发酵罐验证
分批发酵:5 L发酵罐中,2.5 L的初始装液量,接种量为5%。接种前加入一定量的卡那霉素,使其终质量浓度为50 mg/L,通气比为1 vvm,溶氧为30%,溶氧与转速进行偶联,pH 7.0,使用10%(体积分数)硫酸与50%(体积分数)氨水进行pH的调控。37 ℃培养4 h后,温度降至20 ℃,加入终浓度为0.4 mmol/L的IPTG进行诱导。
补料分批发酵:在分批发酵的基础上恒速流加50%(体积分数)的甘油,溶氧反弹作为流加甘油的标志。
1.8 数据处理
所有实验均重复3次,实验数据均用平均值±标准差表示。应用Excel 2013和Design-Expert 8.0.6进行数据分析,并使用Origin 2019作图。
2 结果与讨论
2.1 培养基优化
2.1.1 单因素实验
(1)培养基碳源的优化
以相同质量浓度的葡萄糖、麦芽糖、乳糖、糊精、蔗糖、淀粉替换基础培养基的甘油,诱导13 h后测定菌体浓度与酶活力,不同碳源对重组菌的生长与产酶情况如图1-a所示。以甘油作为碳源时,菌体的酶活力最大,达到(610.44±4.16) U/L。虽然葡萄糖是常见的速效碳源,适合菌体的生长,但总产酶水平与单位菌体产酶水平均比甘油效果差,这可能是由于葡萄糖会降低含有Lac启动子重组菌胞内的cAMP水平,对诱导物的利用有抑制作用,进而会降低其产酶水平[20]。并且,考虑到葡萄糖的快速利用容易产生大量乙酸,抑制菌体生长与产物的形成[21],因此选择甘油作为最适碳源。碳源浓度对酶活力的影响如图1-b所示,随着碳源浓度的增加,菌体的产酶水平呈现出先增加后降低的趋势,当甘油添加量达到10 g/L时,菌体的产酶水平最高,达到(592.11±12.98)U/L,因此选择10 g/L的甘油作为碳源。

a-碳源种类;b-甘油添加量图1 碳源对发酵的影响Fig.1 Influence of carbon source on fermentation
(2)培养基氮源的优化
以相同质量浓度的酵母粉、牛肉膏、玉米浆粉、蛋白胨以及硫酸铵代替培养基中的复合氮源,诱导13 h后测定菌体浓度与酶活力。结果如图2-a所示,相对于单一的氮源成分,复合氮源下的菌体浓度与产酶水平均达到最高,酶活力达到(779.60±18.94) U/L。以无机氮源作氮源时,菌体浓度与产酶水平均为最低,说明无机氮源并不适合菌体的生长与产酶。酵母粉与蛋白胨的复合不仅能够提供氮源,并且可以提供维生素、矿物质与氨基酸等。同时,酵母粉可以促进重组大肠杆菌将重组酶释放到周质空间[22]。因此,选择酵母粉与蛋白胨组成的复合氮源作为最佳氮源。酵母粉与蛋白胨的浓度优化结果如图2-b和图2-c所示,最佳的酵母粉与蛋白胨质量浓度分别为20、15 g/L,其对应的产酶水平分别为(812.05±3.75)、(881.28±1.65) U/L。

a-氮源种类;b-酵母粉浓度;c-蛋白胨浓度;d-磷酸盐浓度图2 氮源与磷酸盐对发酵的影响Fig.2 Effects of nitrogen source and phosphate on fermentation
(3)培养基磷酸盐浓度的优化
摇瓶发酵诱导13 h后测定菌体浓度与酶活力,探究磷酸盐浓度对菌体产酶的影响。结果如图2-d所示,磷酸盐浓度从0~180 mmol/L增加的过程中,对菌体浓度的影响并不大,酶活力出现了先降低后增加再降低的趋势。不加磷酸盐时,发酵过程中pH与对照组相比无明显差异,并且此时的酶活力最高可达到(850.46±21.99) U/L。类似现象在其他酶的发酵优化过程中也有报道,这可能是高浓度磷酸盐对某些酶的生产有抑制作用[20]。同时,考虑到不添加磷酸盐可降低废水的污染,所以培养基中选择去除磷酸盐。
(4)培养基无机盐的优化
无机盐的主要作用是构成菌体组织成分,参与调节细胞的渗透压并维持某些酶的活性[23]。在培养基中添加NaCl、MgSO4·7H2O、CaCl2、KCl,添加量为1.0 g/L,诱导13 h后测定菌体浓度与酶活力,探究无机盐对菌体产酶的影响。结果如图3-a所示,添加MgSO4·7H2O有利于菌体的产酶,酶活力达到(985.67±16.26)U/L。对MgSO4·7H2O的浓度优化,如图3-b所示,其浓度达到1.0 g/L时产酶最高,达到(1 101.69±38.53)U/L,所以培养基最终选择添加1.0 g/L的MgSO4·7H2O。

a-无机盐种类;b-MgSO4·7H2O浓度;c-金属离子种类;d-ZnSO4·7H2O浓度图3 无机盐与金属离子对发酵的影响Fig.3 Effects of inorganic salts and metal ions on fermentation
(5)培养基金属离子的优化
在培养基中添加0.1 g/L的ZnSO4·7H2O、CuSO4·5H2促进卤醇脱卤酶表达相符。对ZnSO4·7H2O浓度优化如图3-d所示,当质量浓度达到0.1 g/L时,其酶活力最高可达到(1 085.13±9.00) U/L;当其质量浓度大于0.1 g/L时,菌体浓度与酶活力均有明显下降,所以最佳质量浓度设置为0.1 g/L。
2.1.2 PB实验
PB实验的实验设计与结果如表3所示,显著性分析结果如表4所示,模型显著(P<0.05),筛选出对发酵产酶有显著影响的因素依次为酵母粉浓度(B)、蛋白胨浓度(C)、MgSO4·7H2O浓度(D)。

表3 PB实验结果Table 3 PB test results
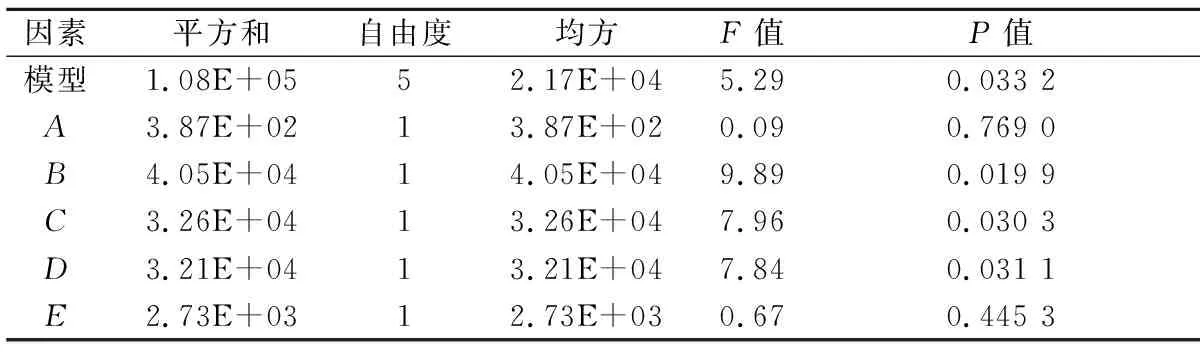
表4 PB实验方差分析Table 4 PB analysis of variance
2.1.3 Box-Behnken实验
Box-Behnken的实验结果及预测值如表5所示,显著性分析如表6所示。此模型达到极显著水平(P<0.01),失拟值不显著(P>0.05),说明模型拟合度较高。对表5的数据进行回归拟合可得方程为:Y=1 151.71+62.36X1-16.58X2+19.96X3-95.78X1X2+16.79X1X3+30.78X2X3-151.21X1X1-67.52X2X2-15.70X3X3。该方程的相关系数R2为0.996 0,可用于此菌株发酵产酶的培养基优化分析及预测。

表5 Box-Behnken实验结果Table 5 Box-Behnken experimental results
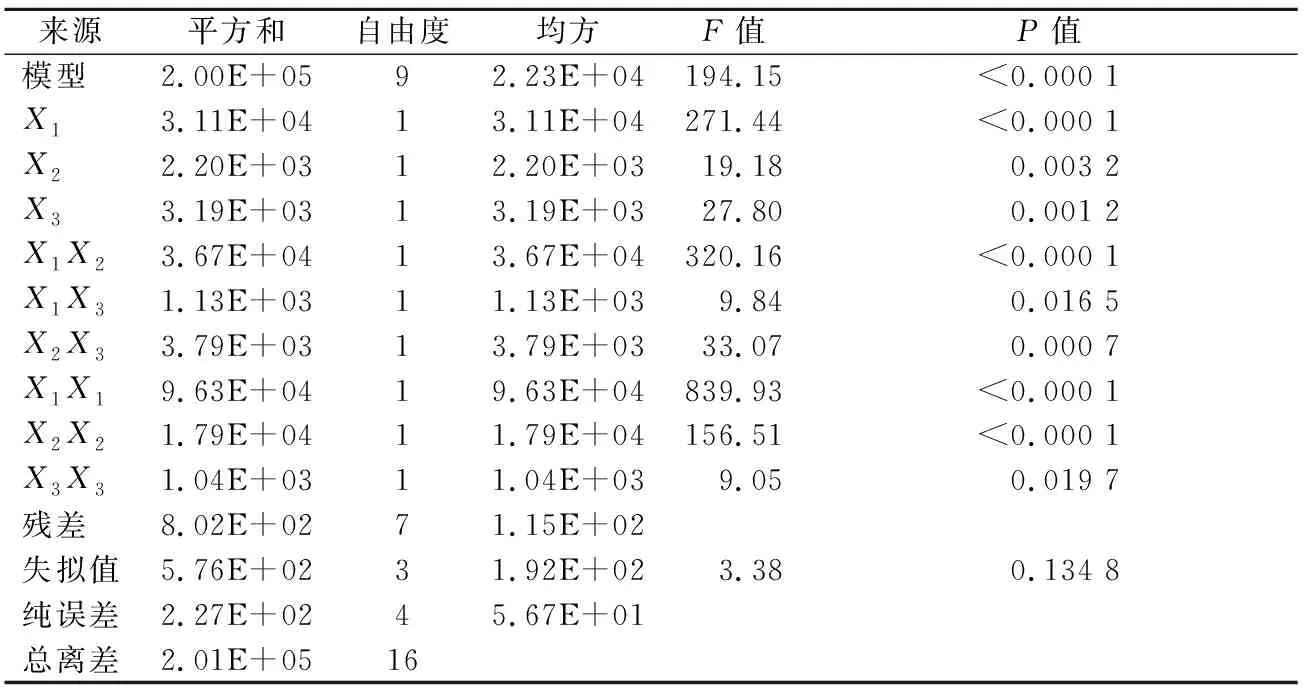
表6 Box-Behnken实验方差分析Table 6 Box-Behnken experimental variance analysis
对响应面的回归方程、三维响应面图以及等高线图分析后得到的最佳配比为酵母粉23 g/L、蛋白胨14 g/L、MgSO4·7H2O 1.3 g/L,酶活力的预测值为1 169.22 U/L。为验证模型预测的结果,进行了3组平行的实验,酶活力为(1 182.94±10.86)U/L,实验结果与模型预测的结果基本符合,比优化前(610.44±4.16)U/L提高了93.78%,脱卤酶的发酵水平显著提高。
2.2 摇瓶发酵条件优化
(1)添加诱导剂的时间
异源蛋白表达的启动会对宿主细胞正常代谢带来负担,对菌体浓度、蛋白表达和质粒稳定性都会产生负面影响,过早的诱导不利于菌体的生长,菌体浓度太低,没有足够量的菌体来进行蛋白的表达;添加诱导剂时间太晚时,菌体积累的代谢产物较多,菌体趋于老化,其产酶能力减弱,蛋白质的表达通常要使菌体处于一定的生长水平[25]。以优化完的发酵培养基进行发酵条件优化,分别在OD600达到0.6、1.2、1.8、2.6、3.4、4.4、5.6时添加诱导剂,25 ℃诱导13 h后测定菌体浓度与酶活力,如图4-a所示,当OD600达到1.8时(对数前期)添加诱导剂酶活力最大,达到(1 525.56±10.86)U/L,所以选择在对数前期进行诱导。
(2)接种量
接种量对于发酵周期与产物合成有着直接影响,合适的接种量缩短延迟期,减少杂菌污染的机会,接种量大时,菌体繁殖快,容易造成溶氧不足,持续生长时间短,自溶也较快,不利于目的蛋白的积累[26]。如图4-b所示,当接种量为5%时,酶活力达到最大(1 873.22±94.16)U/L,因此,选择5%为最佳接种量。
(3)诱导温度
诱导温度是影响异源蛋白表达的关键参数之一。低温诱导通常可以减少蛋白质的错误折叠,但同样会降低菌体的代谢活动,延长发酵周期,高温诱导虽然可以加快代谢活动,缩短发酵周期,但同时会由于蛋白质折叠太快出现错误折叠,并产生大量的不溶性蛋白(包涵体)[25]。如图4-c与图4-d所示,20 ℃诱导22 h的酶活力最大,达到(2 798.22±17.45)U/L。30 ℃诱导的菌体浓度与酶活力均受到抑制,其他重组蛋白的发酵过程中也观察到类似的现象[27],可能是由于高温诱导产生的包涵体对菌体生长和目的蛋白的可溶性表达均有抑制作用。而低于20 ℃的诱导温度在发酵周期和温度控制方面均不适合实际生产,所以选择20 ℃诱导22 h作为最佳条件。

a-诱导时机;b-接种量;c-不同诱导温度下的菌体生长状况;d-不同诱导温度下的菌体产酶状况图4 诱导时机、接种量及诱导温度对发酵的影响Fig.4 Effects of induction time, inoculation amount and induction temperature on fermentation
(4)诱导剂浓度
IPTG可作为基于T7启动子表达载体的诱导剂[28],如图5-a所示。在低浓度时,酶活力随着IPTG浓度的增加而增加,浓度增加至0.4 mmol/L时,其产酶能力达到阈值,此时的酶活力达(3 372.89±17.03)U/L,由于高浓度的IPTG对菌体有一定的毒性,继续增加IPTG浓度对菌体浓度与酶活力均有一定抑制作用。因此,以0.4 mmol/L的诱导剂作为最佳诱导浓度。
(5)装液量
摇瓶发酵过程中的装液量通过影响发酵液与空气的接触面积来影响发酵过程中的溶氧水平,对菌体的生长与蛋白的表达有着重要影响[29]。如图5-b所示,摇瓶的溶氧水平随着装液量的增加而减少,装液量达到40 mL/250 mL时达到最大酶活(3 585.83±15.02)U/L,继续增加装液量则由于供氧不足对菌体生长与蛋白表达均产生了负面影响,所以最终选择40 mL/250 mL作为最佳装液量。
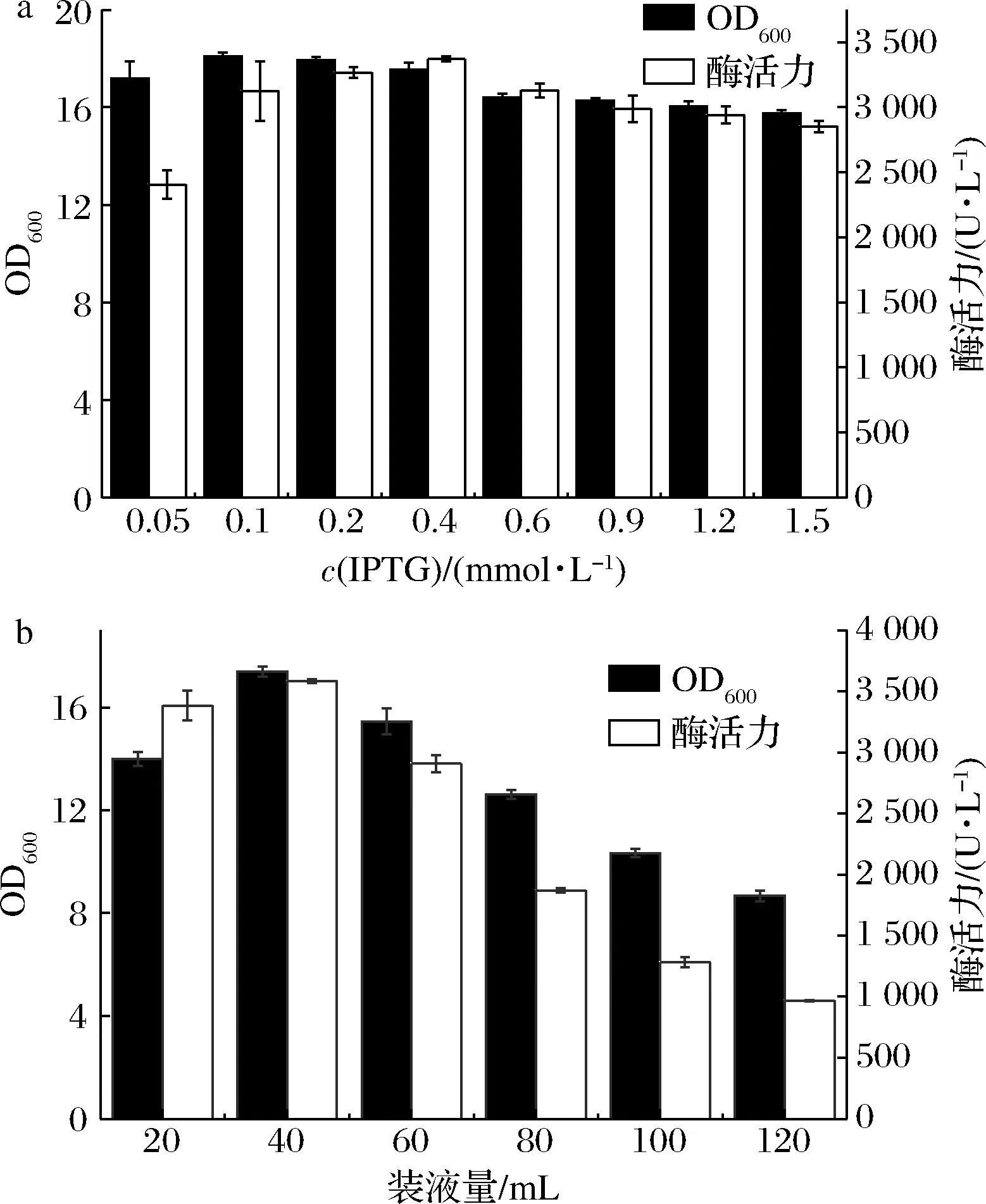
a-IPTG浓度;b-装液量图5 诱导剂浓度及装液量对发酵的影响Fig.5 Effect of inducer concentration and liquid loading amount on fermentation
2.3 5 L发酵罐放大实验
分批发酵结果如图6-a所示,37 ℃培养4 h后,开始降温至20 ℃并加入0.4 mmol/L的IPTG进行诱导,酶活力随着菌体浓度的增加而增加,产物的生成与菌体浓度呈正相关。在发酵20 h时菌体浓度与酶活力达到最高,其中酶活力达到(4 496.60±141.22)U/L。图7-a为分批发酵时的破碎上清液的蛋白电泳图,将菌体浓度稀释到同一水平进行细胞破碎。上样量一致情况下,可以明显看出随着诱导时间的增加,单位菌体的目的蛋白含量明显增加。达到一定阈值后,总的目的蛋白含量随着菌体浓度增加持续增加。
在分批发酵的过程中,发酵到14 h溶氧开始反弹,这可能是碳源缺乏造成。通过恒速流加一定量的甘油为发酵过程提供充足的碳源,如图6-b所示,发酵到46 h的酶活力最高可达到(9 682.62±191.16)U/L。图7-b为流加甘油发酵时细胞破碎上清液的蛋白电泳图,与未流加甘油时进行同样的处理,可以看出随着发酵的进行,单位菌体的目的蛋白含量在增加,并且达到一定的阈值,菌体浓度提升的过程中,总蛋白产量也在增加。

a-恒定pH;b-恒定溶氧图6 发酵罐中控制恒定pH与溶氧对发酵的影响Fig.6 Influence of constant pH and dissolved oxygen on fermentation in fermentation tank

a-分批发酵时的破碎上清液;b-流加甘油发酵时细胞破碎上清液图7 发酵罐的蛋白电泳图Fig.7 Protein electrophoresis of fermentation tank
3 结论
在微生物发酵过程中,培养基的成分与工艺对于发酵生产水平有着重要的影响。本研究首先在摇瓶的水平上对培养基的碳源、氮源、无机盐与金属离子进行了单因素优化,再通过PB实验与Box-Behnken实验对其中的显著因素进行响应面优化实验,获得最佳的培养基优化方案。结果表明最佳的培养基配方为甘油10 g/L,酵母粉23 g/L,蛋白胨14 g/L,MgSO4·7H2O 1.3 g/L,ZnSO4·7H2O 0.1 g/L,优化后培养基的酶活力是基础培养基的1.94倍。优化的最佳发酵条件为OD600达到1.8时添加诱导剂,接种量5%,诱导温度20 ℃,诱导时间22 h,IPTG浓度0.4 mmol/L,装液量40 mL/250 mL。经过发酵条件的优化,酶活力再次提高了3.03倍。
用5 L发酵罐对摇瓶的工艺进行放大时,由于可以维持恒定的pH与溶氧,菌体浓度与酶活力有了进一步的提升。当发酵到14 h时,由于碳源的缺乏,溶氧出现了反弹现象。恒速流加甘油后,溶氧一直维持在30%,菌体浓度与酶活力较分批发酵均提高了1倍以上,最终的酶活力为摇瓶的2.7倍。通过一系列的条件优化,卤代烷脱卤酶的发酵生产水平有了显著提高。目前在发酵罐进行的只是初步放大验证,后续可以在发酵罐上对工艺进行优化与放大,对补料策略、诱导策略等进行探索以获得更高的产量,为实现卤代烷烃脱卤酶(DhaA)的工业化生产奠定基础。
