磷酸甜菜碱对产黑色素短梗霉发酵产聚苹果酸的影响
2022-07-25杨东霖李佳谦鲁亮王舸楠王纪赵廷彬殷海松乔长晟
杨东霖,李佳谦,鲁亮,王舸楠,王纪,赵廷彬,殷海松,乔长晟,,4,5*
1(天津科技大学 生物工程学院,天津,300457)2(天津慧智百川生物工程有限公司,天津,300457)3(天津现代职业技术学院 生物工程学院,天津,300457)4(工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津,300457)5(天津市微生物代谢与发酵过程控制技术工程中心,天津,300457)
聚苹果酸(polymaleic acid,PMLA)是一种以苹果酸为唯一单体的高分子聚合物,主要有α、β、γ三种构型,微生物体内只合成β-PMLA这一种构型[1]。β构型的PMLA主链上含有大量的酯键[2],在水中可自发降解或经催化后降解,使其有可取代塑料的可能性[3-4],具有广泛的经济效益与环境价值。并因其具有较多游离的羧基,故可直接接入或经化学修饰后连接化合物基团、特异性蛋白、靶向分子或特定药物等多种功能性生物活性分子[5],形成许多具有特殊功能的衍生物[6],其可作为药物载体材料与生物材料[7],具有非常可观的发展前景与应用范围。
目前多采用出芽短梗霉(Aureobasidiumpullulans)作为生产菌株进行发酵[8-9],对于产黑色素短梗霉(Aureobasidiummelanogenum)发酵PMLA的研究较少。由微生物发酵法生产的PMLA产量低,仍未达到理想的工业化水平,且生产过程较为复杂[10],使用的发酵原料多为有机氮源或硝酸盐类物质[11],成本较高或在放大工业化生产时有安全风险。甜菜碱作为一种发酵助剂在工业微生物发酵领域已有较多的应用,其可参与甲基代谢反应,也可被分解为其他营养物质参与到细胞代谢中[12-13];XU等[14]发现外源添加甜菜碱可有效提高赖氨酸合成过程中的关键酶活力;LI等[15]在生产维生素B12的过程中发现,甜菜碱可极大刺激维生素B12的合成,并在120 L发酵罐中进行了验证。ZOU等[16]在使用乳杆菌发酵乳酸时发现,利用甜菜碱可替代原培养基中的吐温80,乳酸产量大幅提高,产率可达到95.5%,且乳酸脱氢酶的活性得到提升。磷酸甜菜碱是甜菜碱的磷酸盐,目前还未见应用在PMLA发酵领域,其价格便宜且添加量也较低,可以极大降低生产成本。本研究从添加量与发酵工艺条件出发,验证磷酸甜菜碱对PMLA发酵是否有促进作用,并通过转录组学分析代谢过程中的关键酶活力变化,探究甜菜碱在发酵中的作用机制,为PMLA的发酵提供可行的工艺方案。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
BCSW-001产黑色素短梗霉(Aureobasidiummelanogenum)CGMCC 18996,天津北洋百川生物技术有限公司。
1.1.2 仪器与设备
LC-20A高效液相色谱系统、Shim-pack GIST C18液相色谱柱(250 mm×4.6 mm,5 μm),日本Shimadzu公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;GRJB-5D多联发酵控制系统,镇江格瑞生物工程有限公司;ZQZY-78BV振荡培养箱,上海知楚仪器有限公司;GZX-9030MBE鼓风干燥箱,上海博迅实业有限公司医疗设备厂;TGL-16G高速离心机,上海安亭科学仪器厂;DF-Ⅱ集热式磁力加热搅拌器,江苏金怡仪器科技有限公司;BS124S分析天平,北京赛多利斯仪器系统有限公司。
1.1.3 培养基
斜面培养基PDA(g/L):新鲜土豆200,葡萄糖20,琼脂粉20,自然pH,121 ℃灭菌20 min。
种子培养基(g/L):蔗糖60 (单独灭菌),酵母浸粉3,丁二酸2,(NH4)2SO41,K2CO30.4,KH2PO40.1,MgSO40.1,ZnSO40.05,玉米浆1 mL/L,溶剂为水,121 ℃灭菌20 min[17]。
基础发酵培养基(g/L):蔗糖200(单独灭菌),(NH4)2SO44,KH2PO40.1,MgSO40.3,K2SO40.5,MnSO40.05,CaCO325,溶剂为水,121 ℃灭菌20 min。
1.2 培养方法
1.2.1 斜面培养
将保存于4 ℃的菌体斜面取出置于25 ℃恒温箱中活化2 h,在无菌操作下用接种环转接到新鲜的PDA斜面上,放于25 ℃的恒温培养箱中,培养3~5 d。
1.2.2 摇床培养
在无菌环境下,用适量无菌生理盐水将活化好的斜面菌株的孢子洗下来形成孢子菌悬液,接种量为5%(体积分数)接入种子培养基中,培养条件为25 ℃、200 r/min,培养40 h后,将种子液接种到发酵培养基中,接种量为10%(体积分数,下同)。恒温摇床培养条件为25 ℃、200 r/min,发酵144 h。
1.2.3 5 L发酵罐培养
接种口在火焰保护下,按照10%的接种量,将300 mL混合均匀的种子液接种到5 L全自动控制发酵罐中,罐内初始装液量为3 L,转速400~500 r/min,通风量5~8 L/min,25 ℃恒温发酵144 h。
1.3 分析方法
1.3.1 菌体量测定方法
取10 mL发酵液于50 mL离心管中,滴加6 mol/L的稀盐酸,中和发酵液中剩余的CaCO3,直到不再有气泡产生为止,混合均匀后的液体5 000 r/min离心15 min,倒掉上清液。用10 mL生理盐水重悬菌体,5 000 r/min离心15 min,倒掉上清液,将离心管置于80 ℃烘箱中烘干至恒重,称量菌体干重(g/L)[18]。
1.3.2 残糖测定方法
采用生物传感仪直接测定法,取发酵液10 mL,15 000 r/min离心10 min。取1 mL上清液,然后用蒸馏水稀释100倍,用生物传感仪测定样品中葡萄糖的含量,记为G1。取上清液2 mL,向上清液中添加200 μL 6 mol/L的盐酸,65 ℃恒温水浴10 min,水冷至室温,将溶液定容到4 mL,混匀后从中吸取1 mL稀释50倍,为保证pH处于中性范围,可以用3 mol/L的NaOH溶液调节pH值(约35 μL),测得的葡萄糖含量标记为G2。发酵液中蔗糖的含量按公式(1)计算:
(1)
式中:S,发酵液中剩余的蔗糖含量,g/L;G1,酸水解前发酵上清液中葡萄糖的含量,g/L;G2,酸水解后发酵上清液中葡萄糖的含量,g/L。
1.3.3 PMLA测定方法
取5 mL发酵液于15 000 r/min离心10 min除去菌体,用移液管取2 mL上清液于水解反应釜中,同时加入等体积的2 mol/L H2SO4溶液,110 ℃水解11 h,将PMLA完全水解为单体苹果酸。HPLC检测水解前后的苹果酸的含量,两者之差即为PMLA产量。
HPLC的检测条件:色谱柱Shim-pack GIST C18(250 mm×4.6 mm);柱温30 ℃;流动相V(25 mmol/L KH2PO4溶液)∶V(乙腈)=95∶5(用6 mol/L的磷酸调节pH至2.5);进样量5 μL;流速1.0 mL/min;紫外检测波长210 nm[19]。
1.4 转录组学实验方法
1.4.1 RNA提取及样本检测
在摇床上从500 mL摇瓶(装液量100 mL)中取发酵液于5 mL离心管中,5 000 r/min离心30 s,去除未被利用的CaCO3;将上清液转移至新的离心管中,10 000 r/min离心2 min,收集菌体;菌体沉淀用PBS重悬,10 000 r/min离心2 min,重复上述操作2次。将菌体进行液氮研磨后,使用Trizol试剂盒从产黑色素短梗霉细胞中提取总RNA。分析RNA的纯度和完整性,再用Nanodrop检测RNA的纯度(以OD260/OD280表示),然后用Qubit 2.0对RNA浓度进行精确定量,最后用Agilent 2100精确检测RNA的完整性[20]。
1.4.2 文库的构建与检测
RNA样品检测合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA。随后加入裂解液将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物合成一链cDNA,然后加入缓冲液、dNTPs和DNA polymerase I和RNase H合成二链cDNA,随后利用AMPure XP beads纯化双链cDNA。纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择。最后进行PCR扩增,并用AMPure XP beads纯化PCR产物,得到最终的文库。文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库,随后使用Agilent 2100对文库的插入片段大小进行检测,插入片段符合预期后,使用Q-PCR方法对文库的有效浓度进行准确定量,以保证文库质量。
1.4.3 数据统计分析
对于原始测序数据(raw data)的末端数据进行裁剪和质量控制,得到clean reads。根据Trinity-2.11.0指南,首先使用RSEM软件将clean reads比对到实验室先前组装的参考转录本上,使用DESeq2软件对比对结果产生的Raw counts进行差异统计分析,筛选获得不同样本之间的差异表达基因。并将注释差异表达基因的GO号进行富集,从而得到GO数据库中分子功能(Gene Ontology)、生物过程和细胞组分的富集结果。根据比对结果进一步分析基因产物的功能及在细胞中的代谢途径。
1.5 数据处理
所有实验数据取3次的平均值,并用Origin 9.0进行数据处理并作图。
2 结果与讨论
2.1 磷酸甜菜碱添加浓度对菌体量与PMLA产量的影响
按1.2.2的方法进行摇床实验,向基础发酵培养基加入磷酸甜菜碱,添加质量浓度设置为0.1~1.7 g/L,递增质量浓度为0.2 g/L,空白组为基础发酵培养基,不添加磷酸甜菜碱。如图1-a所示,随着磷酸甜菜碱的加入,菌体量不断增加,当添加量为1.3 g/L时,菌体量达到最大25.0 g/L,空白组菌体量为7.75 g/L。磷酸甜菜碱添加浓度继续增大,菌体量出现下降,菌体生长受到抑制。如图1-b所示PMLA产量随着磷酸甜菜碱添加量的提高基本呈上升趋势,当添加量为0.9 g/L时,PMLA产量达到最大47.9 g/L,空白组产量为10.37 g/L。但当磷酸甜菜碱继续增加时,产量开始下降,说明磷酸甜菜碱添加过多时,菌体可能主要将能量用于生长作用,而没有用于产酸。由图1-c可知,当磷酸甜菜碱添加量为0.9 g/L时,菌体的单位产酸率最高,且此时产量最高,故选择此添加量进行后续研究。

a-菌体量;b-PMLA产量;c-单位菌体产酸率图1 磷酸甜菜碱添加浓度对菌体量、PMLA产量和单位菌体产酸率的影响Fig.1 Effect of betaine phosphate concentration on biomass,PMLA and yield
2.2 5 L发酵罐工艺条件优化
2.2.1 不同通风量对于菌体发酵的影响
PMLA的发酵为好氧发酵过程,不同的溶氧条件会导致菌株的代谢产物不同[21]。为探究在添加磷酸甜菜碱后PMLA发酵的最适溶氧条件,以基础发酵培养基为空白组,添加0.9 g/L磷酸甜菜碱为实验组进行实验。首先探究通风对于发酵的影响,固定转速400 r/min,调整通风量为5、6.5、8 L/min,按1.2.3的方法进行5 L发酵罐实验。结果如图2所示,前40 h实验组菌体积累较少,40~60 h菌体进入对数生长期,生长较快,中后期菌体生长较慢,5 L/min的条件下实验组菌体生长的速度最快,实验组菌体量最后可达到39.5 g/L。空白组菌体生长均较为缓慢,在144 h时5 L/min条件下菌体量积累最多,为15.7 g/L。

图2 不同通风量对菌体量的影响Fig.2 Effect of different ventilation rates on biomass
通风量对产量的影响结果如图3所示,前40 h实验组PMLA产量较低,40 h后随着菌体量的增加,产量增长较快。80 h后通风条件为5 L/min与6.5 L/min的实验组产量增长开始减慢,8 L/min的实验组产量积累一直较快,发酵到144 h可达到45.62 g/L。前24 h,3个通风条件下空白组都没有PMLA的积累,可能与前期空白组的菌体量过低有关,36 h后空白组的PMLA开始合成,但合成量均较少,发酵到144 h时,8 L/min通风条件下的空白组产量最高,为16.43 g/L。

图3 不同通风量对PMLA产量的影响Fig.3 Effect of different ventilation rates on PMLA yield
实验发现每个时间点相同通风与转速条件下实验组的菌体量与产量均高于空白组,说明磷酸甜菜碱的加入有利于菌体的生长,可提高PMLA的产量。3个通风条件对比发现8 L/min通风条件下,PMLA产量最高,5 L/min与6.5 L/min PMLA可能无法满足菌体的耗氧需求,部分菌体转为无氧呼吸,而消耗同样浓度的碳源,无氧呼吸提供的能量较少,为了维持生长提供足够的能量与ATP,导致耗糖加快,副产物较多。虽然实验组均未出现拐点,但通风量8 L/min已经较大,继续增大通风量放大生产时对于工艺设备要求较高,所以确定8 L/min为最适通风量。发酵144 h时,不同通风条件下,空白组与实验组的菌体量与产量如表1所示。

表1 不同通风量对PMLA发酵的影响Table 1 Effects of different ventilation on PMLA fermentation
2.2.2 不同转速对于菌体发酵的影响
由2.2.1确定8 L/min的通风条件,以基础发酵培养基为空白组,基础发酵培养基添加0.9 g/L磷酸甜菜碱为实验组进行实验。设置转速为400、450、500 r/min。如图4所示,在400、450 r/min条件下,实验组菌体前期生长较慢,40 h后进入对数生长期,菌体量积累较快。在转速为500 r/min时,实验组菌体生长非常活跃,延滞期较短,发酵液在72 h后开始发黑,可能是某些副产物代谢途径加强。实验组在500 L/min条件下菌体量最高,发酵144 h可达到43.50 g/L。3个转速条件下,空白组的菌体活力均比实验组低,生长较慢,空白组在500 r/min的转速条件下菌体量最高,144 h为16.8 g/L。

图4 不同转速对菌体量的影响Fig.4 Effect of different rotating speeds on biomass
如图5所示 40 h实验组与空白组产量均较低,可能由于此时菌体量少,导致PMLA积累较少,40 h以后实验组菌体生长进入对数生长期,产量增长较快,96 h以后500 r/min的实验组产量增长较慢,而400、450 r/min的实验组产量仍在继续增加,转速为450 r/min的实验组发酵144 h最后达到53.10 g/L。40 h左右空白组开始有PMLA生成,但合成量较少,3个转速条件中,450 r/min的空白组最终产量最高,产量为17.29 g/L。相同通风转速条件下,每个时间点空白组的菌体量与产量均低于实验组,说明磷酸甜菜碱的加入提高了菌体活力,可以促进PMLA合成,提高了蔗糖利用率。3个转速条件比较发现,实验组在450 r/min产量最高,故确定最适的发酵条件为转速450 r/min,通风量8 L/min。发酵144 h时,不同转速条件下,空白组与实验组的菌体量与产量如表2所示。
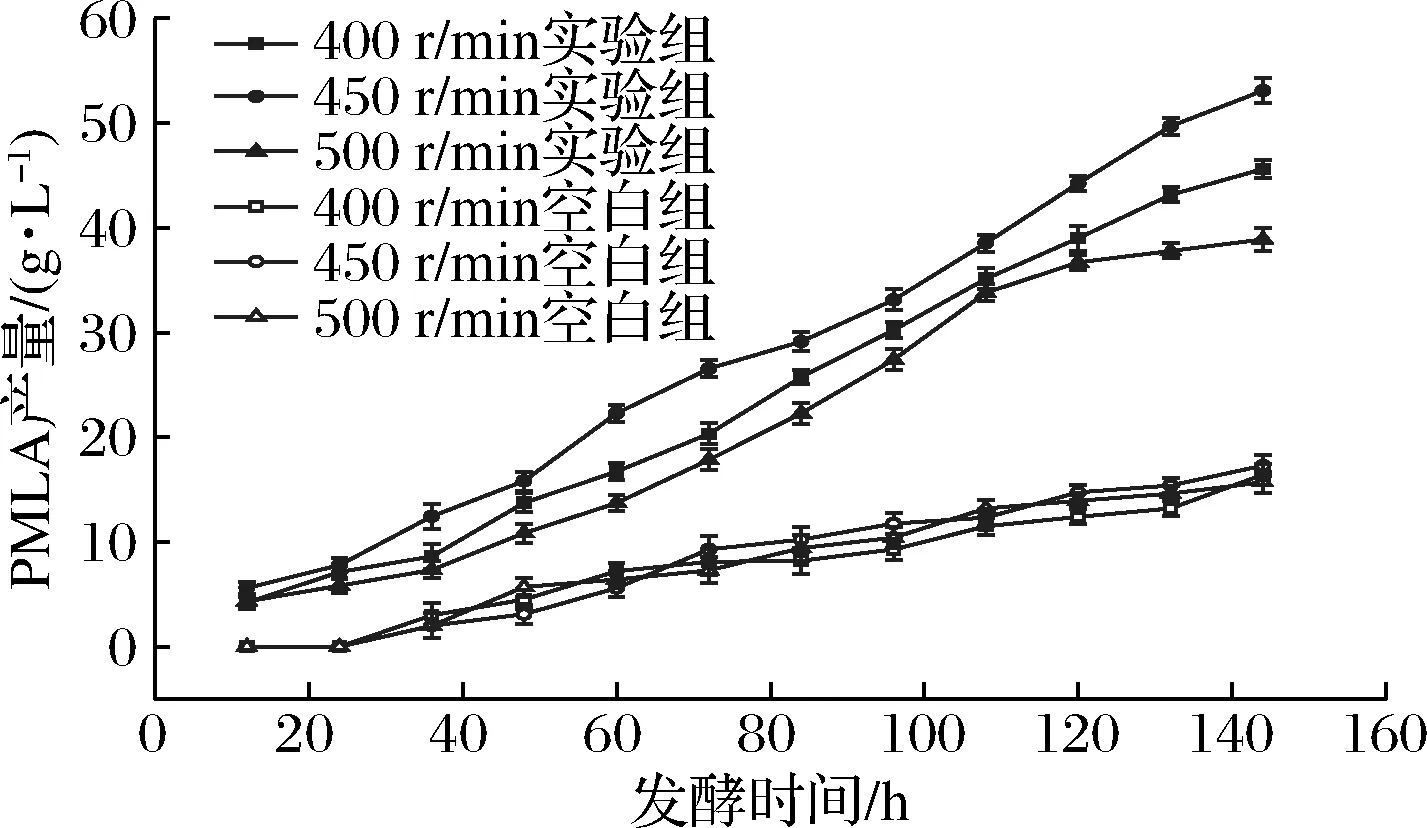
图5 不同转速对PMLA产量的影响Fig.5 Effect of different rotating speeds on PMLA

表2 不同转速对PMLA发酵的影响Table 2 Effects of different rotating speeds on PMLA fermentation
2.3 转录组分析
2.3.1 差异表达基因筛选
60 h菌体处于对数生长期阶段,菌体生长较为活跃,代谢旺盛,故选择在60 h时,在摇床实验条件下对空白组与实验组取样测序,空白组为基础发酵培养基,实验组为基础发酵培养基添加0.9 g/L磷酸甜菜碱,测序结果已上传到NCBI,将得到的原始数据经过处理后进行主成分分析(principal component analysis,PCA),对两组的组间样品与组内样品进行稳定性和差异性分析,如图6-a所示PCA评分为69.6%,处在50%~100%,证明模型拟合较好且可靠性较高。每组3个样本聚集比较紧密,证明组内样本的重复性较好,各组间样本分散较远,证明磷酸甜菜碱的加入确实使菌体在60 h基因的表达量出现差异。
经过数据质控与参考基因组比对并经过DEseq2差异表达分析后可得出有1 984个基因表达有差异(图6-c),其中221个基因表达量显著提高,46个基因表达量显著下降(图6-b)。

a-实验组与空白组的PCA得分图;b-基因表达差异量火山图;c-基因表达差异量热图图6 空白组与实验组差异表达基因分析图Fig.6 Analysis of differentially expressed genes between control and experimental group
2.3.2 GO富集分析
将获得的221个表达量较高的基因通过与GO数据库进行比对并进行GO富集分析,GO数据库主要将基因本体分为3类:生物过程、细胞组成组分、分子功能。如图7所示,其中富集到生物过程条目中的差异表达量较高的基因主要参与ATP能量代谢、丙酮酸代谢与糖酵解过程,富集到细胞组成组分中的差异表达量较高的基因主要与蛋白质DNA复合物的组成、胞质小核糖体亚基的组成有关,富集到分子功能中的基因主要与有机阴离子跨膜转运蛋白活性、与羧酸跨膜转运蛋白活性有关。富集结果表明磷酸甜菜碱的加入提高了菌体的能量代谢能力与有机酸转运能力,对于PMLA的合成有影响。

图7 表达量较高的基因GO富集分析图Fig.7 GO annotation of genes with high expression
2.3.3 代谢通路分析
如图8所示,将差异表达基因与KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库比对后可解析到差异表达基因在代谢通路上的影响,同时结合GO富集结果,可得到磷酸甜菜碱对于菌株在主要代谢通路上的影响。细胞外的葡萄糖无法被细胞直接吸收利用,因为葡萄糖无法自由通过细胞膜上的磷脂双分子层,需要借助细胞膜上己糖转运蛋白(hexose transporter,KHT2),GO富集分析发现该蛋白的基因表达量调高,说明相比于空白组,实验组菌体对葡萄糖的吸收能力增强,葡萄糖能更多且更迅速的进入细胞。分析发现糖酵解过程中的己糖激酶(hexokinase,HXK)、6-磷酸果糖激酶(ATP-dependent 6-phosphofructokinase,PFKA)、果糖二磷酸醛缩酶(fructose-biphosphate aldolase,ALF)、磷酸丙糖异构酶(triosephosphate isomerase,TPIS)、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,G3P)、磷酸甘油酸激酶(phosphoglyceric kinase,PGK)、烯醇化酶(enolase,ENO)等酶的基因表达量提高,可以推测出糖酵解路径中的相关酶的活性增强,细胞的能量代谢得到加强,生成的ATP与能量较空白组更多,所以菌体的生长情况更好。实验组的磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PCKA)与天冬氨酸转氨酶(aspartate aminotransferase,AATM)的基因表达量提升较高,磷酸烯醇式丙酮酸羧激酶可将磷酸烯醇式丙酮酸催化为草酰乙酸并同时吸收来自空气中或呼吸作用产生的CO2[22],天冬氨酸转氨酶将草酰乙酸催化生成天冬氨酸,天冬氨酸转运出线粒体外后再被还原为草酰乙酸,由两者催化生成的草酰乙酸可被细胞质中的苹果酸脱氢酶还原成苹果酸,随后与来自线粒体的少量苹果酸进一步由非核糖体肽合成酶(non-ribosomal peptide synthetase,NRPS)蛋白催化生成PMLA[23-24],GO富集结果发现有机酸跨膜转运蛋白与羧酸跨膜转运蛋白活性提高,说明相对于空白组,实验组细胞内的PMLA可以被更快的运出胞外,减小胞内的浓度抑制,更有利于PMLA的合成。

图8 磷酸甜菜碱对产黑色短梗霉基因表达量的影响Fig.8 Effect of betaine phosphate on gene expression of A.melanogenum注:其中红色代表该基因表达量提高;基因表达量均做了归一化处理,Betaine,实验组;Control,空白组;基因缩写如下KHT2,己糖转运蛋白; HXK,己糖激酶; PFKA, 6-磷酸果糖激酶; ALF, 果糖二磷酸醛缩酶; TPIS, 磷酸丙糖异构酶; G3P, 3-磷酸甘油醛脱氢酶; PGK, 磷酸甘油酸激酶; ENO, 烯醇化酶;PCKA, 磷酸烯醇式丙酮酸羧激酶; AATM, 天冬氨酸转氨酶
3 结论
本研究发现磷酸甜菜碱的外源加入能够促进菌体生长,提高PMLA产量。通过单因素试验确定了磷酸甜菜碱的最适添加质量浓度为0.9 g/L,并通过5 L发酵罐实验优化最适工艺条件,确定了最适的通风量8 L/min与转速450 r/min。在最适条件下实验组发酵144 h产量为53.10 g/L,空白组产量为17.29 g/L,实验组菌体量与产量均高于空白组,结果表明磷酸甜菜碱的加入能够提高产黑色素短梗霉的菌体活力与产酸能力,加快菌体生长。通过转录组学分析发现磷酸甜菜碱使菌体对糖的吸收利用加强,并主要通过加强草酰乙酸的还原反应提高PMLA的产量。本研究提供了一种成本低且安全的工业生产方案,通过转录组学分析出关键节点的酶活力变化,为后续菌株改造提供参考。
