不耐受强化化疗的初治老年急性髓系白血病患者诱导治疗疗效及安全性
2022-07-25罗东凤游建华李啸扬李军民张赟翔
罗东凤, 游建华, 李啸扬, 李军民, 张赟翔
(1. 湖南省娄底市中心医院血液内科,湖南 娄底 417000;2. 上海交通大学医学院附属瑞金医院血液科 上海血液学研究所,上海 200025)
急 性 髓 系 白 血 病 (acute myeloid leukemia,AML)是老年患者中最常见的急性白血病,以骨髓及外周血中异常髓系原始细胞克隆性增殖为特征,主要临床表现为贫血、出血以及感染。 其发病率随年龄增长而增加[1]。 老年患者因体能状态差、合并症复杂、遗传学高危因素多,对传统化疗耐受差。 目前,国内外指南等均推荐采用老年综合评估(comprehensive geriatric assessment,CGA)评价老年AML 患者对传统化疗的耐受性, 并筛选不耐受强化化疗的患者[2-4]。 对于不耐受强化化疗的患者,其长期生存率仅为10%或更低[5]。 因此,不耐受强化化疗的老年AML 患者急需有效且耐受良好的诱导治疗。
既往常用治疗方案包括低剂量阿糖胞苷、去甲基化药物(hypomethylation reagent,HMA)、预激化疗等。 随着B 细胞淋巴瘤2 (B cell lymphoma-2,BCL-2) 抑制剂获批上市,HMA 联合维奈克拉(venetoclax,VEN) 也开始应用于中国老年AML 患者的治疗。 但与既往传统治疗相比,其有效性及安全性仍缺乏研究。因此,本文通过回顾性分析,筛选上海交通大学医学院附属瑞金医院(瑞金医院)所有通过CGA 后确定为不耐受强化化疗的初治老年AML 患者,分析其临床及遗传学特征,总结不同诱导化疗方案的疗效及安全性,希望为不耐受强化化疗的AML 患者提供更多的临床治疗选择。
资料与方法
一、研究对象
回顾性分析瑞金医院2018 年6 月至2021 年5 月间诊断的年龄≥60 岁的初发AML 患者120 例,通过CGA 共筛选出不耐受强化化疗的患者52 例(43.3%)。 根据2016 年版WHO 造血和淋巴组织肿瘤分型诊断标准[6],所有患者经过骨髓形态学、免疫分型检查确诊为AML。 不耐受强化诱导化疗标准:①起病时年龄≥75 岁;②年龄60~74 岁,治疗开始前通过CGA 判定为不耐受强化化疗的患者。
二、CGA 评估
评估量表包括东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分、日常生活活动(activities of daily living,ADL)功能评定量表、Charlson 合并症指数 (Charlson comorbidity index,CCI)、 简易精神状态检查(mini-mental state examination,MMSE) 量 表 和 简 明 体 能 状 况(short physical performance battery,SPPB) 量表。 若患者ECOG 评分<3 分,CCI 评分≤1 分,ADL 评分=100 分,MMSE 评分≥24 分,SPPB 评分≥9 分, 评估为可耐受强化化疗。 其余患者均归为不耐受强化化疗。
三、诱导治疗方案
1. HMA+VEN:VEN 采用剂量爬坡给药。 第1 天给予100 mg,第2 天增量至200 mg,自第3 天起每天400 mg 直至第28 天。 HMA 选用阿扎胞苷75 mg/m2,第1~7 天,皮下注射;或采用地西他滨20 mg/m2,第1~5 天,静脉滴注。
2. 其他方案:包括以下5 种。①HMA 联合预激化疗: 采用D-HAG 方案。 具体用药: 地西他滨20 mg/m2,第1~5 天,静脉滴注;高三尖杉酯碱2 mg/m2,第6~10 天,静脉滴注;阿糖胞苷25 mg,q12h,第6~12 天,皮下注射;粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)300 μg,第6~12 天,皮下注射;若患者治疗期间白细胞计数大于20×109/L,则停止使用G-CSF,待其下降后根据病情使用。②减量IA 方案:伊达比星6 mg/m2,第1~3 天,静脉推注;阿糖胞苷100 mg/m2,第1~7 天,静脉滴注。③HMA 单药:地西他滨20 mg/m2,第1~5 天,静脉滴注;或阿扎胞苷75 mg/m2,第1~7 天,皮下注射。 ④小剂量阿糖胞苷: 阿糖胞苷25 mg,q12h,皮下注射,根据患者白细胞计数及病情调整治疗时间。⑤预激化疗:HCAG 方案(高三尖杉酯碱、阿柔比星、阿糖胞苷、G-CSF),剂量同既往研究[7]。
四、疗效评价及随访
患者诱导治疗后的疗效评价标准参考2017 年ELN(European LeukemiaNet)指南[8],疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)及未缓解(non-remission,NR)。 治疗期间的不良反应评估参考不良反应常见术语标准4.0 版 (Common Terminology Criteria Adverse 4.0,CTCAE 4.0)进行分级评价。 无事件生存(event free survival,EFS)期定义为诊断至2 次诱导治疗失败、任何原因引起的死亡或末次随访时间。 总生存(overall survival,OS) 期定义为诊断至死亡或末次随访时间。 以查阅门诊、住院病历及电话联系方式进行随访。 末次随访日期为2021 年9 月16 日。
五、统计学处理
采用SPSS 22.0 统计软件。 计量资料以中位数及范围表示[M(范围)],组间比较采用Mann-WhitneyU检验。计数资料以百分比或率表示,组间临床特征比较采用χ2或Fisher 精确检验。 Kaplan-Meier法描述生存状态分布,采用Log-rank 检验进行预后单因素分析。P<0.05 为差异有统计学意义。
结 果
一、患者一般情况及CGA 评估结果
全部120 例患者中,经过CGA,68 例患者确定为适合强化化疗,不耐受强化化疗的患者为52 例。其中,年龄≥75 岁的患者9 例;年龄60~74 岁,由CGA 评估为不耐受强化化疗的患者共43 例。2 组患者性别、初发骨髓原始细胞比例、白细胞计数及血红蛋白水平差异无统计学意义。适合强化化疗组患者中位年龄65(60~74)岁,显著低于不耐受强化化疗组的67.5(60~79)岁(P=0.001)。 同时,不耐受强化化疗组患者中位血小板计数仅34.5×109/L,低于适合强化化疗组的45×109/L(P=0.029)。 2 组患者ECOG 体能状态、ADL 功能评定量表、CCI 评估、MMSE 及SPPB 量表差异均有统计学意义(见表1)。

表1 患者基本资料[n(%)/M(范围)]
在不耐受强化化疗组中,仅14 例(26.9%)患者无特殊既往史及合并症;其余38 例(73.1%)患者均至少合并1 种疾病。 其中, 合并高血压16 例(30.8%),冠心病5 例(9.6%),恶性肿瘤病史5 例(9.6%)(甲状腺癌、胃癌、卵巢癌、前列腺癌、胆囊癌各1 例),心房颤动4 例(7.7%),胆囊炎/胆囊结石、糖尿病、肝硬化各3 例(5.8%),抑郁症、肺结核、慢性乙型病毒性肝炎各2 例(3.8%),心力衰竭、脑梗死、慢性胰腺炎各1 例(1.9%)。
二、不耐受强化化疗组患者的临床特征
52 例不耐受强化化疗的患者中, 共47 例(90.4%) 患者为新发AML,5 例(9.6%) 为继发性AML (3 例有既往血液疾病病史、2 例为治疗相关AML)。 共50 例(96.2%)患者完成了骨髓细胞遗传学及分子生物学评估。 染色体核型低危患者4 例(8.0%),中危25 例(50.0%),高危21 例(42.0%);核型中高危患者比例达92.0%。 高危核型中,复杂核型及单倍体核型共12 例(57.1%)。 共50 例患者采用二代测序方法检测AML 常见基因突变, 所有患者均检测出至少1 个驱动基因异常。 最常见的基因突变为核仁磷酸蛋白1 (nucleophosmin 1,NPM1)(19 例,占38.0%),DNA 甲基转移酶3A(DNA methyltransferase 3A,DNMT3A)(14 例,占28.0%),Fms-样酪氨酸激酶3-内部串联重复(Fms-related tyrosine kinase 3-internal tandem duplication,FLT3-ITD)(11 例,占22.0%),TET 癌基因家族成员2(teneleven translocation 2,TET2)(10 例, 占20.0%),Runt 相关的转录因子1 (Runt-related transcription factor 1,RUNX1)(9 例,占18.0%),N-Ras(8 例,占16.0%), 附加性梳样结构-1 (additional sex comblike 1,ASXL1)(6 例,占12.0%),异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH2)(6 例, 占12.0%),FLT3-酪氨酸激酶结构域(FLT3-tyrosine kinase domain,FLT3-TKD)(5 例,占10.0%),K-Ras(5 例,占10.0%)。 最常见的融合基因为KMT2A相关融合,共5 例(10.0%);其次为RUNX1-RUNX1T1融合,共4 例(8.0%)。 所有检出的基因突变情况见图1。根据2017 年ELN 标准,对患者进行细胞遗传学与分子生物学危险分层:低危组7 例(13.5%),中危组14 例(26.9%),高危组29 例(55.8%),中高危组共43 例(86.7%),2 例(3.8%)患者因未完成相关检查无法评估。

图1 患者基因突变及融合基因
三、 不耐受强化化疗组患者的诱导治疗反应率及安全性
共11 例(21.1%)患者因病情、合并症、个人原因等未接受化疗,仅采用支持治疗;共2 例(18.2%)患者在确诊60 d 内发生早期死亡。 其余41 例(78.9%)患者均接受诱导化疗,其中25 例患者采用了HMA+VEN 的治疗方案,占所有接受积极化疗患者的63.4%。 其他诱导治疗方案包括D-HAG 方案6 例,HMA 单药方案4 例,IA、HCAG 及小剂量阿糖胞苷方案各2 例。
诱导治疗2 个疗程后,CR 率最高的诱导治疗方案为HMA+VEN, 达到了64.0%; 而采用传统诱导化疗患者的总CR 率为31.3%,2 组间CR 率差异存在统计学意义 (P=0.04)。 在传统诱导化疗方案中,HMA+预激化疗及IA 方案的CR 率均为50.0%(见表2)。
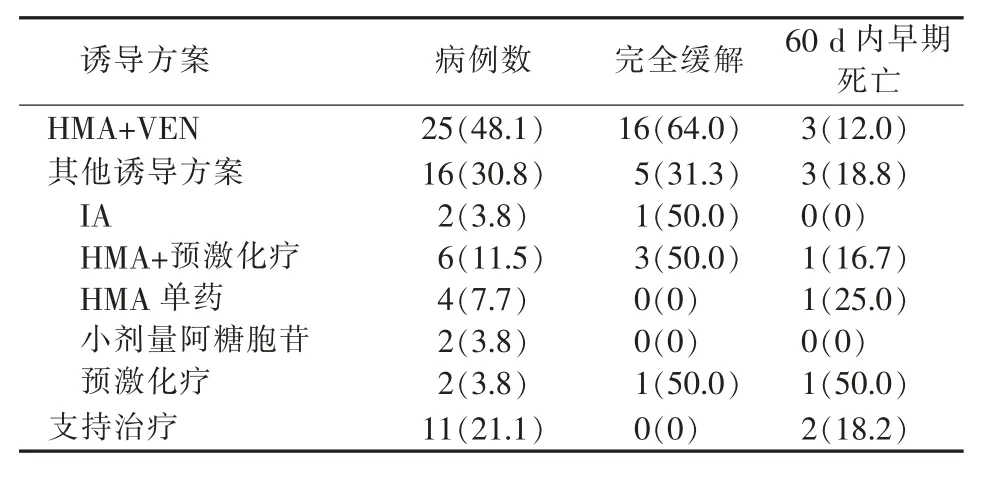
表2 诱导疗效及早期死亡率[n(%)]
采用HMA+VEN 方案治疗的25 例患者中,共16 例(64.0%)患者出现粒细胞缺乏伴发热,其中3 例患者提前停用VEN;2 例患者发生肿瘤溶解综合征,7 例患者出现3 级及以上呕吐;60 d 内早期死亡3 例(12%)。 采用其他诱导化疗的16 例患者中9 例(56.3%)发生粒细胞缺乏伴发热,1 例接受IA 方案诱导的患者提前1 d 结束既定化疗,其余患者均完成1 个疗程诱导;1 例患者出现3 级呕吐;60 d 内早期死亡3 例,占比为18.8%。2 组治疗方案比较, 患者的60 d 内早期死亡率差异无统计学意义(P=0.886)。
四、预后
强化化疗组患者的1 年OS 率为72.6%, 中位生存时间为686 d;而不耐受强化化疗组患者的1 年OS 率仅为44.2%,中位生存时间仅134 d;2 组间差异有统计学意义(P<0.001);同时,强化化疗组的中位EFS 时间为335 d,显著优于不耐受强化化疗组的101 d(P=0.001)。
采用HMA+VEN 方案治疗的患者1 年OS 率64.8%,中位生存时间434 d;采用其他化疗方案的患者OS 率为44.7%,中位生存时间为110 d。 而所有未治疗的患者均在1 年内死亡,3 组间差异有统计学意义(P=0.001)。 3 组间EFS 差异也有统计学意义(P=0.003)(见图2)。

图2 AML 患者生存分析
讨 论
AML 是常见的血液系统恶性肿瘤, 中位发病年龄68 岁[9]。 大部分老年患者因体能状态、合并症等原因,无法耐受强化化疗。 CGA 是对患者功能状态、合并症、年龄、认知等进行综合评估,国内外研究显示可对老年实体肿瘤或血液肿瘤患者予以CGA 进行预后判断及指导治疗[3,10]。CGA 自2015 年起在国内推广使用,国内其他中心数据显示,适合强化化疗的患者比例50.1%[2]。 本研究采用的评估量表较上述研究增加了MMSE 及SPPB 用于认知及体能状态评估,筛选出适合强化化疗的患者比例为43.3%。 上述结果提示,本研究所采用的评估体系可能更为严格,能更大程度上保证接受强化化疗患者的安全;同时,也可能造成部分患者被评为不耐受强化化疗而错失治疗机遇。 后续将扩大样本量,并继续完善CGA 评估体系,以更精准地为老年AML 患者制定诱导方案。
CGA 除了对于患者治疗方案选择有价值,在老年AML 患者的预后判断中也存在重要价值。 Giles等[11]的回顾性研究发现,合并症指数与患者治疗期间早期死亡相关;国内相关研究也发现,合并症指数评分高者治疗相关死亡率高[12]。 众所周知,老年AML 患者长期生存受多种因素影响。 本研究发现强化化疗组患者的OS 及EFS 均显著优于不耐受强化化疗组,这可能与患者ECOG 评分、功能状态、治疗方案强度、耐受性等多方面有关。 既往研究也有类似结论。 Klepin 等[13]研究发现,老年AML 患者广泛存在CGA 异常;SPPB 得分高者 (≥9 分)较得分低者 (<9 分) 预后好, 其中位OS 期分别为16.8 个月和6 个月(P=0.018);并且ECOG 及功能状态也与长期预后相关。 国内多中心研究显示,CGA 评分异常数目与患者的中位OS 相关 (P=0.050)[3]。
老年AML 除了患者本身的不良预后因素外,疾病相关高危因素发生率也更高。在完成预后评估的50 例不耐受强化化疗患者中, 细胞遗传学及分子生物学分层中高危组比例高达86%。 更重要的是,复杂核型患者共10 例,占比达20%;既往研究也发现,染色体复杂核型的发生率随着年龄升高而增加[14]。 除染色体高危核型比例高外,还发现本研究涉及的老年AML 患者NPM1基因突变比例达38%。但是,单纯NPM1突变且染色体正常核型,综合评估为低危组的患者仅3 例;剩余15 例患者中,合 并FLT3-ITD突 变 的 共5 例,NPM1、FLT3-ITD、DNMT3A三 基 因 突 变 2 例,NPM1、FLT3-ITD、ASXL1三基因突变3 例, 合并染色体高危核型的6例;国际上的其他研究中也同样发现,单纯NPM1突变的患者比例随发病年龄增加而降低[14-15];且老年患者中单纯NPM1突变与合并FLT3-ITD突变相比并未体现出显著的生存优势[16]。 上述结果均提示,无论是患者还是疾病,老年人群都更复杂,由此导致其治疗效果不佳。 临床中,需要通过更完善细致的评估来制定个体化方案。
迄今为止,多项研究均已经表明诱导化疗可为老年患者带来生存获益[17-18],并且缓解后进行同种异体造血干细胞移植,仍是诱导缓解后治愈非低危组AML 患者的唯一途径[19]。 采用减低剂量化疗方案,仅能在约30%患者中取得疗效[20]。 在本研究回顾的52 例不耐受强化化疗患者中,16 例接受了传统诱导化疗,化疗方案涵盖了目前国内绝大多数可用药物, 其中包括6 例D-HAG 及2 例减量IA 方案。 但是,16 例患者中仅5 例在诱导2 个疗程后获得CR,CR 率仅31.3%,与既往文献报道[10]相类似。而患者的60 d 内早期死亡率达到18.8%。 由此可见,传统诱导化疗在不耐受强化化疗的老年患者中疗效有限,亟需新的临床方案。
VEN 是第一个高度选择性的口服BCL-2 抑制剂, 已经在多种血液系统肿瘤中被证实有效[21]。VIALE-A[22]及VIALE-C 研究[23]显示,VEN 联合HMA或小剂量阿糖胞苷方案能显著提高不耐受强化化疗的老年AML 患者预后。 2018 年,VEN 被美国食品药品监督管理局批准用于AML 的治疗。 VIALEC 研究中国患者的疗效结果显示,小剂量阿糖胞苷联合VEN 治疗组与单药阿糖胞苷相比, 死亡风险下降了38%,患者中位生存期延长了5 个月[24]。
本研究中, 共有25 例患者采用HMA 联合VEN 作为初始诱导治疗方案,3 例选择了静脉滴注地西他滨,22 例患者采用皮下注射阿扎胞苷。 经过2 个疗程诱导后,患者的CR 率达到64.0%。 国外一项回顾性研究对33 例非纳入临床研究, 并采用HMA+VEN 诱导治疗的老年初发AML 患者进行回顾性分析,其治疗后CR 率为63.3%[25]。 上述结果提示,该方案在注册临床研究及真实世界研究中获得的有效率类似。 同时, 患者60 d 内早期死亡率12.0%,也较其他方案低,提示该方案临床应用安全性良好。更重要的是,生存分析发现采用HMA 联合VEN 作为诱导治疗方案的患者长期生存率显著提升,其中位OS 及EFS 时间均较采用传统化疗方案的患者延长超过1 倍。 而未接受化疗的患者,生存期不足半年;上述结果提示,对于不耐受强化化疗的老年AML 患者应在改善其综合状态后尝试更积极的治疗手段,以改善其生存状态。
综上所述,本研究结果表明,通过CGA 评分筛选出的不耐受强化诱导化疗的老年AML 患者具有高龄、合并症复杂、细胞遗传学及分子生物学不良预后因素多的特点; 其长期预后较差。 HMA+VEN的新型诱导治疗方案较传统方案在有效性及安全性上均具有一定优势,可以尝试在上述人群中进一步推广使用。
