1株牛源致病性蜡样芽孢杆菌特征分析
2022-07-25杨增岐
雨,王 娟,杨增岐
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
蜡样芽孢杆菌是蜡样芽孢杆菌群中一种产芽孢、无荚膜的革兰阳性兼性厌氧菌[1-2],对外界环境有较强的适应能力,能够广泛存在于土壤、河流等自然环境和人类食物当中[3-4]。
蜡样芽孢杆菌由于能够导致多种疾病而被广泛关注[5-7],其能够引起全身性和局部感染,在免疫功能缺陷个体中能够导致死亡[8]。蜡样芽孢杆菌最常引起的是以腹泻和呕吐为主要症状的食源性疾病,分别由腹泻相关毒素(HBL、NHE、CYTK)和呕吐毒素引起[9-11]。关于蜡样芽孢杆菌引起食品污染和食物中毒在我国多有报道[12-13],除此之外蜡样芽孢杆菌还可以引起牛猝死和奶牛乳房炎[14-15],但由于其引起的猝死症状与产气荚膜梭菌相似,临床上常被混淆[16]。
为进一步了解蜡样芽孢杆菌疾病在奶牛养殖中的危害并对蜡样芽孢杆菌疾病的诊断和防治提供参考。本试验以全基因组测序、药敏检测以及小鼠感染模型的建立为基础对1株分离自猝死荷斯坦奶牛肝脏的蜡样芽孢杆菌进行了特征分析。
1 材料与方法
1.1 样品来源2020年末,陕西省华阴县某规模化奶牛养殖场出现零星荷斯坦奶牛猝死。剖检显示,猝死荷斯坦奶牛肝脏和肠道发生明显病变,初步怀疑为产气荚膜梭菌感染;无菌采集1头猝死荷斯坦奶牛肝脏和小肠,送至西北农林科技大学兽医传染病实验室进行细菌分离鉴定。
1.2 主要试剂细菌DNA提取试剂盒购自天根生化科技有限公司;昆明小鼠购自西安交通大学实验动物中心;细菌培养96孔板为广州洁特生物过滤股份有限公司产品;2×Taq PCR StarMix为北京GenStar生物科技有限公司产品;药品购自上海源叶生物科技有限公司;胰胨-亚硫酸盐-环丝氨酸(TSC)培养基、厌氧肉肝汤培养基、CAMHB肉汤、LB肉汤和普通营养琼脂购自青岛海博生物技术有限公司。
1.3 细菌分离鉴定常规细菌分离培养:取猝死荷斯坦奶牛肝脏切面涂布接种于2个5%绵羊血平板,分别置于37℃温箱和厌氧培养箱中培养20 h;接种环挑取过夜培养的菌落,划线接种于5%绵羊血平板进行细菌纯化,分别置于37℃厌氧培养箱中培养20 h。
产气荚膜梭菌分离培养:取部分肝脏和肠道内容物接种于厌氧肉肝汤培养基,培养18 h进行增菌,取菌液进行3 000 r/min离心2 min后划线接种于TSC培养基置于厌氧培养箱37℃培养24 h,若出现颜色变黑的菌落则将其平板划线至5%绵羊血平板进行进一步分离纯化。
菌种鉴定:细菌培养完成后分别进行细菌菌落形态观察、革兰染色镜检、16S rRNA序列PCR扩增并送至西安擎科泽西生物技术有限公司进行测序。
1.4 分离菌株全基因组测序将分离菌株接种于LB肉汤中过夜培养,无菌条件下取过夜培养菌液3 mL,25℃、12 000 r/min离心2 min,按照细菌DNA提取试剂盒流程提取分离菌株DNA并送至金唯智生物科技有限公司进行全基因组测序。
1.5 分离菌株药敏试验通过微量肉汤稀释法对分离菌株进行药敏检测,在96孔细菌培养板每孔加入50 μL CAMHB肉汤,并将阿莫西林、氨苄西林、恩诺沙星、氟苯尼考、磷霉素、壮观霉素、万古霉素、庆大霉素、四环素、乙酰甲喹在96孔细菌培养板上进行梯度稀释。5% 绵羊血平板上刮分离菌株菌落,生理盐水稀释为麦氏浊度为0.5的菌液,每60 μL 菌液与5 mL CAMHB混合均匀后,按照每孔50 μL加入96孔细菌培养板,37℃培养20 h。通过观察孔内菌株生长情况统计所选抗生素对试验菌株的最小抑菌浓度(MIC)。
1.6 小鼠致病性试验自5%绵羊血平板上刮取分离菌株菌落,用无菌生理盐水稀释均匀后按照1∶100接种于150 mL LB肉汤中,37℃培养。每1 h取菌液进行10倍梯度稀释后取50 μL涂布接种于5%绵羊血平板进行活菌计数,并绘制该菌株在12 h内的生长曲线。
20只小鼠随机均分为5组,将使用生理盐水2倍梯度浓度稀释的分离菌株菌液0.2 mL/只腹腔注射攻毒各组小鼠,并对各梯度稀释的菌液进行活菌计数,初步确定该菌株对小鼠的半数致死量所在区间。另取40只小鼠随机均分为5个试验组,在预试验得出的区间内按照0.7倍进行梯度浓度稀释后0.2 mL/只腹腔注射攻毒试验组小鼠,统计各试验组小鼠死亡情况并使用IBM SPSS Statistics 26计算该菌株对小鼠的半数致死量。全程取8只小鼠0.2 mL/只腹腔注射生理盐水,给予与试验组小鼠相同饲养条件作为对照组。
将试验组死亡小鼠与对照组小鼠进行剖检,对比观察试验组死亡小鼠的病理变化;并将病变组织器官进行常规石蜡制片和组织病理学观察。
2 结果
2.1 细菌分离鉴定厌氧和需氧条件下,肝脏切面涂板的5%绵羊血平板上均分离到灰白色、表面粗糙、边缘不整齐并带有淡绿色溶血环的较大菌落(图1);TSC培养基上未发现符合产气荚膜梭菌特征的菌落,但同样分离得到了表面粗糙、边缘不整齐的较大菌落;革兰染色镜检显示其为革兰阳性中等大小杆菌、多成对或链状排列(图1),16S rRNA序列测序结果Blast显示分离菌株为蜡样芽孢杆菌。

图1 分离菌株的菌落特征及革兰染色镜检(10×100)
2.2 全基因组分析经CGE (https://cge.cbs.dtu.dk/services/ResFinder/)和 VFDB (http://www.mgc.ac.cn/VFs/)分析,得知该蜡样芽孢杆菌分离株基因组大小为5.51 Mb,MLST分型属于ST1150,菌株基因组携带有磷霉素耐药基因fosB以及多种毒素基因(表1)。使用MEGA 7.0以及在线工具iTOL (https://itol.embl.de/)对该蜡样芽孢杆菌分离株(BN)与NCBI上记录的我国和其他国家蜡样芽孢杆菌进行进化树分析表明,相比于国内蜡样芽孢杆菌菌株,印度和美国的蜡样芽孢杆菌菌株与本次分离的蜡样芽孢杆菌之间具有更近的进化关系,表明本试验所分离蜡样芽孢杆菌可能是由国外传入我国(图2)。

表1 蜡样芽孢杆菌分离株所携带毒素基因

图2 不同地区蜡样芽孢杆菌菌株进化树分析
2.3 分离菌株药敏试验常用抗生素对该菌株的MIC显示(表2),氨苄西林、头孢他啶、乙酰甲喹、磷霉素和壮观霉素对该菌株的MIC较高(>64 mg/L),乙酰甲喹对该菌株的MIC处于中等水平(16 mg/L),万古霉素、四环素、恩诺沙星、氟苯尼考和庆大霉素对该菌株的MIC较低(<0.5~2 mg/L)。结果表明,万古霉素、四环素、恩诺沙星、氟苯尼考和庆大霉素更适合蜡样芽孢杆菌疾病的临床用药。

表2 蜡样芽孢杆菌分离株对多种抗生素MIC值 mg/L
2.4 小鼠致病性试验本试验中,该蜡样芽孢杆菌生长曲线显示其对数生长期为2~5 h,5 h后活菌数目稳定在7.5×108CFU/mL上下。该菌株12 h培养过程中,菌液D600持续上升,对数生长期菌液对应D600值在0.1~1.35之间(图3)。

图3 蜡样芽孢杆菌分离株生长曲线
不同攻毒剂量下小鼠的死亡情况不同(表3),在95%置信区间内该蜡样芽孢杆菌对小鼠的半数致死量的估计值为1.247×107CFU,对应的下限和上限分别为 1.023×107,1.507×107CFU(表4)。

表3 不同攻毒剂量下小鼠死亡情况

表4 不同死亡概率对应攻毒剂量及95%置信区间
攻毒后1 h左右小鼠开始呈现持续性匍匐爬行姿态,死亡时间集中在12 h内,死亡小鼠病变主要集中于肺脏、肝脏和肠道(图4),表现为肺脏严重出血(图4D)、肝脏质地变脆、颜色变灰白(图4E)、肠壁水肿并伴有出血(图4F),死亡小鼠肝脏进行细菌分离鉴定仍能分离到该蜡样芽孢杆菌。病理切片观察可见死亡小鼠肠黏膜脱落、肠绒毛破碎;肝细胞肿大出现空泡变性、肝细胞索状排列结构紊乱、肝血窦变窄等病变(图5)。
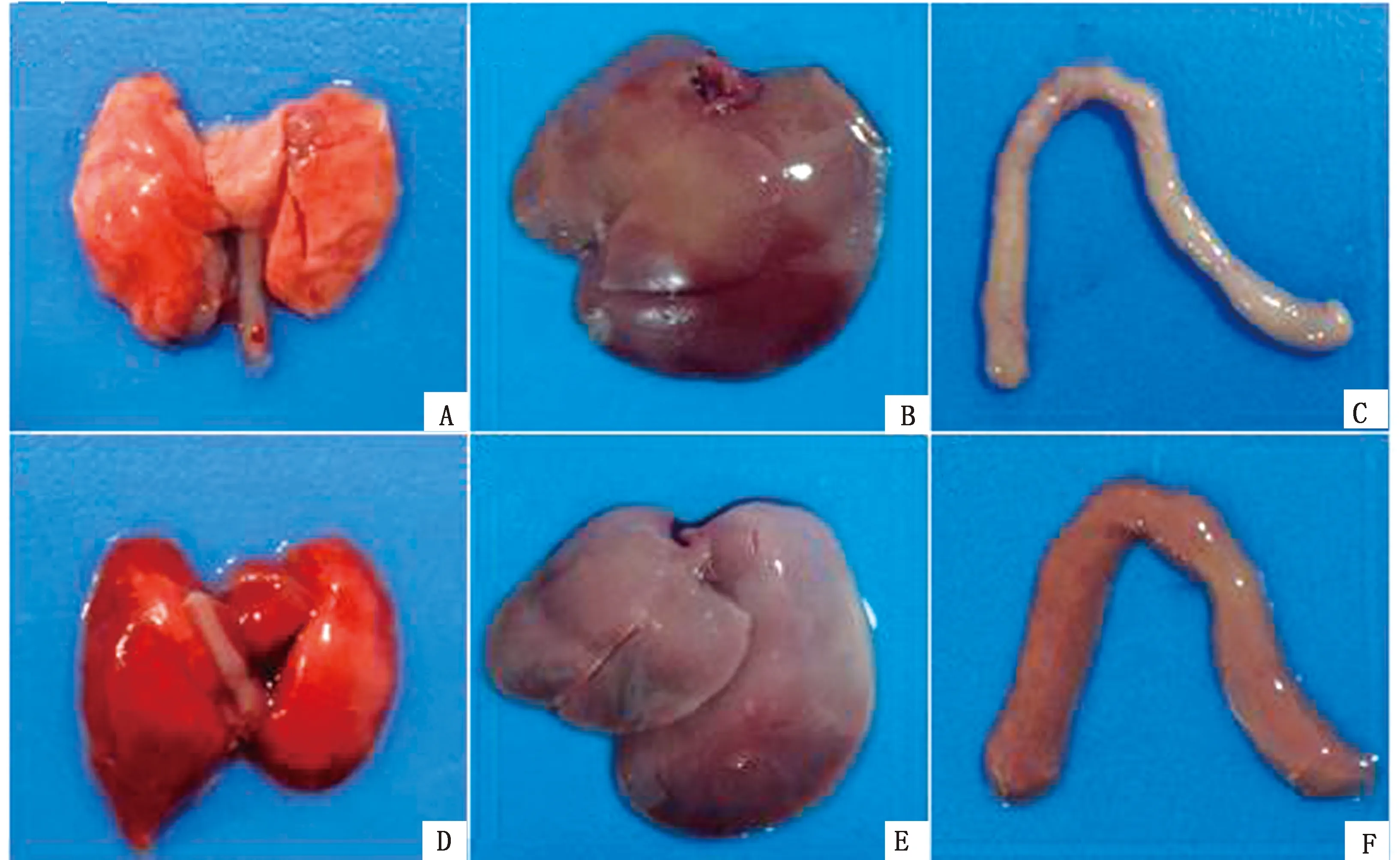
A.~C.对照组小鼠肺脏、肝脏、肠道;D~F.试验组小鼠肺脏、肝脏、肠道

A.、B.对照组肠道、肝脏;C、D.试验组肠道、肝脏
3 讨论
该蜡样芽孢杆菌自猝死荷斯坦奶牛肝脏分离,基因组携带有多种毒素基因,腹腔注射攻毒1 h左右小鼠开始呈现持续性的匍匐姿态,攻毒 1×107CFU 水平时即可引起小鼠死亡;且死亡小鼠出现与猝死奶牛相似病变并能从肝脏分离到该蜡样芽孢杆菌。可判断该菌株具有较强的毒力,与荷斯坦奶牛的猝死密切相关。
死亡小鼠的肝脏、肠道和肺脏均出现明显病变,生产中综合肝脏、肺脏和肠道等多种组织器官病变对蜡样芽孢杆菌疾病进行诊断能够使诊断结果更加准确。药敏试验显示氨苄西林、头孢他啶、乙酰甲喹、磷霉素和壮观霉素对该蜡样芽孢杆菌作用较弱,庆大霉素、万古霉素、恩诺沙星、四环素与氟苯尼考对该蜡样芽孢杆菌作用明显。作为参考,畜牧生产中针对于蜡样芽孢杆菌疾病的用药可以优先选择庆大霉素、恩诺沙星、四环素与氟苯尼考。
本研究表明,我国奶牛养殖中存在携带有多种毒素基因且对某些常用抗生素具有较强抵抗力的强毒力蜡样芽孢杆菌菌株,与奶牛猝死密切相关。在畜牧生产中应加强对蜡样芽孢杆菌疾病的诊断和合理用药,防止相应蜡样芽孢杆菌菌株经奶制品对人类造成感染。
