真菌菌群在炎症性肠病中的作用研究进展
2022-07-19杨卓杨欢于继凯周云岳剑李淑霞
杨卓 杨欢 于继凯 周云 岳剑 李淑霞
(1.甘肃中医药大学,兰州 730000; 2.甘肃中医药大学附属医院,兰州 730000)
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),是消化道的慢性复发性炎症性疾病,多年来IBD与肠道菌群的关系备受关注[1-2],其发病率在全球范围内呈上升趋势[3]。IBD的发病机制是遗传易感性、环境影响和肠道屏障受损等多因素之间相互作用的结果[4-5]。目前,随着宏基因组、18SrRNA和真菌内部转录间隔区(ITS)扩增子测序技术的发展,诸多研究已发现IBD患者的肠道真菌菌群发生了变化,但尚不清楚这种变化是IBD发病的起因还是结果。Sokol等[6]通过分析IBD患者的粪便样本,检测到担子菌门和子囊菌门的比值较健康个体上升。最近的真菌测序分析也揭示了IBD患者粪便和炎症黏膜中念珠菌和马拉色菌的增加,存在明显的真菌失调,证实了真菌菌群和IBD之间存在潜在的联系[7]。Ott等[8]研究发现,CD患者的平均真菌多样性更高,而在UC患者的粪便中真菌多样性较低,表明CD患者的的特定肠道环境有利于真菌定植。研究表明[9],CD患者肠道炎症部位的真菌菌群明显不同于非炎症部位,肠道真菌菌群组成的变化可能与黏膜炎症、疾病活动度有关。担子菌门和子囊菌门之间具有较强的负相关性,疾病活动期时担子菌门丰度增加,而子囊菌门丰度减少[10]。而在IBD缓解期,子囊菌门和担子菌门的丰度比值并无改变[11]。此外,真菌在急性肠道炎症时对维持肠道细菌菌群和微生物-宿主的稳态起重要作用,而慢性复发性结肠炎时,真菌会易位至其他部位,造成新的损害并加重炎症程度[12]。由此可见,肠道真菌可能在IBD的发生发展中发挥多方面作用。
1 真菌菌群概述
人类肠道菌群是由细菌、真菌和病毒等组成的复杂生态系统[13]。到目前为止,大多数研究都集中在肠道微生物群中的细菌部分及其在健康和疾病中的作用,而真菌在宿主内环境稳定中的关键作用研究较少。胃肠道中含有高度多样化的真菌,是人类研究最多的真菌生态位,目前通过对从粪便中提纯的DNA中的标记基因进行ITS扩增子测序技术和全基因组测序,发现的有66个属,分成约180个种,在真菌分类群中,子囊菌门(Ascomycota)与担子菌门(Basidiomycota)在真菌群中占主导地位[14]。虽然真菌菌群仅占肠道微生物群落的0.1%左右,但在肠道细菌组成的动态平衡和黏膜免疫反应中起着决定性的作用,在生态系统中有着不成比例的意义[15]。在人体肠道中检测到的肠道真菌类别可以分为常驻和非常驻两类,它们具有影响重要功能的潜力,有些真菌能够绕过或穿透表面屏障以及抵御人体免疫系统在肠道内生长和定植,继而感染人类[16]。近几十年来,由于免疫缺陷患者等易感人群的数量增加,真菌感染也有所增加,现在已对公众健康构成严重威胁。
共生细菌虽然对宿主健康和免疫调节具有影响,但也不足以调节肠道菌群的所有功能,肠道共生真菌与细菌相互之间有着密切联系,存在相互影响的可能性[17]。长期服用广谱抗生素的个体中酵母的过度生长反映了共生细菌在肠道真菌定植中的调节作用。肠道真菌菌群似乎比细菌菌群更不稳定,较细菌而言显得多变[18]。二者的丰度似乎呈负相关,肠道中真菌的增多通常是细菌菌群失调的迹象,而细菌菌群的破坏是真菌过度生长的前提[19]。特定细菌的存在可能会降低真菌的存活率和定植能力,间接改变真菌基因组对宿主的作用,细菌代谢产物如丙酸也可以自然控制人体肠道内真菌的致病性和宿主细胞的损伤[20-21]。而真菌可以抑制细菌的毒力,真菌菌群感应分子法尼醇也会影响细菌的基因调控,并能显著改变细菌的转录谱[22]。证实了肠道细菌与真菌之间除了共生关系外,也存在竞争作用。因此,了解IBD患者中真菌和细菌之间的确切跨域相关性可能会改善这类患者的治疗策略[23]。
2 真菌菌群的免疫机制
目前特定真菌的研究还都聚焦于白念珠菌(Candidaalbicans)和酿酒酵母(Saccharomycescerevisiae)上,免疫系统如何识别真菌的入侵或定植还未完全了解[24]。研究表明[25],共生真菌可以激活与上皮屏障完整性相关的宿主保护性免疫通路,也可以引发与IBD相关的炎症反应。巨噬细胞可识别真菌细胞壁上的β-葡聚糖等多种复合物,继而激活机体先天和获得性免疫反应,抑制肠道真菌菌群的过度繁殖或外来病原菌的定植作用。在该免疫应答过程中, 吞噬细胞表达并激活宿主细胞表面的C型凝集素受体(C-type lectin receptor,CLRs)的家族成员Dectin-1、Dectin-2和Mincle,以及具有次要作用的Toll样受体(Toll-like receptors,TLRs)和Nod样受体(NOD-like receptors,NLRs)等模式识别受体 (pattern recognition receptor,PRR),从而对病原相关分子模式(pathogen-associated molecular patterns,PAMPs)识别及信号传导,并通过胱天蛋白酶募集域蛋白9(caspase-associated recruitment domain 9,CARD9)和核因子-κB(NF-κB)诱导信号级联反应产生促炎细胞因子应答先天性免疫,还可诱导树突细胞释放辅助性T细胞17(T helper cell 17,Th17)和Th1应答获得性免疫,从而启动免疫功能参与真菌的免疫识别[26]。作为真菌关键模式识别受体的dectin-1缺失被认为与IBD相关,Dectin-1诱导产生Th17,通过CARD9激活胞内信号通路产生作用[27]。此外,定量PCR和流式细胞分析证实,编码真菌CLRs的转录子在CX3CR1+单核巨噬细胞(MNPs)显著高表达,CX3CR1+MNPs对于启动抗真菌CLRs激活下游的信号级联至关重要[34]。由此可见,Dectin-1、CARD9、IL-17信号途径、CX3CR1+MNPs等均可能作为IBD真菌菌群失调的驱动因素,参与调节肠道内环境的稳定(见图1)。
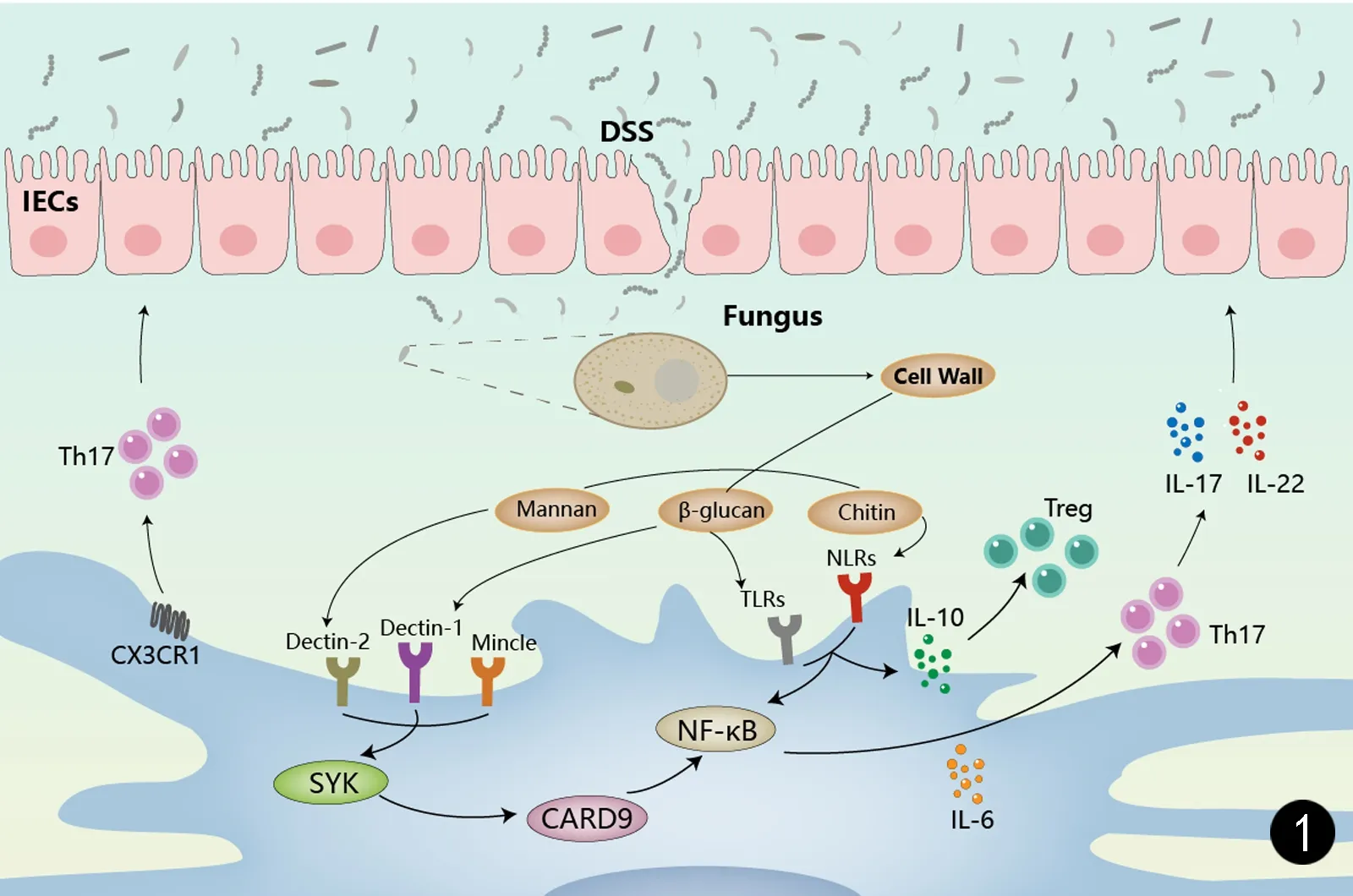
图1 图1 PAMPs被PRR识别后,通过SYK方式诱导下游CARD9激活NF-κB通路促进IL-6和IL-10等细胞因子的分泌来维持Th17/Treg平衡,而启动免疫功能参与真菌的免疫识别Fig.1 After PAMPs are recognized by PRR, SYK induces downstream CARD9 to activate the NF-κB pathway to promote the secretion of IL-6 and IL-10 cytokines to maintain the Th17/Treg balance, and to initiate immune function to participate in the immune recognition of fungi
3 真菌菌群与炎症性肠病
3.1 念珠菌
念珠菌(Candida)隶属子囊菌门,通常存在于正常人的口腔、肠道及阴道,白念珠菌是其中最为常见的致病菌,占念珠菌感染的75%,在IBD患者肠道内,白念珠菌的检出率高达97.1%[28]。由于缺氧和营养受限,念珠菌在消化道中的代谢活性很低,被认为是机会致病性真菌[29]。当机体免疫功能降低,它便会大量繁殖并从酵母相转变为菌丝相,侵入细胞引起疾病[30]。Liguori等[31]研究发现,在CD患者的粪便和黏膜中,真菌菌群丰度和多样性均明显升高,其中念珠菌属的比例大幅增高。Limon等[32]研究显示,在IBD患者中念珠菌的定植增加,可以放大IBD炎症过程,延迟炎症病变的愈合。Dectin-1和β-葡聚糖之间的相互作用在念珠菌的应答中起着重要作用,Dectin-1基因缺陷小鼠由于念珠菌的过度生长而加重UC病程。最近的一项研究表明[33],Dectin-1基因的多态性与UC患者疾病严重程度的增加有关,Dectin-1在葡聚糖硫酸钠(DSS)诱导的UC小鼠模型中具有调节炎症严重程度的中心作用,Dectin-1缺乏增加了小鼠对白念珠菌感染的易感性,可能的机制是通过增加肠的通透性和调节宿主嘌呤代谢而加重UC炎症。
研究显示[34],编码CX3CR1的基因中的SNPs与CD患者的抗真菌IgG反应密切相关,CX3CR1+MNPs在肠道抗真菌免疫中起关键作用,80%以上的CX3CR1+MNPs能有效识别和应答念珠菌,并以脾酪氨酸激酶(spleen tyrosine kinase,Syk)依赖的方式表达抗真菌受体并激活抗真菌反应,以预防UC,并且在产生白细胞介素17(interleukin 17,IL-17)的Th17细胞的发育中起着至关重要的作用。而在CD患者中,发现了编码CX3CR1基因的错义突变,并发现该突变与抗真菌反应受损有关[35]。此外,白念珠菌的肠道定植诱导T细胞产生IL-17和IL-22,这些Th17细胞将免疫系统与肠道组织紧密结合在一起,控制小鼠和人类体内特定的共生细菌和真菌[36]。尽管IL-17可促进肠道上皮细胞表达防御素,从而在抵抗病原菌侵袭中发挥了重要作用[37]。但高水平的IL-17在多种细胞因子协同作用下可募集炎症细胞,促进吞噬细胞分化,从而扩大组织局部病理损伤[38-39]。可见,IL-17在具有保护性免疫效应的同时更具有强大的潜在致炎效应。因此,对IL-17水平的影响可能是念珠菌定植增强炎症的能力的基础[40]。白念珠菌可能通过诱导真菌抗原反应性Th17细胞的分化,促进促炎细胞因子IL-17和IL-22的分泌来增加IBD的风险,从而在IBD患者的肠道中起致病作用[41]。
3.2 马拉色菌
马拉色菌(Malassezia)隶属担子菌门(Basidiomycota),由于它们依赖脂质来生长,所以主要生长在产生油性分泌物的皮脂腺中,是皮肤微生物群中的主要真菌成员[42]。然而,随着测序方法的发展,马拉色菌也已被鉴定为肠道的常驻真菌[43]。尽管以前的研究大多认为这种存在是短暂的,对宿主没有影响。但最近的研究显示[44-45],IBD患者在急性发作期的马拉色菌数量较高,肠道黏膜中发现的限制马拉色菌(M.restricta)可能以CARD9依赖的方式加重肠道炎症,CARD9多态性有利于限制马拉色菌定植,CARD9基因座的遗传缺陷也被认为与IBD的严重程度有关,说明CARD9相关信号通路对于机体感知限制马拉色菌起重要作用。研究发现[46-47],衔接分子CARD9为IBD的相关基因,作为CLRs的关键下游信号分子,主要是通过Dectin-2和Mincle参与对马拉色菌的免疫应答。CARD9或Dectin-2的缺失降低了炎性细胞因子TNF和IL-6的分泌水平,从而加重结肠炎[49]。因此,CARD9的缺失不仅可能导致对真菌病原体的易感性[49],还可能增加IBD的发病风险[50]。此外,CARD9缺乏也会影响肠道真菌的免疫调节,从而影响结肠癌的发生[51-52]。
3.3 酵母菌
酿酒酵母是是与人类关系最广泛的一种酵母,广泛存在于人体的不同部位。目前,肠道中的抗酿酒酵母抗体(ASCA)已被用作识别大多数CD患者的重要血清学标志物,有力地支持了酿酒酵母菌在IBD中的作用[53]。基于定量PCR的粪便样本中酿酒酵母菌的检测发现,IBD活动期患者粪便中的酿酒酵母多于疾病缓解期患者,说明酿酒酵母能影响IBD活动度[6]。研究表明[54],在IBD受试者的粪便样本中,酿酒酵母菌和白念珠菌的丰度之间呈负相关,酿酒酵母菌与白念珠菌的定植和黏附存在竞争,并通过抑制白念珠菌中可溶性天冬氨酸蛋白酶的表达,或阻止白念珠菌转化为侵袭性菌丝形式,提示它们在IBD发生过程中存在一定的竞争关系。
此外,布拉酵母菌(Saccharomycesboulardii)作为一种益生真菌,主要通过通过分泌细菌素、上调防御素等增加宿主的免疫功能以及限制树突状细胞向炎症部位移动来减轻肠道局部炎症,已被用于缓解肠道炎症的辅助治疗[55-56]。布拉酵母菌对DSS诱导的UC小鼠的抗炎作用,提示该酵母通过转录后调控microRNAs的表达水平发挥免疫调节作用。研究表明[57-58],布拉酵母菌可上调肠道分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)水平,来维持Th1/Th2和Th17/Treg平衡,促进IL-6和IL-10等细胞因子的分泌,从而限制IBD病理性炎症反应。其次,用布拉酵母菌进行的治疗也可部分缓解缺氧诱导因子-1α(HIF-1α)和HIF-2α的水平,从而改善DSS诱发的UC[59]。
4 结 论
综上所述,真菌菌群在炎症性肠病中扮演着不可缺少的角色,真菌菌群的重建可能为炎症性肠病提供新的治疗途径。要开发微生物的治疗剂,就需要识别肠道菌群中有助于预防疾病的特定真菌以及任何菌株特定的靶点。因此,未来的研究应尝试从定量和功能两个方面表征更多真菌菌群的组成,在现有的数据库中扩大真菌和其他微生物的参考基因组,尝试挖掘其他真菌的致病机制或治疗潜能,以评估它如何影响肠道炎症的转归和治疗反应。还应改变目前对人类微生物群的“细菌中心”观点,并在细菌-真菌相互作用或肠道真菌与IBD患者的免疫反应方面进一步探索。此外,了解导致IBD发病的机制对于发现新的治疗策略以提高患者的治疗水平至关重要,需要更多的基础研究来为这一微生物组新领域的治疗方法提供信息,以促进人类肠道健康。
