裸果木再生体系建立与不定芽发生研究
2022-07-16杨海峰王佳琪甘晓雪王树森韦东山于凤强
杨海峰,王佳琪,甘晓雪,王树森,韦东山,于凤强
(1 内蒙古农业大学 林学院,呼和浩特 010010;2 内蒙古农业大学 沙漠治理学院,呼和浩特 010010;3 鄂尔多斯林业和草原事业发展中心,内蒙古 鄂尔多斯 017000)
裸果木(Gymnocarposprzewalskii)为多年生半灌木,具有多分枝、叶线型、花两性、花粉小等特征,是古地中海旱生植物区系的孑遗植物[1-3],主要分布在中国的甘肃、青海、内蒙古、新疆等地[4-5]。裸果木起源第三纪,经历冰期,积累了丰富的遗传变异,有较高的遗传多样性,适应环境能力强[6-7]。但随着气候变化,裸果木自然分布有向水源充足地区移动的趋势,适生区逐步缩小[8-9]。加之裸果木是荒漠地区动物的食物来源之一,其数量日益减少,于1997年被认定为国家一级保护植物[10-11]。裸果木数量减少的另一个原因是其繁殖具有一定的困难和局限性。在宁夏中卫观察发现,裸果木花期为降雨量集中月份,结实率不到1%[10];在新疆阿合奇县裸果木有性繁殖的结实率仅为6.37%,其有性繁殖困难[12]。有报道认为在其无性繁殖中采用生根粉可促进裸果木硬枝生根,在沙土中成活率达80%[13],但传统无性繁殖需要大量繁殖体,不利于野生资源的保护,且效率不高。
植物组织培养技术是解决珍稀林木种质资源保护及可持续利用问题的有效途径之一,其具有外植体丰富、生长迅速、繁殖系数大及占地面积小等特点[14],可有效保存珍稀濒危的林木种质资源的多样性,对于裸果木的种质资源保护及可持续利用具有重要的应用价值。有关裸果木的组织培养研究较少,仅见汪之波等[15]利用裸果木下胚轴为外植体,采用6-BA和NAA组合,成功获得再生植株,但该途径存在芽分化效率较低,愈伤较多,再生植株生根不理想等问题,需要进一步优化该组培体系,但未见后续报道。因此,需要深入开展裸果木的植物组织培养研究工作,为裸果木的种质资源保护及可持续利用提供一条有效途径。
本研究利用裸果木健壮植株的茎段为外植体,进行6-BA与IBA不同浓度组合的组织培养,筛选最佳愈伤增殖及不定芽分化配方,确定影响不定芽生根的关键因素,实现离体再生,同时对裸果木不定芽分化过程进行解剖结构分析,确定其起源。本研究对裸果木的快速繁殖,规模化应用提供了相关研究基础,同时为保护和繁衍这一珍稀植物种质资源提供了一条新途径。
1 材料和方法
1.1 实验材料
本实验材料采自内蒙古自治区乌拉特后旗呼和温都尔镇的郊区林场(E106.83,N40.95),为自然生长的裸果木健壮植株。
1.2 实验方法
1.2.1 外植体消毒将裸果木枝条截成长2~3 cm带叶片的茎段,流水冲洗4 h。之后,在超净工作台内用75%酒精清洗2次,每次30 s,无菌水清洗2次,3%次氯酸钠消毒2次,每次10 min。最后,无菌水清洗6~8次,无菌滤纸吸干,作为外植体备用。
1.2.2 初代愈伤诱导外植体接种到愈伤诱导培养基(1/2 MS+0.1 mg·L-1IBA+0.05 mg·L-1NAA+30 g·L-1糖+7 g·L-1琼脂,pH 5.8),光照培养16 h,黑暗8 h,培养温度(25 ± 2) ℃。接种50瓶,每瓶2个茎段,4周后统计愈伤诱导情况。
1.2.3 愈伤组织增殖及不定芽分化将诱导的愈伤组织接种到MS培养基内,添加不同浓度水平6-BA(0、0.2、0.5、0.7、1.0、1.2、1.5、1.7、2.0 mg·L-1)和IBA(0、0.2、0.5、0.7、1.0、1.2、1.5、1.7、2.0 mg·L-1)的组合配比试验。每个激素组合接种25块愈伤,重复3次。接种后,每周统计愈伤组织直径、不定芽分化数量。
1.2.4 不定芽生根培养(1)确定适合不定芽生根的基本培养基。选择生长至约2 cm的裸果木不定芽,分别接种到蔗糖浓度30 g·L-1的MS、1/2 MS、WPM、DCR和SH的基本培养基内(不含激素),每个组合接种30个不定芽,重复3次。接种后,每周观察不定芽生根状况,第4周拍照并统计生根情况。
(2)确定适合不定芽生根的蔗糖浓度。选择生长至约2 cm的裸果木不定芽,接种到不含激素的SH培养基内,设置蔗糖浓度梯度为0、10、20、30 g·L-1进行培养。每个组合接种30个不定芽,重复3次。接种后,每周观察不定芽生根状况,第4周拍照并统计生根情况。
1.2.5 愈伤组织分化不定芽过程的解剖学观察将裸果木由愈伤分化形成不定芽的过程,每隔3 d取样,FAA固定,进行石蜡切片[16],切片厚度5 μm。芽点出现后的材料每隔3~6 d取样,琼脂糖固定,进行振动切片,厚度为30 μm。均采用苏木精-伊红染色(HE染色)。
1.2.6 统计指标初代愈伤诱导率=(产生愈伤的茎段数/接种茎段数) × 100%
生芽率= (产生不定芽的愈伤块数/接种愈伤块数) × 100%
平均不定芽数量=不定芽总数量/接种愈伤块数
生根率= (产生不定根的不定芽总数/接种不定芽总数) × 100%
平均不定根数量=不定根总数/接种不定芽总数
1.2.7 数据处理、图像分析方法本研究利用Excel 2010进行数据处理,SPSS 22.0显著性分析,对石蜡、振动切片采用尼康全自动显微镜Ni-E拍照,imageJ、Photoshop(CC 2018)完成图片拼合,Origin 2018绘图。
2 结果与分析
2.1 初代愈伤组织的诱导 裸果木茎段接种到愈伤诱导培养基内,培养至7 d,裸果木茎段基部开始膨胀,表面出现一层淡黄色愈伤(图1,A);培养至21 d,愈伤组织继续增大,直径约1 cm,为淡黄色、紧致、块状愈伤组织(图1,B);继代28 d后,愈伤呈半透明淡黄色、质地柔软、长势良好(图1,C),愈伤组织诱导率达90%。
2.2 6-BA和IBA对裸果木愈伤增殖的影响
2.2.1 愈伤增殖过程初代愈伤接种到6-BA与IBA不同浓度组合的愈伤增殖培养基(图2,A)。增殖第10天,愈伤直径增加约2 mm,颜色变为黄绿色(图2,B)。第20天,愈伤呈现3种分化方向,第1种愈伤体积明显增大,直径达2.5 cm,颜色变为深黄绿色(图2,C);第2种愈伤继续增殖,直径达1.5 cm,为半透明黄白色,分化出不定根(图2,D);第3种愈伤为黄绿色,增殖较慢,表面有少量不定芽分化形成(图2,E)。培养至30 d,愈伤增长较快,呈颗粒状、翠绿色,继续膨大,可占据培养基全部表面,内部中空。
2.2.2 6-BA和IBA对愈伤增殖的影响根据裸果木愈伤直径的相关数据,分析IBA、6-BA对裸果木愈伤增殖效果的影响(表1)。当6-BA浓度保持固定,随IBA浓度增加,愈伤直径呈先增大后减小的显著变化趋势;当IBA浓度保持固定,随6-BA浓度增加,愈伤直径未出现显著性差异变化。同时对主体间效果检定(表2),IBA的F值大于6-BA,达18.259,且IBA对愈伤增殖的影响达到极显著水平,因此,本研究认为IBA对裸果木愈伤增殖的影响高于6-BA,IBA为关键影响因子。在6-BA与IBA不同浓度组合中,1 mg·L-16-BA+1 mg·L-1IBA(图2,G)、1 mg·L-16-BA+1.2 mg·L-1IBA(图2,F)、1.5 mg·L-16-BA+0.2 mg·L-1IBA(图2,H)愈伤组织直径均值超过2.7 cm(图3)。但组合1 mg·L-16-BA+1 mg·L-1IBA形状更加规则、聚拢、褐化样本少,继代时,内部中空现象少,故较好的愈伤增殖组合为1 mg·L-16-BA+1 mg·L-1IBA。
2.3 6-BA和IBA对裸果木不定芽分化的影响
2.3.1 不定芽的分化过程初代愈伤接种到6-BA与IBA不同浓度组合的不定芽分化培养基内(图2,A)。培养至第10天,愈伤组织直径增加约2 mm,颜色由淡黄色向黄绿色转变(图2,B);培养至12 d,黄绿色愈伤表面有绿色芽点凸起(图4,A);培养至21 d,芽点分化为不定芽,高约0.5 cm(图4,B);培养至28 d,部分不定芽继续高生长,形成节间(图4,C),上述愈伤组织继代,愈伤表面不断分化不定芽,可形成丛生芽(图4,D)。
2.3.2 6-BA和IBA对不定芽分化的影响对第3周裸果木愈伤分化不定芽结果进行统计分析(表3),结果表明,不同浓度的6-BA与0或0.2 mg·L-1IBA组合,均可诱导愈伤分化不定芽。当IBA为0或0.2 mg·L-1时,随6-BA浓度增加,不定芽分化率呈先上升后下降趋势,其中IBA为0 mg·L-1、6-BA为0.5 mg·L-1时,愈伤生成量少,不定芽分化率最高,达92.3%(图5),且平均分化不定芽数量4.9个/块。而主体间效果检定发现(表4),IBA的显著性达0.049,小于0.05,对不定芽诱导存在显著影响,但0 mg·L-1IBA的生芽率明显高于0.2 mg·L-1,说明IBA抑制不定芽诱导,降低生芽率。结合上述内容分析,低浓度6-BA可快速诱导裸果木愈伤分化不定芽,而高浓度6-BA不利于不定芽分化,IBA为不定芽诱导的关键因素,起负调控作用。因此,基于前期裸果木愈伤诱导基础,裸果木愈伤分化不定芽的最佳培养基为MS+0.5 mg·L-16-BA+30 g·L-1蔗糖+7 g·L-1琼脂。
2.4 裸果木不定芽生根的关键因素影响
2.4.1 基本培养基对生根的影响为分析基本培养基对裸果木生根的影响,本研究选择MS、1/2 MS、WPM、DCR、SH为生根的基本培养基进行筛选。
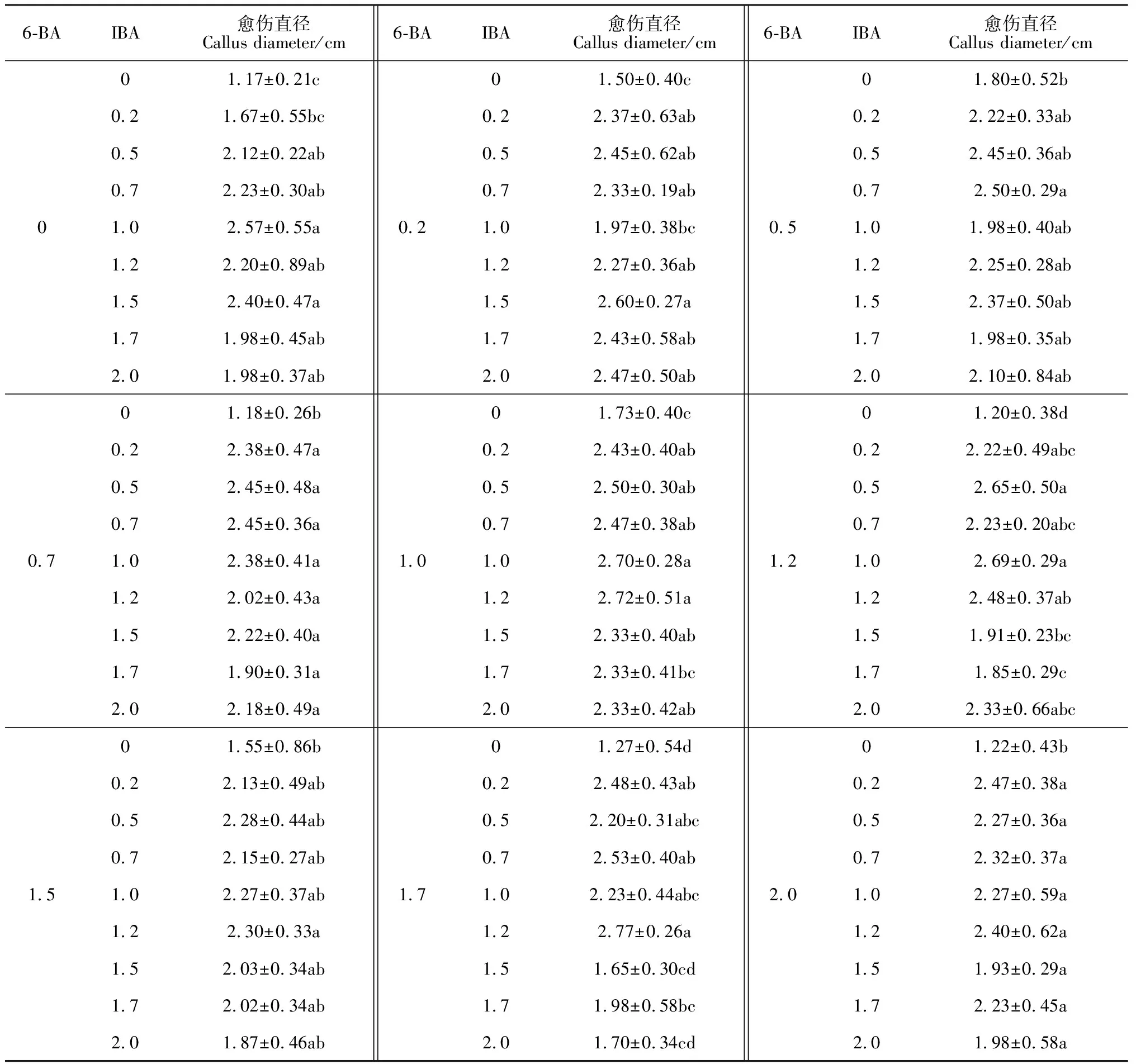
表1 IBA和 6-BA组合对愈伤增殖的影响
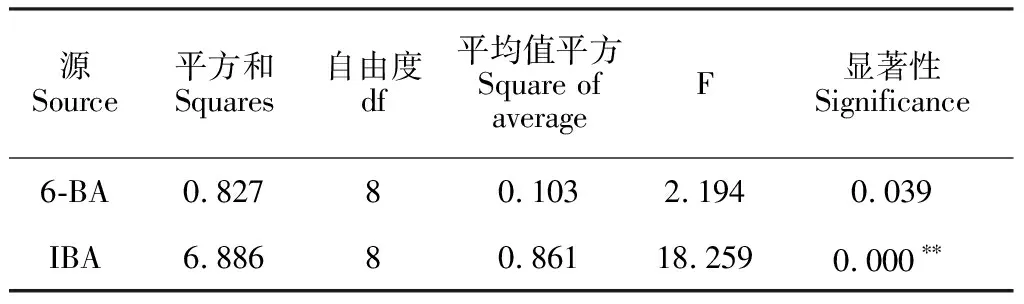
表2 主体间效应的检验
结果表明,培养至30 d,MS(图6,A)、1/2 MS(图6,B)、WPM(图6,C)基本培养基上,不定芽茎生长缓慢,基部愈伤较多,多数根沿培养基表面生长,呈褐色,长势弱;DCR(图6,D)、SH(图6,H)基本培养基上,不定芽茎生长较快,苗高达2.5 cm,生根率达82%以上(表5),但DCR基本培养基中,不定芽基部愈伤多于SH基本培养基。在SH基本培养基中,基部仅有少量愈伤,不定根呈乳白色,在培养基中生长状态良好,长度可达3 cm, SH为适合裸果木生根的基本培养基。
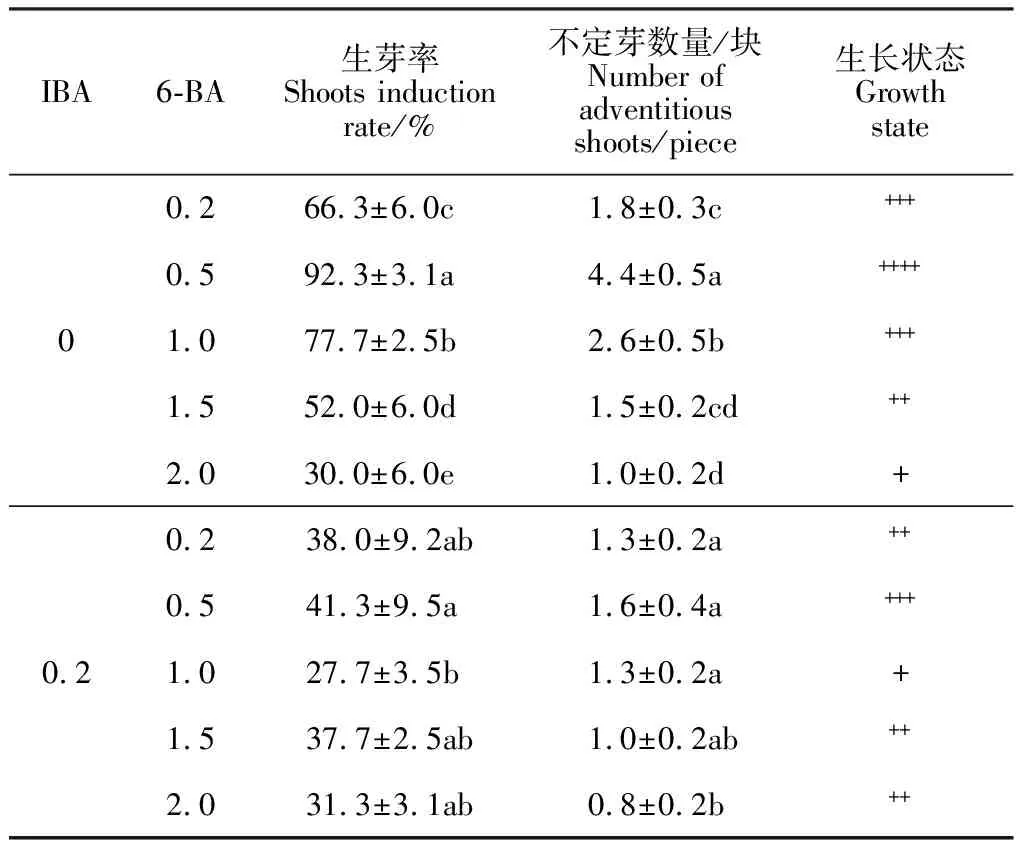
表3 裸果木愈伤分化不定芽数量统计表
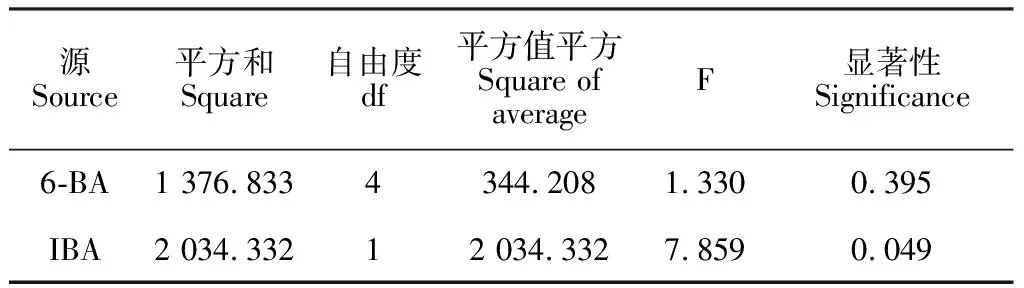
表4 主体间效果检定
2.4.2 蔗糖浓度对生根的影响为分析蔗糖对裸果木生根的影响,本研究选择添加不同蔗糖浓度的SH培养基为生根培养基进行蔗糖浓度筛选。研究发现,培养至40 d,蔗糖浓度为0 g·L-1的培养基上,不定芽生长较快(图7,A),不定芽基部无愈伤生成,平均不定根数量达3.1个(图7,E);蔗糖浓度为10 g·L-1时,不定芽生长快(图7,B),基部愈伤极少,平均不定根数量达5.7个(图7,F);蔗糖浓度为20 g·L-1时,不定芽生长较快(图7,C),基部愈伤较少、平均不定根数量达5.3个(图7,G;表6);蔗糖浓度为30 g·L-1时,不定芽茎生长缓慢(图7,D),基部愈伤较多、不定根少(图7,H)。据此分析,蔗糖浓度为10 g·L-1时,其生根率、不定根数量、生长高度均为最佳,但其愈伤形成与0 g·L-1蔗糖的培养基相比,仍有少量愈伤形成,但该愈伤不影响植株生长与移栽。因此,裸果木不定芽生根的最适培养基为SH+0~10 g·L-1蔗糖+7 g·L-1琼脂。本研究认为不添加蔗糖或低浓度蔗糖是裸果木诱导生根的关键因素之一。
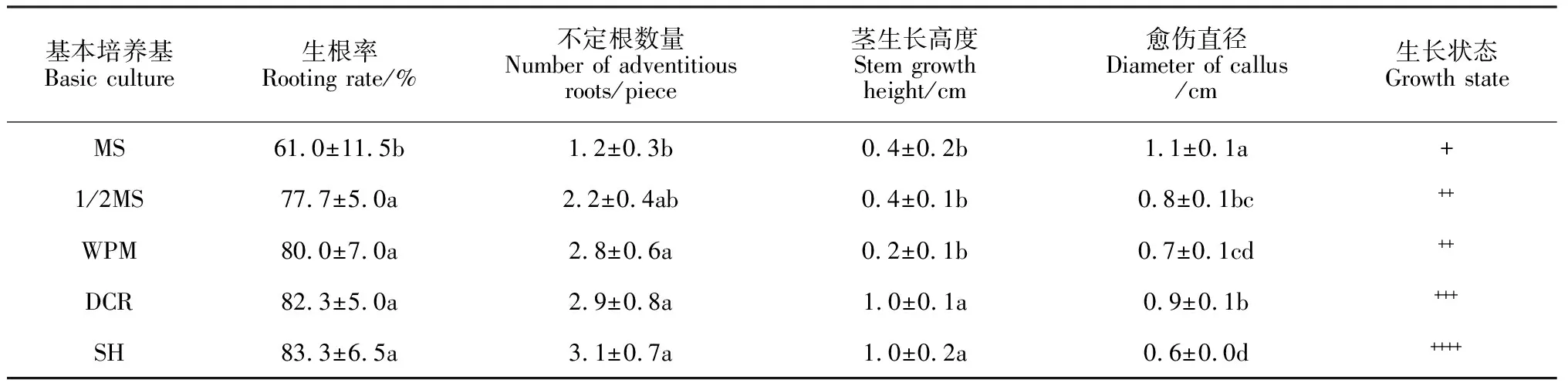
表5 裸果木不定芽生根统计表(基本培养基)

表6 裸果木不定芽生根统计表(蔗糖)
2.5 不定芽分化过程的解剖结构分析 为确认裸果木不定芽的起源,对裸果木愈伤分化过程进行解剖结构分析。培养0 d,细胞较大,形态不规则,细胞核小,染色浅(图8,A);培养3 d,细胞质浓缩,细胞核增大,向分生细胞发育(图8,B);培养6 d,细胞核进一步增大,染色深,具备团状分生组织结节(图8,C)及具有导管结构的维管组织结节(图8,E);培养9 d,维管组织结节形态持续增大,结节内部多中心(图8,D);培养12 d,愈伤表面有绿色凸起,切片可见愈伤表层细胞的细胞核分布集中,形成生长中心(图8,F);培养15 d,生长中心持续极性生长,细胞核占比增大,叶原基由生长中心伸出(图8,G);培养18 d,生长中心顶部分化出生长锥,长出愈伤(图8,H);培养28 d,不定芽具备生长锥、节间、叶片等结构(图8,I),愈伤内部维管组织结节解体,腋芽原基由不定芽基部分化(图8,I箭头)。上述裸果木愈伤分化不定芽进程分析表明,不定芽由愈伤表层分生细胞发育而来,为外起源。
3 讨 论
3.1 激素对裸果木不定芽分化的影响
激素是影响不定芽分化的关键因素。本研究发现,不同浓度6-BA与0、0.2 mg·L-1IBA组合可诱导愈伤分化不定芽,不定芽分化率随6-BA浓度增加,呈先上升后下降的趋势,6-BA为0.5 mg·L-1,IBA为0 mg·L-1时,不定芽分化率显著高于其他激素组合,因此认为,适中浓度6-BA利于不定芽分化。汪之波等[15]以裸果木下胚轴为外植体,进行裸果木的组织培养再生体系建立,认为不定芽分化诱导的最适激素组合为1 mg·L-16-BA和0 mg·L-1NAA,高浓度6-BA不利于不定芽分化,与本研究结果基本一致。但该研究添加6-BA的浓度高于本研究的最适浓度,原因可能为两个方面,其一可能是初始愈伤诱导的激素种类和浓度的差异,造成愈伤内激素累积水平差异,导致后续芽分化中激素需求水平不同,其二可能是采用外植体的差异,汪之波采用下胚轴诱导愈伤,而本研究采用茎段诱导愈伤,可能是外植体自身生理状态差异而导致。综合分析,在裸果木芽分化诱导过程中,细胞分裂素6-BA具有重要作用,适中浓度6-BA有利于芽分化,而高浓度6-BA不利于芽的分化。
3.2 基本培养基和蔗糖浓度对裸果木生根的影响
基本培养基对裸果木生根具有重要影响。本研究发现,采用MS、1/2MS、DCR培养基时,愈伤形成较多,不定根由愈伤表面生成,移栽易脱落。采用WPM、SH培养基时,愈伤形成较少,多数根由茎基部直接分化形成,但WPM培养基中,不定根呈褐色,长势弱,SH培养基中,不定根呈乳白色,生长状态良好。因此,SH培养基适合裸果木生根培养。究其原因,可能与基本培养基内硝态氮和铵态氮的应用比例有关,MS、WPM、DCR 的硝铵比接近1∶1,而SH培养基硝态氮含量高、铵态氮含量低,硝铵比值差距大,达到25∶3,这可能是SH培养基更适合裸果木的生根的原因之一。根据裸果木的进化生境分析,其主要分布西北荒漠地区,生境干旱、土壤贫瘠。根据苗艳芳等研究发现,干旱地土壤中硝铵比值差距大,为9∶1[17],这与SH培养基中硝铵比值相似。因此认为,硝铵比值大的SH培养基利于裸果木生根,这与其历史进化的生境可能存在相关性。
蔗糖是影响裸果木生的关键因素之一。本研究中,设置不同蔗糖浓度对比,发现低浓度或不添加蔗糖有利于裸果木生根及生长发育,是影响裸果木生根的关键因素。研究发现,高浓度蔗糖培养基中,裸果木的茎基部形成较多愈伤,由愈伤表面分化出不定根,生长缓慢,移栽时易脱落,影响成活率,但在低浓度或不添加蔗糖时,茎基部仅有少量或不出现愈伤,由基部直接分化出根,生长状态良好。因此,蔗糖浓度与愈伤形成存在直接关系,进而影响着不定根的分化与发育。有关蔗糖与愈伤形成的相关研究发现,低蔗糖浓度可抑制草莓(strawberry)花药壁及花丝断口处愈伤组织产生[18]。火焰卫矛(Euonymusalatuscv. ‘Compacta’)组培苗生根时,低浓度蔗糖有利于组培苗形成不定根,促进不定根生长[19]。樟子松(Pinussylvestrisvar.mongolica)组织培养不定根时也有相同发现,低浓度蔗糖利于不定芽生根[20]。综上所述,低蔗糖浓度可抑制愈伤生成,利于不定根分化生长。分析原因,裸果木主要分布西北荒漠地区,该地区土壤贫瘠,营养元素少,导致该植物对养分获取积极,蔗糖浓度较低有利于模拟其正常生长生境,有利于根的分化和植物的整体生长。因此,低浓度蔗糖利于裸果木不定芽生根。
3.3 不定芽起源分析
目前,植物组织培养不定芽有两种起源方式,外起源与内起源。多数植物仅存在外起源,而少数植物以外起源为主,内起源为辅。本研究发现,裸果木不定芽起源于愈伤表层分生细胞,为外起源。许多植物的不定芽分化均为外起源,啤酒花(HumuluslupulusL.)愈伤分化形成的维管组织结节内部的薄壁细胞及外部表层细胞均具有强大的分生能力,分化出不定芽,属外起源[21]。辣椒(CapsicumannuumL.)不定芽起源于愈伤组织表层的分生细胞,同样为外起源[22]。但也在其他少数植物的愈伤培养中发现,内外起源均存在,杂交构树(BroussonetiapapyriferaL. Vent)的不定芽组织培养诱导研究发现[23],不定芽起源于愈伤组织表层细胞或内部分生组织,两者可发育成芽原基。裸果木愈伤再生不定芽起源与啤酒花和辣椒发现的外起源类似,但研究中未发现组织内部出现芽原基,无内起源证据。因此,本研究认为裸果木愈伤再生不定芽为外起源方式。
本研究通过组织培养技术,成功建立了裸果木器官发生途径的高效再生体系,确定了再生不定芽为外起源及基本培养基和蔗糖浓度是影响裸果木生根的关键因素。本研究为裸果木这一珍稀濒危的林木种质资源保护及可持续利用奠定了研究基础,提供了有效应用途径。
