CD200在慢性淋巴细胞白血病相关疾病诊断中的价值
2022-07-15饶永彩
洪 俊,饶永彩
1.武汉大学人民医院检验科,湖北武汉 430060;2.武汉生物制品所,湖北武汉 430060
B细胞慢性淋巴细胞增生性疾病(B-CLPD)是由成熟B淋巴细胞引起的累及外周血、骨髓和继发性淋巴器官如淋巴结和脾脏的一大类疾病。世界卫生组织(WHO)根据这类疾病的组织病理学特征、免疫表型和遗传变异特征对其进行了分类[1-3]。慢性淋巴细胞性白血病(CLL)相关疾病是B-CLPD中最常见的一类,其特点为成熟形态的淋巴细胞在体内积聚,使血液和骨髓中淋巴细胞增多,进而引起淋巴结、肝、脾大,并可累及其他组织器官,CLL相关疾病主要包括CLL、单克隆B细胞淋巴细胞增多症(MBL)和小淋巴细胞淋巴瘤(SLL),现在一般认为CLL与SLL本质上是同一种疾病,因主要累及部位不同而造成了不同表现形式[3-4]。研究表明,免疫表型在CLL相关疾病的诊断中具有重要的参考价值,一般认为如果患者每微升血液出现超过5 000个具有独特免疫表型(即SmIg弱表达,CD5+CD19+、CD20弱表达和CD23+)的单克隆B细胞,即可诊断CLL相关疾病[4-7]。MATUTES等[7]根据细胞免疫表型抗原谱设计了Matutes免疫表型评分(MS)系统用于CLL相关疾病的诊断。在该评分系统中,根据5个标记的表达情况进行计分(CD5、CD23、FMC7、SmIg和CD79b阳性各记1分);大多数CLL相关疾病病例的得分为4或5分,而非CLL相关疾病病例的得分小于4分。目前,国际CLL工作组(IWCLL)、WHO和欧洲CLL研究倡议(ERIC)已更新了当前的CLL诊断标准[8-11]。大量研究表明,CD200可能是诊断B-CLPD特别是CLL相关疾病极为有用的标志物[12-15]。本研究的目的是验证CD200在CLL诊断中是否有用,并分析了添加CD200是否可以提高MS在CLL相关疾病诊断中的诊断效能。
1 资料与方法
1.1一般资料 收集2014年11月至2019年6月在武汉大学人民医院就诊及住院治疗的200例疑似B-CLPD患者的骨髓标本。纳入标准:淋巴细胞数量增多(>5×109/L)和/或发现轻链限制表达单克隆B细胞群;根据IWCLL和WHO指南确诊[2]。排除标准:合并其他肿瘤以及可能影响CD200表达水平的浆细胞疾病患者。在B-CLPD患者中,CLL相关疾病患者(CLL相关组)136例,占68%(136/200),包括CLL 108例、MBL 20例和SLL 8例;非CLL相关疾病患者(非CLL相关组)64例,占32%(64/200),包括边缘区淋巴瘤(MZL)32例、套细胞淋巴瘤(MCL)8例、滤泡性淋巴瘤(FL)2例,其他B-CLPD 22例。纳入研究的患者均对本研究知情同意,并自愿签署知情同意书。本研究经医院伦理委员会审批通过。
1.2仪器与试剂 主要检测仪器为BD Canto Ⅱ流式细胞仪,美国BD公司生产。所用检测试剂为BD公司原厂配套试剂。
1.3方法
1.3.1流式细胞术 流式检测样本处理方法参考文献[16]。流式细胞仪检测以下荧光标记单克隆抗体组合:CD8、CD19/CD3、CD56/CD4、κ/λ/CD/19、FMC7/CD5/CD19、CD79b/CD23/CD19、CD38/CD200/CD19、CD79b/CD20/CD10。用4色组合的单克隆抗体进行全骨髓染色(1×106个/100 μL)。在黑暗中孵育30 min后,细胞在5 min内用BD FACS裂解液裂解,并在磷酸盐缓冲液(PBS)中洗涤。随后,将细胞重悬于500 μL PBS中,并用美国BD Canto Ⅱ流式细胞仪对所有样本进行检测,数据分析采用FACS-Diva软件;检测前,用CST校准微球校准流式细胞仪的电压及增益。每个样品测定管至少取细胞数200 000个。
通过CD45和散射光侧向角(SSC)的特点将细胞分为淋巴细胞群、单核细胞群、粒细胞群、原始细胞群、前体细胞群及有核红细胞群。使用BD Paint-A-Gate软件(Becton Dickinson)对根据前向和侧向散射特征(FSC/SSC)控制的淋巴细胞群体进行了分析。选择CD19+细胞,并收集每种标志物阳性细胞的百分比。另外,CD200表达采用阳性细胞百分比和平均荧光强度比(MFIR)两种方式表示。根据B细胞群上荧光轴的对数刻度,评估CD200表达模式(弱、中或高):当阳性峰值在第1个对数百分位数之内时为弱表达,在>第1个对数百分位数至<第2个百分位数时为中等表达,而在第2个百分位数及以上的则为高表达[5]。
1.3.2MS MS的判定方法参考文献[7]。具体如下:当FMC7和CD79b阳性细胞群<30%时,被认为在CLL相关疾病的诊断中得1分;当CD5和CD23阳性细胞群为≥30%时,得分为1分;当SmIg表达较弱时,得分为1分。典型的CLL相关疾病的病例被定义为≥4分,非典型病例定义为<4分。在确诊非典型CLL相关疾病之前,应参考临床和/或细胞遗传学/分子生物学检查结果以排除白血病期的淋巴瘤。
为了研究CD200在CLL相关疾病中的诊断价值,根据以往研究,将CD200阳性细胞比例30%作为阳性判断的临界值:≥30%为阳性,<30%为阴性[17-18]。当CD200阳性细胞群≥30%时,被视为得1分。同时对采用MFIR判别CD200阳性的临界值进行评估。根据以往的研究[15],阳性阈值设置为18分,MFIR≥18分为阳性,MFIR<18分为阴性。
1.4统计学处理 使用SPSS22.0统计软件进行数据分析。对灵敏度、特异度和准确性进行分析。当CD200添加到MS时,总积分≥4分,考虑CLL相关疾病的诊断。以原MS为对照,采用McNemar检验评估采用CD200改进评分系统后与原MS系统间的差异。非正态分布的计量资料用M(P25,P75)表示,使用Whitney′sU检验进行组间比较。计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1CD200在B-CLPD中的表达 CD200在B-CLPD中的表达情况见表1。当CD200的表达情况以阳性细胞百分比表示时,CLL相关组的CD200表达水平高于非CLL相关组[99.4%(95.0%,100.0%)vs.70.1%(0.4%,99.9%),U=38,P<0.05],见图1A。所有CLL相关组患者的CD200阳性细胞百分比均高于30%;而在非CLL相关组中,CD200阳性细胞百分比呈高度异质性,例如MCL的百分比非常低,而其他B-CLPD的百分比较高。此外,1例MCL(1/8,12.5%),18例MZL(18/32,56.2%)和2例FL(2/2,100.0%)的CD200阳性细胞百分比超过30%。

表1 CD200在B-CLPD中的表达情况
当CD200表达强度以MFIR表示时,CLL相关组CD200表达水平同样高于非CLL组[51.4(4.2,121.0)vs.13.0(1.0,62.1),U=44,P<0.05],见图1A。CLL相关组136例患者中有121例(88.9%)表现出CD200高表达,非CLL相关组64例患者中有24例(37.5%)表现出CD200高表达。CD200细胞的MFIR通常在CLL病例中较高,在FL和MZL中为中等,而在MCL中则较低。在CLL组中,80例典型CLL(MS 4~5分)和28例非典型CLL病例(MS 0~3分)间比较,无论是以CD200阳性细胞百分比还是MFIR表示,CD200均为高表达,差异均无统计学意义(P>0.05),见图1B。
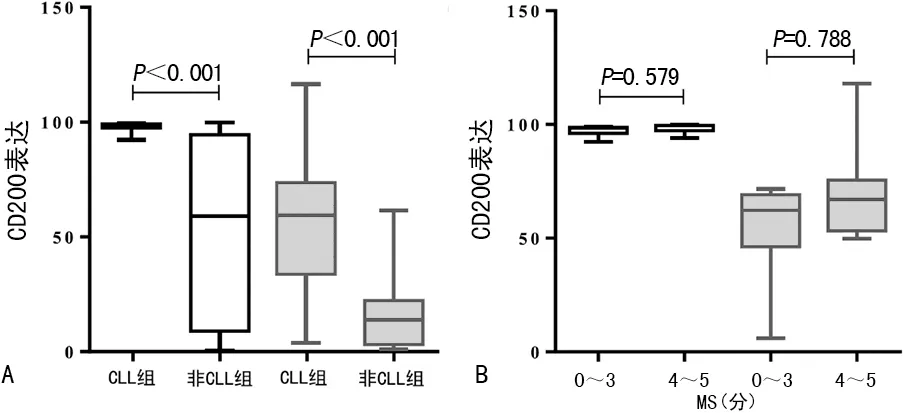
注:A为CLL相关组和非CLL相关组CD200表达水平的比较;B为MS 4~5分和MS 0~3分的CLL患者间CD200表达水平的比较;无填充颜色为以阳性细胞百分比表示的CD200表达水平,浅灰色表示以MFIR表示的CD200表达水平。
2.2CD200作为单个标志物用于CLL诊断的价值 为了研究CD200在区分CLL相关疾病和其他B-CLPD中的价值,对CD200的灵敏度、特异度和准确性进行了分析并与MS中的标志物进行了比较,见表2。CD200表达水平以阳性细胞百分比表示时,其灵敏度明显高于FMC7、CD79b和SmIg(χ2=6.51、6.12、6.78,P<0.05),与CD23和CD5相比差异均无统计学意义(χ2=0.21、0.32,P>0.05);其特异度为44.1%,明显低于其他标志物(FMC7、CD79b、CD23、CD5、SmIg,χ2=7.41、6.21、6.98、7.18、6.98,P<0.05);而其准确性明显高于SmIg(P<0.05),而与其他MS标志物相似(P>0.05)。对CD200表达水平的两种表示方式(阳性细胞百分比和MFIR)进行评估,结果表明二者在准确性方面相似(分别为81.1%和80.1%)而灵敏度方面MFIR较低(100.0%vs.77.9%,χ2=6.20,P<0.05),特异度方面MFIR更高(44.1%vs. 85.1%,χ2=8.20,P<0.05)。
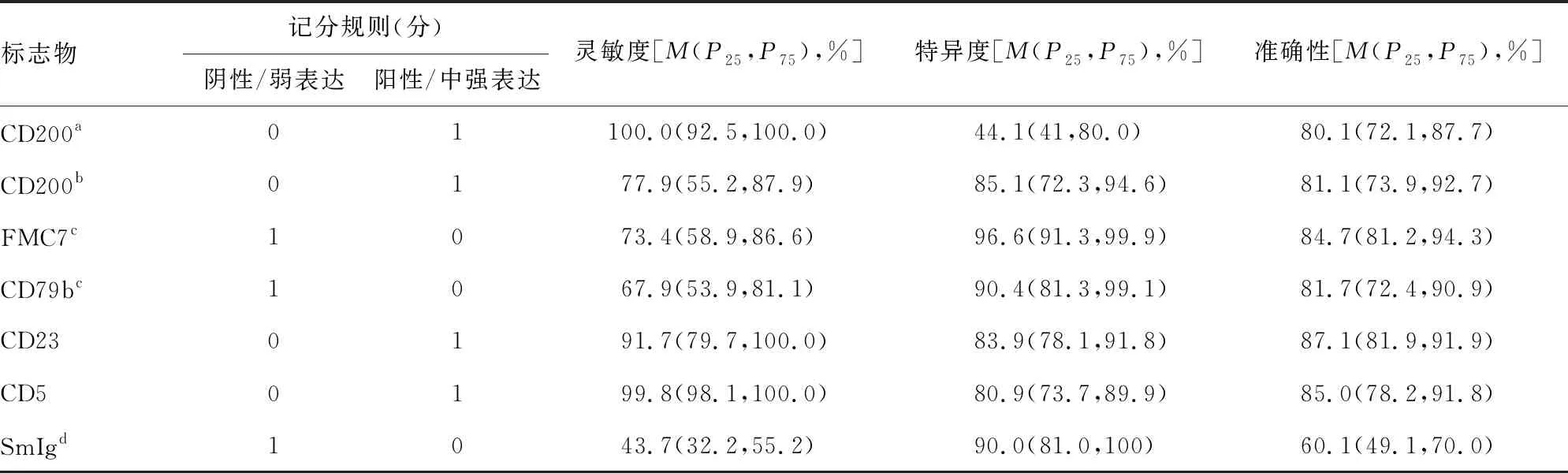
表2 单个标志物在CLL相关疾病与非CLL相关疾病鉴别诊断中的灵敏度、特异度和准确性
2.3将CD200加入MS中的实用价值 在本研究中,136例CLL病例中有108例表现出典型表型(MS≥4分),28例表现出非典型表型(MS<4分),见表3。所有非CLL相关患者均显示MS低于4分。在MS中添加CD200(以阳性细胞百分比表示表达水平)改变了19例患者的诊断:在CLL相关组,原MS诊断为非典型CLL相关疾病的28例患者中有16例从3分变为≥4分;在非CLL相关组,当添加CD200后,64例中有3例的MS变为4分。CD200的添加将MS的准确性从84.3%提高到94.7%(McNemar检验,P<0.01)。值得注意的是,MS中CD200替代SmIg后,准确性从84.3%提高到94.5%(McNemar检验,P<0.01),见表4。使用MFIR表示CD200的表达水平也显示了相似的准确性(数据未展示)。
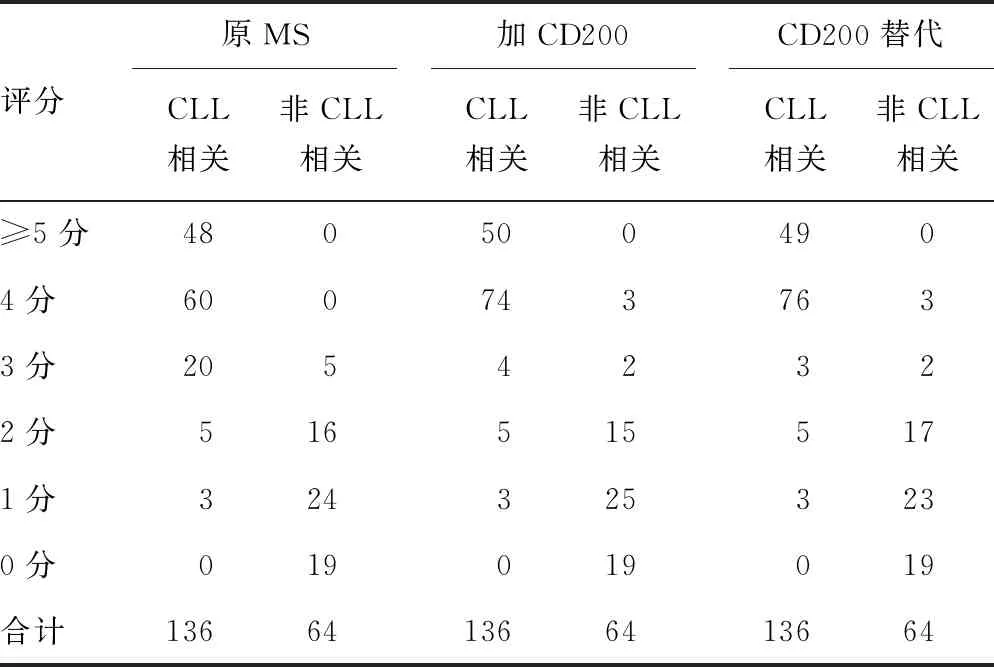
表3 按MS和改进替代评分对患者进行分类(n)
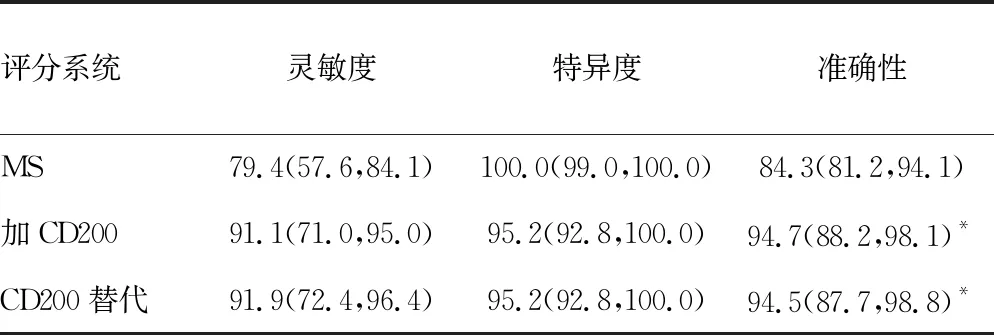
表4 几种评分系统在CLL相关与非CLL相关疾病鉴别诊断中的灵敏度、特异度和准确性[M(P25,P75),%]
3 讨 论
流式细胞仪免疫表型分析是诊断B淋巴细胞增生性疾病(包括CLL)不可或缺的技术[2,3,11]。有学者基于白血病细胞膜表面分化抗原CD5、CD23、FMC7、SmIg和CD22/CD79b的表达情况,建立了用于CLL诊断的MS系统,时至今日仍被认为是一种非常有效用的CLL诊断工具,并被众多临床实验室广泛使用[7-8]。国外研究发现了多种CLL肿瘤细胞表达的新免疫标志物[18-19]。其中,作为Ig受体膜蛋白超家族成员的CD200被认为对CLL诊断有较好的特异性[12-15]。本研究旨在探讨CD200在CLL诊断中的作用,以及该标志物是否能增加MS的诊断效能。
目前,多个研究从方法学角度证实了无论是以阳性细胞百分比还是以MFIR表示CD200的表达水平,其在几种淋巴增生性疾病中的表达水平都有差异[14,17]。此外,有部分学者认为使用MFIR来表示CD200表达水平有助于确保不同实验室之间检测的可重复性。本研究发现CD200的MFIR和阳性细胞百分比两种表达方式在区分不同类别的B-CPLD方面具有相同的准确性。此外,虽然MFIR在确保不同实验室之间的技术可重复性方面有部分优势,但由于MFIR存在换算环节,因此在常规临床实践中并不十分方便。
本研究中,所有CLL相关疾病病例(包括具有非典型表型的病例)CD200均为阳性表达,而且CLL相关疾病中的CD200表达水平明显高于其他B-CLPD;这与国外研究结论基本一致,这表明CD200具有作为CLL相关疾病表型标志物的潜在价值[12-13,17]。国外研究主要集中在CD200区分CLL和MCL的作用,而在这些研究中CD200在CLL中全部阳性,而在MCL中几乎不表达[20]。本研究中,发现有少数MCL病例的CD200可以呈现出与CLL相比较低水平的表达。此外,本研究还观察到在其他B-CLPD(非MCL)中CD200存在差异性表达。综上所述,笔者认为CD200强表达在CLL中很常见,但CD200可以在包括MZL和FL在内的B细胞肿瘤中呈现不同程度的差异性表达[21]。因此,仅靠CD200一个标志物是不能够完全区分不同B-CLPD的,但是如果将CD200加入MS系统中也许有改善MS对CLL相关疾病诊断准确性的可能;当前相关研究极少[13]。本研究对这个问题进行了探讨,结果表明加入CD200能有效提高MS在CLL诊断中的准确性。此外,本研究还表明,在MS中直接加入CD200或用CD200代替SmIg作为诊断标志物都能起到类似的作用,且二者效果无差别。这是可能与SmIg的表达水平难以评估,而且在B-CLPD中的表达存在高度差异性有关[18]。
总之,CD200是CLL相关疾病诊断中有价值的标志物,尽管特异性不强,但结合MS使用可明显提高CLL相关疾病诊断的准确性。此外,CD200在疑似CLL相关疾病病例中可能是有用的诊断标记,特别是在CLL相关疾病与MCL的鉴别诊断中。
