脐带血冷冻前、小管复苏及大袋复苏后造血功能的比较
2022-04-01吴洁莹陈劲松吴韶清汤雪薇
吴洁莹 陈劲松 吴韶清 陆 琰 汤雪薇 李 焱
广州医科大学附属广州市妇女儿童医疗中心广州脐血库(广州 510623)
作为除骨髓和外周血干细胞外的另一移植供体来源,以实物形式置于液氮中长期冻存的脐带血,具有采集方便、来源广泛、可根据患者需求随时解冻回输等优势。但是,与“新鲜”样本不同,冷冻和复苏时细胞外环境的变化会导致细胞活性降低;随着冻存时间的延长,细胞的造血功能也会受到影响[1- 3]。根据现行的全球先进输血和细胞治疗联盟(Advancing Transfusion and Cellular Therapies Worldwide,AABB)细胞治疗服务标准(第9 版)的规定,脐血产品至少需要两个完整的附属血辫与产品一起冷冻保存,用于造血重建的产品在附属连接段取样检测集落形成单位和(或)CD34 阳性细胞(直接测量)[4]。每份脐带血产品体积有限、细胞珍贵,可供检测的样本通常仅数百微升。本文拟探讨从冷冻袋附属小管取样,是否可用于脐带血产品的质量控制及脐带血移植供体发放前复核。
1 材料与方法
1.1 一般资料
本研究选取2009年3月—2021年2月在广州脐血库保存的53份脐带血样本(包括主袋和附属小管)为研究对象,分别于2014年6月—2021年3月冷冻复苏。根据取材部位和检测时间,分为冷冻前、小管复苏和大袋复苏组。
1.2 主要试剂与仪器
IMDM培养基购自美国Gibco公司,胎牛血清购自美国Gibco公司, DNA酶购自美国Promega公司,台盼蓝溶液购自Sigma公司,甲基纤维素半固体培养基购自加拿大Stemcell公司,流式抗体:CD45-异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)、CD34-藻红蛋白(phycoerythrin, PE)、免疫球蛋白(IgG)-PE、7-氨基放线菌素D(7-aminoactinomycin D, 7-AAD)及溶血素购自美国BD公司。 生物洁净工作台购自苏州苏静安泰空气技术有限公司,型号:BCM-1600A;低温高速离心机购自美国IEC公司,型号:GP8R;流式细胞仪购自美国BD公司,型号:BD FACS Canto Ⅱ;血细胞分析仪购自美国贝克曼库尔特公司,型号:Ac.T diff2;恒温水浴箱购自美国Coring公司,型号LSE waterbath 6L;旋涡震荡仪购自美国IKA公司,型号:LAB Dancer S25;医用冷藏箱购自海信(北京)电器有限公司,型号:BCD-196TA;CO2培养箱购自德国Labotect公司,型号:C200;倒置显微镜购自日本Olympus及Nikon公司,型号:CHK及TE300。
1.3 方法
1.3.1 样本复温 将脐血自液氮液相中移至气相,放置5 min。打开铝夹,取出脐血冷冻袋的附属血辫,避免弯折。将附属血辫浸入恒温水浴箱,温度设置在37 ℃~42 ℃,轻轻晃动小管,数秒后取出,快速完成复温。用无菌注射器抽取100 μL样本用于有核细胞计数、活率检测,其余样本约400~500 μL转移至15 mL无菌离心管,缓慢加入预冷的含2%胎牛血清(fetal bovine serum,FBS)和10 U/mL DNase的IMDM(Iscove’s Modified Dulbecco’s Media) 培养基5 mL,轻轻摇动离心管。置10 ℃条件下,1 500 r/min、离心10 min。重悬细胞沉淀,再次洗涤离心。加入IMDM培养基重悬细胞,用于CD34阳性细胞检测和干/祖细胞集落培养。大袋复苏与小管复温步骤基本相同,置水浴箱中2 min内完成复温。
1.3.2 样本检测 有核细胞计数:采用全自动血细胞分析仪进行检测。读取屏幕上显示的白细胞(white blood cell, WBC)数值,细胞总数=WBC×脐血体积。细胞活率检测:采用0.4%台盼蓝染色检测活细胞数量,计数100个有核细胞,被染色的为死细胞,未染色的为活细胞,根据台盼蓝拒染率,计算活细胞比例。CD34阳性细胞计数:标记流式管,设同型对照,将制备好的细胞悬液各50 μL分别加入对照管及实验管,对照管加入10 μL CD45-FITC及10 μL IgG-PE荧光抗体,实验管加入10 μL CD45-FITC及10 μL CD34-PE荧光抗体,避光孵育20 min。各管分别加入5 μL 7-AAD,继续孵育5 min。再加入溶血素2 mL,室温避光孵育10 min。于1 500 r/min离心5 min,弃上清,再加入2 mL磷酸缓冲盐溶液,于1 500 r/min离心5 min,弃上清,再以300 μL磷酸缓冲盐溶液重悬细胞沉淀,上机检测。分析结果得到CD34阳性细胞占CD45阳性有核细胞的百分比,再根据复温后脐血的细胞总数,计算出每份脐血中的CD34阳性细胞的数量。造血祖细胞集落分析:采用MethodCult®GF H4434半固体甲基纤维素培养基,以105细胞/mL的密度接种于12孔板中,每孔终体积1 mL,每标本设双复孔。置37 ℃、5% CO2饱和湿度下培养14~16 天。倒置显微镜下观察粒-巨噬细胞集落形成单位(colony-forming units-granulocyte/macrophage, CFU-GMs)、爆式红细胞集落形成单位(burst-forming unit-erythroid, BFU-E)和粒细胞-红细胞-巨噬细胞-巨核细胞集落形成单位(colony-forming unit-granulocyte/erythrocyte/macrophage/mega-karyocyte, CFU-GEMM),分别计数每105细胞中的各系集落数量,求和得到祖细胞集落形成单位总数(colony-forming unit, CFUs),再根据复苏脐血的细胞总数,计算出每份脐血中的集落数量。
1.4 观察指标
选择两种方法制备的样本在冷冻前后的总有核细胞数(total nucleated cells,TNCs)、细胞活率、CD34阳性细胞活率、CD34阳性细胞数量、CFU-GMs及CFUs数量为观察比较的指标,细胞活率的计算公式如下:
TNCs细胞活率(%)=[活细胞总数/(活细胞总数+死细胞总数)]×100%
CD34阳性细胞活率(%)=(7-AAD阴性/CD34阳性细胞数)/[(7-AAD阴性/CD34阳性细胞数)+(7-AAD阳性/CD34阳性细胞数)]×100%[5]
1.5 统计学方法
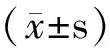
2 结 果
2.1 脐血复苏后(小管)和冷冻前的各项参数的比较
复苏后(小管)的总有核细胞数、细胞活率、CFU-GMs及CFUs数量较冷冻前均有所降低,差异有统计学意义(P<0.001,P<0.001,P=0.039,P=0.019),而二者的CD34阳性细胞数基本相似,差异无统计学意义(P=0.821),见表1。
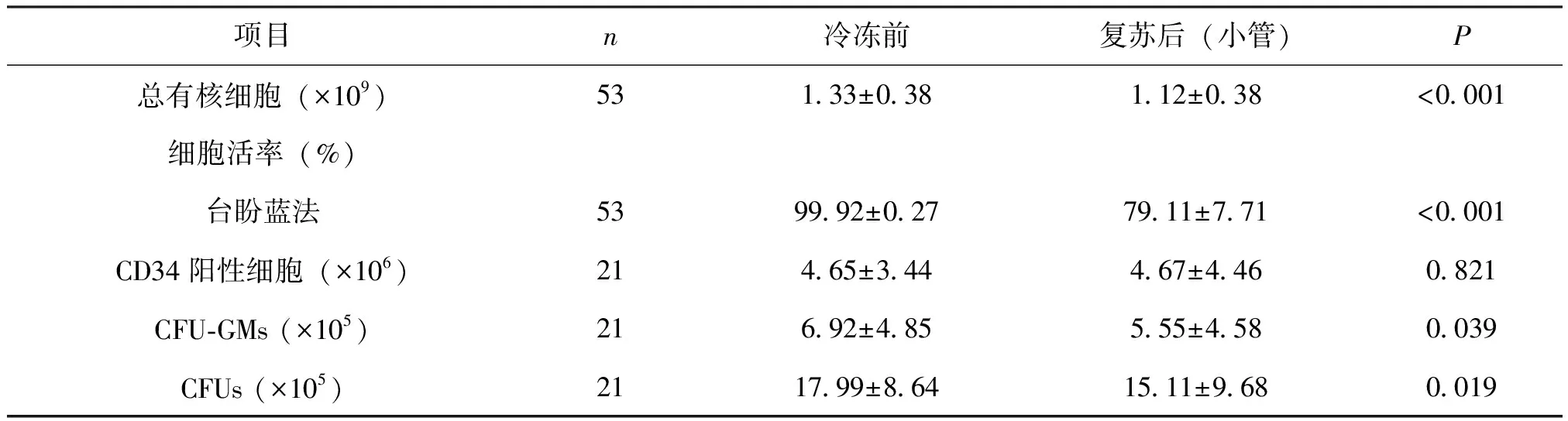
表1 脐血复苏后(小管)和冷冻前的各项参数的比较
2.2 脐血复苏后(大袋)和冷冻前的各项参数的比较
复苏后(大袋)的总有核细胞数、细胞活率较冷冻前均有所降低、CFUs数量略高于冷冻前,差异有统计学意义(P<0.001,P<0.001,P=0.013),而二者的CD34阳性细胞数及CFU-GMs基本相似,差异无统计学意义(P=0.646,P=0.136),见表2。
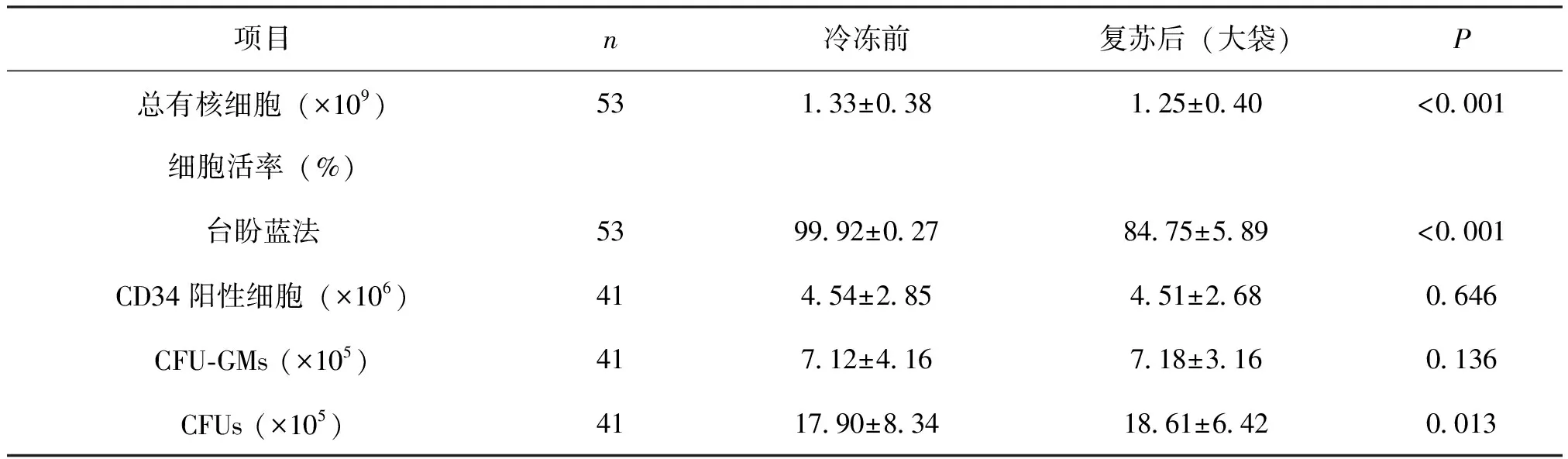
表2 脐血复苏后(大袋)和冷冻前的各项参数的比较
2.3 脐血复苏后(小管)和复苏后(大袋)的各项参数的比较
复苏后(小管)的总有核细胞数、细胞活率、CD34阳性细胞活率、CFU-GMs及CFUs数量较复苏后(大袋)均有所降低,差异有统计学意义(P<0.001,P<0.001,P<0.001,P=0.003,P=0.002),而二者的CD34阳性细胞数基本相似,差异无统计学意义(P=0.245),见表3。
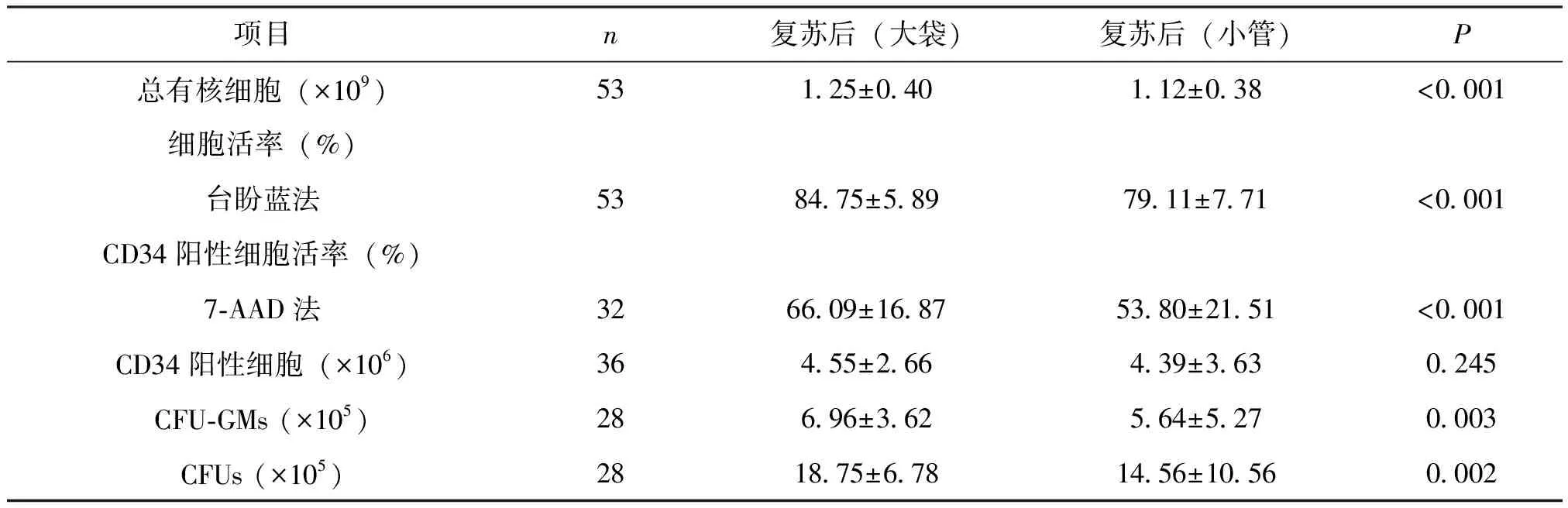
表3 脐血复苏后(小管)和复苏后(大袋)的各项参数的比较
2.4 脐血复苏后(小管)和复苏后(大袋)的各项参数的相关性分析
复苏后(小管)的总有核细胞数、细胞活率、CD34阳性细胞活率、CD34阳性细胞数、CFU-GMs及CFUs数量与复苏后(大袋)的各相应参数均具有高度相关性(P<0.001),见表4。复苏后小管和复苏后大袋的TNCs、CD34阳性细胞数、CFU-GMs和CFUs的相关性曲线见图1。

表4 脐血复苏后(小管)和复苏后(大袋)的 各项参数的相关系数
3 讨 论
随着深低温冷冻技术的发展和临床脐血移植的广泛开展,世界各地纷纷建立公共和自体脐带血库。据美国国家骨髓捐献者计划的统计数据,全球已有约54家机构可提供超过802 000份脐带血,完成超过50 000例脐带血移植[6- 7]。脐血的平均使用率不到10%,随着时间的推移,越来越多的脐血将处于长期冻存状态,面临着细胞活力丢失、环境温度失控、人为操作失误等风险。因此,脐血库应建立严格完善的质控体系,定期评估脐带血的质量和性能,及时发现并清除不合格产品。
含有脐带血终产品的冷冻袋在封口前保留一段附属连接小管,通过热合机隔断为数段,可作为长期冻存脐带血的质控样本。小管与大袋连接,一同存放于铝夹内,避免了样本混淆。
本脐血库从2009年起对入库的样本保留了与血袋相连的备份小管。本研究选取2009年3月—2021年2月在广州脐血库冻存的53份脐带血样本为研究对象,分为冷冻前、小管复苏和大袋复苏三组。临床实践表明,脐血输注剂量与植入及造血重建速度密切相关,而无论是冷冻前还是复温后的CD34阳性细胞数量、CFUs数量比TNCs与移植效果的相关性更为密切[8-10],因此,我们评价了各组样本的TNCs、细胞活率、CD34阳性细胞数量、CFU-GMs、CFUs等质量参数。结果显示,小管复苏后TNCs数量、细胞活率、CFU-GMs数量及CFUs数量均低于冷冻前,而二者的CD34阳性细胞数量相当;大袋复苏后TNCs数量、细胞活率亦低于冷冻前, CFUs数量略高于冷冻前,但 CD34阳性细胞数量及CFU-GMs数量相当;小管复苏后的TNCs数量、细胞活率、CD34阳性细胞活率、CFU-GMs数量及CFUs数量均低于大袋复苏后,而二者的CD34阳性细胞数量相当。同时,小管复苏与大袋复苏后的TNCs数量、细胞活率、CD34阳性细胞活率、CD34阳性细胞数量、CFU-GMs数量及CFUs数量均存在高度相关性。
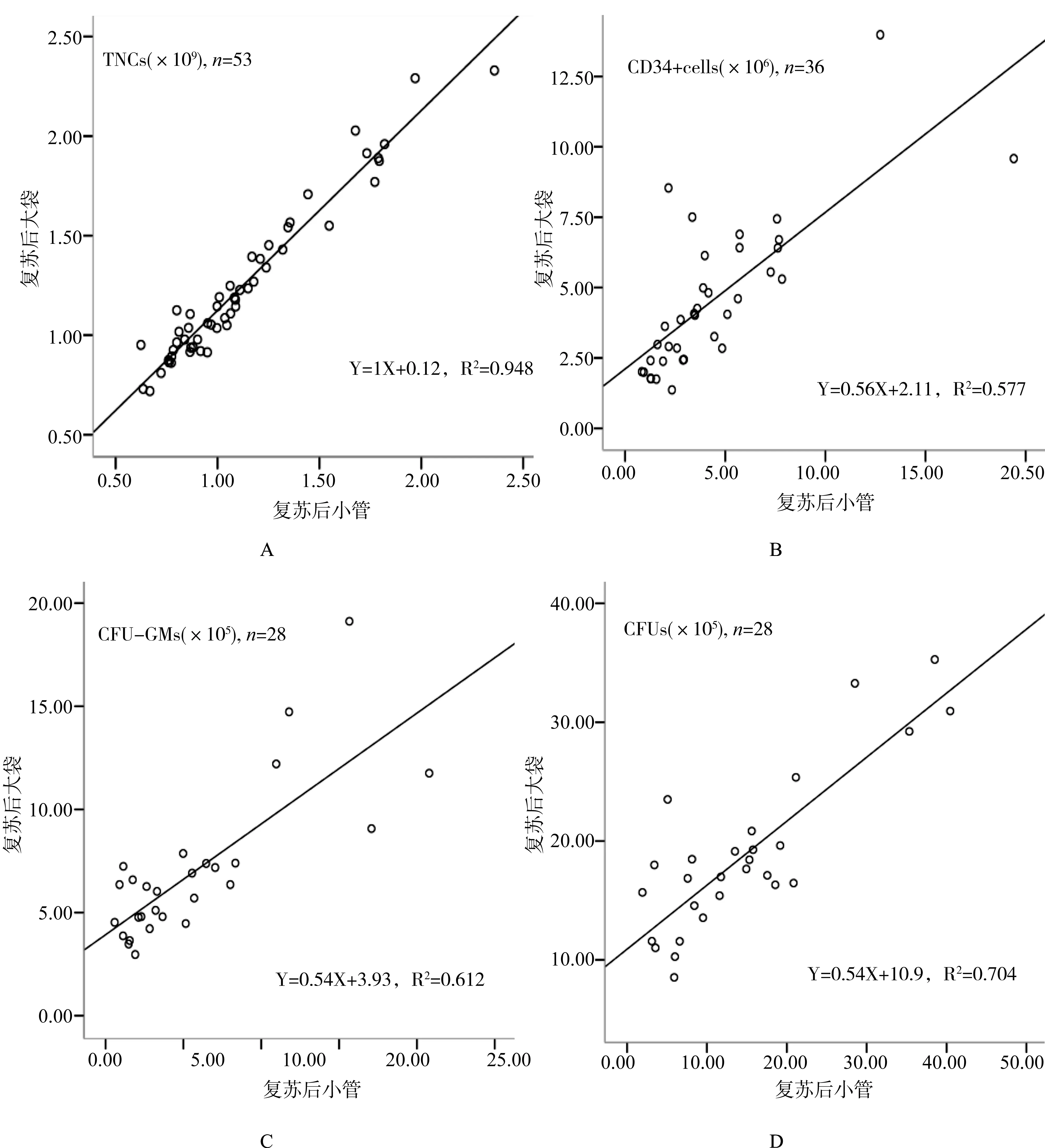
图1 脐血复苏后小管和复苏后大袋的TNCs、CD34阳性细胞数、CFU-GMs和CFUs的相关性曲线注:A:复苏后小管和大袋的TNCs相关分析曲线(n=53, Y=1X+0.12, R2=0.948) B:复苏后小管和大袋的CD34阳性细胞数相关分析曲线(n=36, Y=0.56X+2.11, R2=0.577) C:复苏后小管和大袋的CFU-GMs相关分析曲线(n=28, Y=0.54X+3.93, R2=0.612) D:复苏后小管和大袋的CFUs相关分析曲线(n=28,Y=0.54X+10.9, R2=0.704)
理论上,小管与大袋共同经历了脐血制备、程序降温到长期冻存的全过程,其复苏后的检测指标应接近,但文献报道的结果却不尽相同[11-17]。van Haute等[13]发现,附属小管的CD34阳性细胞比大袋高15%,而同时备份的0.5 mL冻存管中的CD34阳性细胞数与大袋接近,他们认为除附属小管外,脐血库应保留更多的冻存管备份样本,并提供给移植中心自行检测,以获得更为准确的输注剂量。Lee[15]等发现,附属小管的活率、CD34阳性细胞、CFU-GM和CFUs 均高于大袋,推测可能是小管的管径厚度均匀,有利于细胞活性的维持。他们发现小管和大袋的各相应指标之间存在高度相关性,认为小管的检测结果可以代表大袋中脐血的质量,并可通过回归方程推算大袋的细胞数量,供临床移植参考。但Faivre[16]等发现,复苏后小管的细胞活率低于大袋,认为可能是二者的体积和容量不同,造成冷冻时温度差异,导致细胞活力受损;小管的检测结果不能预测大袋中脐血质量的好坏,甚至可能导致合格的脐血被召回,使患者失去治疗的机会。他们建议应更加关注冷冻前数据,并强调脐血库应该接受权威机构认证,保证脐血制备和冻存的质量。Galindo[17]等发现,复苏后近端和远端小管的细胞活率和集落增殖效率与大袋接近,但中段小管低于大袋,推测可能是由于中段小管在冷冻过程中接触到大袋表面不规则突起(如接口处或凹痕)导致活率降低。本研究发现,低温冻存和复苏过程会降低脐带血的TNCs及细胞活率,但CD34阳性细胞数量相当,各观察指标间均存在高度相关性,因此,附属小管可作为脐血库质量控制和样本发放前复核的取材。
本研究的脐血均为内部质控样本,所有检测在本实验室完成。我们未将移植供体纳入分组,是考虑到脐血已发往临床,只能在当地实验室检测,存在取样和操作误差,但也导致本研究缺乏临床数据。另外,总体例数偏少,各组间样本数不平衡(主要是部分样本取样量不足,无法检测)是本研究的另一局限。值得注意的是,虽然各组的CD34阳性细胞数量相当,但造血集落的生长却存在差异,复苏后大袋略高于冷冻前,而复苏后小管又低于冷冻前和复苏后大袋,表明CD34阳性细胞数量的多少并不意味着造血功能是否完好,这也从Morgenstern等[18]和Brand等[19]的报道中得到证实。
总之,脐带血作为一种既可长期冻存,又能随时回输的干细胞治疗产品,其产品质量应备受关注。脐血库应依照国内外最新行业标准,不断修订和完善质量控制体系,细化脐血处理、冻存、复温等关键步骤的操作规程,确保临床移植用血的安全。
