含三氟甲基吡啶结构的氮杂环化合物的合成及杀线虫活性研究
2022-07-14马小云杨香奉
马小云,刘 丹,杨香奉
(1. 贵州师范学院化学与材料学院,贵州 贵阳 550018;2. 贵州大学精细化工研究开发中心,贵州 贵阳 550025)
0 引言
植物病原线虫是造成植物病虫害的主要病原体之一,每年植物线虫病对农业生产造成的经济损失高达上千亿美元[1-2]。线虫以线虫口针刺入植物根皮吸取植物营养,分泌生物化学毒素影响植物正常生长,同时也使植物易被真菌、细菌等微生物浸染,最终导致植物病虫害的发生[3]。为了防治线虫的危害,大量杀线虫剂被开发出来并用于农业生产[4-6]。最早的杀线虫剂大都由杀虫剂、杀菌剂及复合生物菌扩大应用而来。目前市场上主要的杀线虫剂为高毒有机磷和氨基甲酸酯类杀线虫剂,如棉隆、灭线磷、苯线磷、涕灭威、杀线威、噻唑磷等[1](见图1),长期使用这些高毒化学农药,导致其防治效果较差,且对环境产生严重的污染。植物线虫病害种类多、危害极为严重,可供选择的高效、低毒杀线虫剂极少,新型、高效杀线虫剂的开发显得尤为迫切。
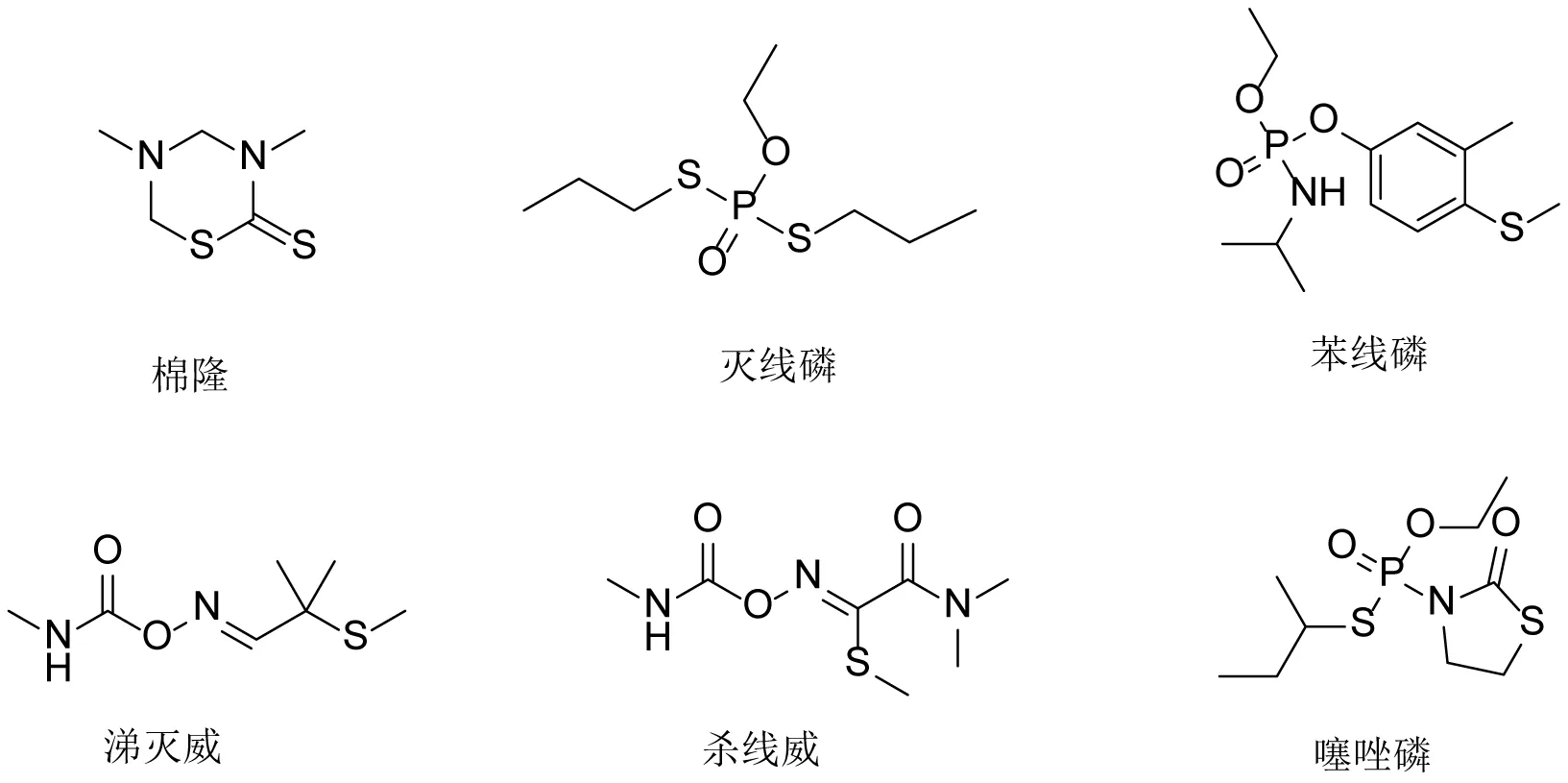
图1 部分杀线虫剂的化学结构
含氮杂环化合物具有广泛的生物活性,在杀线虫剂、杀菌剂、杀虫剂等诸多方面均有广泛的应用,已成为当今新农药开发的热点[7]。三氟甲基吡啶是一类重要的含氟杂环结构,也是当前商品化农药中的常见基团[8-11],在已登记的农药中,含三氟甲基吡啶结构的农药有几十个[12]。为了寻找活性优良的新型杀线虫先导化合物,将三氟甲基吡啶结构引入含氮杂环,希望通过活性亚结构拼接的方法,得到高杀线虫活性的先导化合物。
1 实验部分
1.1 仪器与试剂
仪器:Bruker Avance 600型核磁共振分析仪(瑞士布鲁克公司);WRX-4型数字显示显微熔点仪(上海易测仪器设备有限公司);DF-101S恒温磁力搅拌器(上海予华仪器设备有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);BZF-50真空干燥箱(上海云泰仪器有限公司);101-3A电热鼓风干燥箱(北京心雨仪器仪表有限公司)。
试剂:5-三氟甲基-2-溴吡啶、吡咯、咪唑、吡唑、吲哚、咔唑、碘化亚铜、L-脯氨酸、碳酸钾、二甲基亚砜、乙酸乙酯、石油醚、无水硫酸钠、次氯酸钠溶液、N,N-二甲基甲酰胺,以上试剂的纯度均为分析纯。
1.2 合成路线
含三氟甲基吡啶结构的氮杂环化合物的合成路线如图2所示:
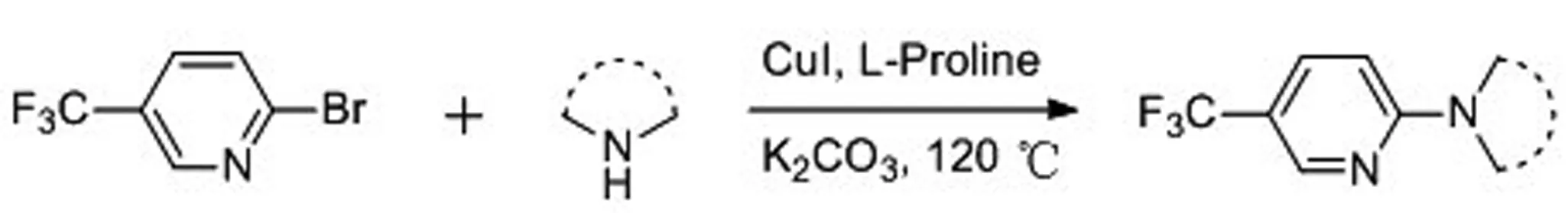
图2 目标化合物的合成路线图
1.3 化合物的合成
合成方法:50 mL圆底烧瓶中,加入5-三氟甲基-2-溴吡啶0.904 g(4 mmol),含氮杂环(4 mmol),碳酸钾0.828 g(6 mmol),L-脯氨酸46 mg(1.6 mmol),碘化亚铜76 mg(0.4 mmol),二甲基亚砜15 mL。然后,在氮气保护下于120 ℃恒温油浴锅中搅拌反应12 h。停止反应,待反应液冷却后加入20 mL水和20 mL乙酸乙酯,充分搅拌后收集有机层,水层再用20 mL乙酸乙酯萃取,合并有机层。用10 mL水洗涤有机层,有机层经无水硫酸钠干燥,过滤,浓缩滤液得粗产品,所得粗产品经柱层析分离得目标产物。
5-三氟甲基-2-(1H-吡咯-1-基)吡啶(1)的合成:白色固体,产率75%。熔程为116.8~117.9 ℃,比移值为0.43 (石油醚∶乙酸乙酯 = 40∶1)。1H NMR (600 MHz,DMSO-d6)δ:8.82 (s,1H),8.31 (dd,J= 8.4,2.4 Hz,1H),7.94 (d,J= 9.0 Hz,1H),7.78(t,J= 2.4 Hz,2H),6.37 (t,J= 2.4 Hz,2H)。
5-三氟甲基-2-(1H-咪唑-1-基)吡啶(2)的合成:白色固体,产率81%。熔程为97.1~97.9 ℃,比移值为0.27 (石油醚∶乙酸乙酯 = 1∶1)。1H NMR (600 MHz,DMSO-d6)δ:8.91 (d,J= 0.6 Hz,1H),8.66 (s,1H),8.45 (dd,J= 8.4,2.4 Hz,1H),8.08~8.06 (m,2H),7.18 (s,1H)。
5-三氟甲基-2-(1H-吡唑-1-基)吡啶(3)的合成:白色固体,产率71%。熔程为65.2~66.1 ℃,比移值为0.30 (石油醚∶乙酸乙酯 = 40∶1)。1H NMR (600 MHz,DMSO-d6)δ:8.88 (t,J= 0.6 Hz,1H),8.68 (d,J= 3.0 Hz,1H),8.38 (dd,J= 8.4,2.4 Hz,1H),8.10 (d,J= 9.0 Hz,1H),7.93 (d,J= 1.2 Hz,1H),6.65~6.66 (m,1H)。
5-三氟甲基-2-(1H-吲哚-1-基) 吡啶(4)的合成:白色固体,产率68%。熔程为93.1~94.2 ℃,比移值为0.39(石油醚∶乙酸乙酯 = 40∶1)。1H NMR (600 MHz,DMSO-d6)δ:8.94 (s,1H),8.56 (d,J= 8.4 Hz,1H),8.33 (dd,J= 9.0,2.4 Hz,1H),8.15 (d,J= 3.6 Hz,1H),7.99 (d,J= 9.0 Hz,1H),7.66 (d,J= 7.8 Hz,1H),7.36~7.27 (m,1H),7.27~7.18 (m,1H),6.84 (d,J= 3.6 Hz,1H)。
5-三氟甲基-2-(9H-咔唑-9-基) 吡啶(5)的合成:白色固体,产率66%。熔程为126.1~127.1 ℃,比移值为0.36(石油醚∶乙酸乙酯=40∶1)。1H NMR (600 MHz,DMSO-d6)δ:9.12 (m,1H),8.45 (dd,J= 8.4,2.4 Hz,1H),8.26 (d,J= 7.8 Hz,2H),8.03 (d,J= 8.4 Hz,1H),7.97 (d,J= 8.4 Hz,2H),7.56~7.46 (m,2H),7.41~7.34 (m,2H)。
1.4 生物活性的测定
1.4.1 南方根结线虫悬浮液的制备
(1) 将感染南方根结线虫的番茄植株连根拔起,轻轻抖落根上的泥土,用缓慢的流水洗净。
(2) 用小镊子将卵囊从根上分离出来,卵囊收集于小烧杯或培养皿中,之后卵囊用0.5%的次氯酸钠溶液消毒1 min,然后取出,用无菌水冲洗5~6次,最后在小烧杯或者培养皿中加入适量无菌水,放于28 ℃生化培养箱内黑暗条件下孵化2~4 d。
(3) 将孵化出的二龄幼虫转移到5 mL的离心管中2100 rpm/min离心2 min,弃其上清液得到二龄幼虫, 配制成所需线虫悬浮液备用。
1.4.2 松材线虫及水稻干尖线虫悬浮液的制备
将松材线虫或水稻干尖线虫饲养在长满灰葡萄孢的马铃薯琼脂培养基中,待繁育至7 d左右,用灭菌水将线虫洗出,去除菌丝,配制成所需线虫悬浮液备用。
1.4.3 离体杀线虫生物测定
采用触杀法测定所有目标化合物对南方根结线虫、松材线虫和水稻干尖线虫的离体杀线虫活性[13-15]。目标化合物溶于少量N,N-二甲基甲酰胺,用1%的Triton-80水溶液稀释,使最终药液浓度为200 μg/mL和50 μg/mL。以噻唑磷和Tioxazafen作为阳性对照,未加药剂组为阴性对照。其中南方根结线虫以二龄幼虫为被试对象,水稻干尖线虫及松材线虫以混合龄期线虫为被试对象。然后将10 μL线虫悬浮液(约50条线虫)加入48孔板中,加入200 μL目标化合物处理。试验温度为25 ℃± 2℃。在72 h评估线虫的死亡数(当线虫身体呈直线型或用针触碰后仍然不动的判断为死亡)。校正死亡率通过Schneider- Orellis公式得到:
死亡率=处理组死亡线虫数/处理组试虫数×100%;
矫正死亡率=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100%。
2 结果与讨论
2.1 化合物合成的反应条件优化
通过文献检索,选择经典的“碘化亚铜/磷酸钾/N,N'-二甲基乙二胺/1,4-二氧六环”反应体系用于5-三氟甲基-2-溴吡啶与吡咯的C-N偶联反应,反应式如图3所示。反应液回流反应12 h 后,产物分离产率只有16%(序号1,表1)。由于反应产率低,对该偶联反应的反应条件进行了优化探索。如表1所示,依次将磷酸钾换成碳酸钠、碳酸钾和氢氧化钠,产品产率没有明显提高,使用碳酸钾时产率相对较高(46%)(序号3,表1)。考虑到溶剂、温度对反应产率也有影响,在上述反应(序号3,表1)的基础上将溶剂1,4-二氧六环更换为二甲基亚砜,并将反应温度提高到120 ℃,但反应产率没有提高,还略有下降(序号5,表1)。将配体N,N'-二甲基乙二胺也更换为L-脯氨酸后,反应产率明显提高,产品分离产率可达75%(序号6,表1)。在此反应条件的基础上,将所用碳酸钾依次换成氢氧化钠、碳酸钠和磷酸钾,5-三氟甲基-2-溴吡啶与吡咯也能高效的发生C-N偶联反应(序号7~9,表1)。通过薄层色谱法检测可知,所用碱的碱性越强,反应越易进行,氢氧化钠、碳酸钾及磷酸钾为碱时原料5-三氟甲基-2-溴吡啶的转化率能达到100%。反应液后续处理的过程中,碱的种类对萃取影响较大,如使用氢氧化钠为碱,萃取液长时间不分层,抽滤滤除萃取液的固体杂质后,仍不易分层。因此,结合反应转化率及后续处理难度,碳酸钾是最适合该偶联反应的碱。
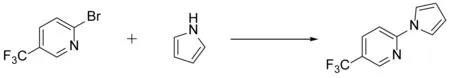
图3 5-三氟甲基-2-(1H-吡咯-1-基)吡啶的合成
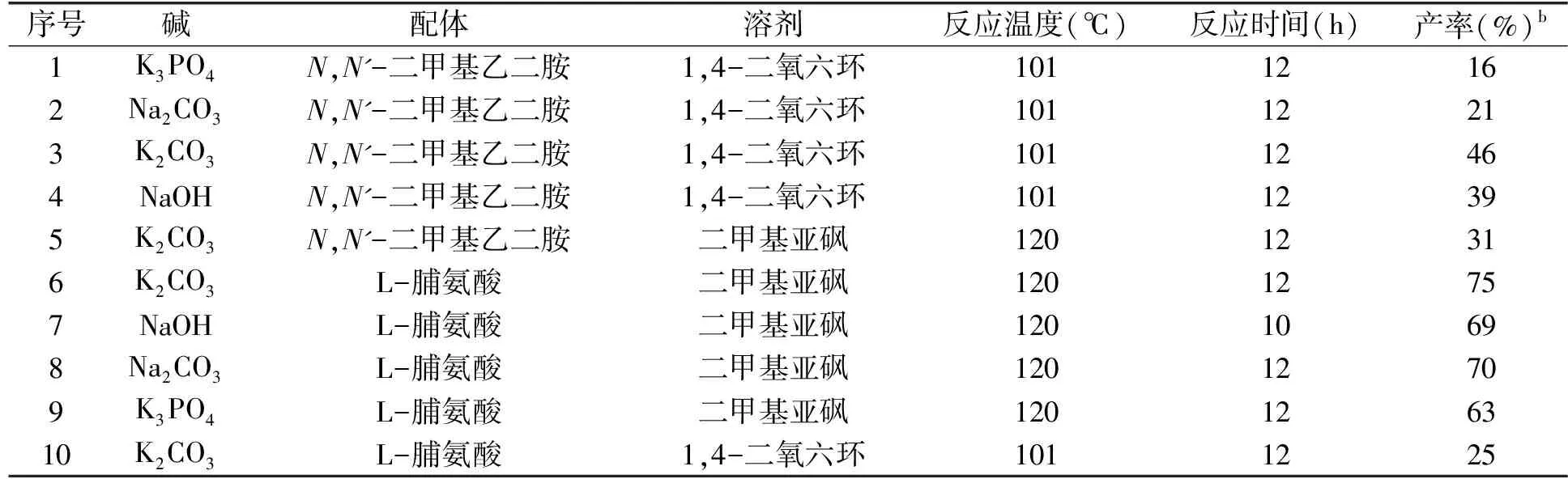
表1 反应条件的优化a
通过上述实验结果可以看出,配体对反应影响较大。通过薄层色谱法发现N,N'-二甲基乙二胺为配体、1,4-二氧六环为溶剂时,除了生成目标产物外,还有一个Rf值比产物小的副产物生成(序号1-4,表1)。推测该副产物由配体N,N'-二甲基乙二胺与5-三氟甲基-2-溴吡啶发生芳香亲核取代反应生成,三氟甲基的强吸电子效应,使得吡啶环上的溴易被亲核试剂N,N'-二甲基乙二胺取代。将溶剂换成二甲基亚砜之后,薄层色谱法检测显示也得到上述Rf值的副产物(序号5,表1),将配体换成L-脯氨酸后,则没有该副产物生成(序号10,表1)。因此,该副产物的产生与溶剂无关,而与配体有关。N,N'-二甲基乙二胺为配体时反应副产物较多,L-脯氨酸为配体时反应副产物却很少,其原因可能是L-脯氨酸的亲核能力弱,不会与5-三氟甲基-2-溴吡啶发生芳香亲核取代反应。综上所述,5-三氟甲基-2-溴吡啶与吡咯反应的最优条件为:碘化亚铜为催化剂,碳酸钾为碱,L-脯氨酸为配体,二甲基亚砜为溶剂,反应温度为120 ℃。该反应条件同样适用于 5-三氟甲基-2-溴吡啶与其它含氮杂环的C-N偶联反应。
2.2 目标化合物对线虫的活性测定
以南方根结线虫、松材线虫和水稻干尖线虫为测试对象,Tioxazafen和噻唑磷为阳性对照物,采用触杀法测定目标化合物对南方根结线虫(松材线虫或水稻干尖线虫)的杀虫活性,测试结果如表2所示,目标化合物的质量浓度为50 μg/mL时没有杀线虫活性。目标化合物的质量浓度为200 μg/mL时,5个化合物对三种线虫都表现出一定的杀线虫活性,在这些化合物中,5-三氟甲基-2-(1H-咪唑-1-基)吡啶对水稻干尖线虫表现出较好的杀线虫活性,优于阳性对照噻唑磷(36.4%),略低于Tioxazafen(64.4%)。这些目标化合物在浓度为200 μg/mL时表现出杀线虫活性可能与三氟甲基吡啶结构有关。如表2所示,咪唑在两种浓度下,对三种线虫的抑制率都为0,而咪唑连上5-三氟甲基吡啶结构后却表现出较好的杀线虫活性。5-三氟甲基-2-(1H-咪唑-1-基)吡啶表现出较好的活性,除了与三氟甲基吡啶结构有关外,其较好的水溶性可能也利于其杀虫。在杀线虫实验的过程中,发现5-三氟甲基-2-(1H-咪唑-1-基)吡啶的溶解性较好,其它化合物特别是5-三氟甲基-2-(1H-吡唑-1-基)吡啶和5-三氟甲基-2-(1H-吲哚-1-基) 吡啶的溶解性较差,在测试的过程中有少量固体析出。因此,5-三氟甲基-2-(1H-咪唑-1-基)吡啶对线虫的抑制活性可能与三氟甲基吡啶结构及咪唑结构都有关系。
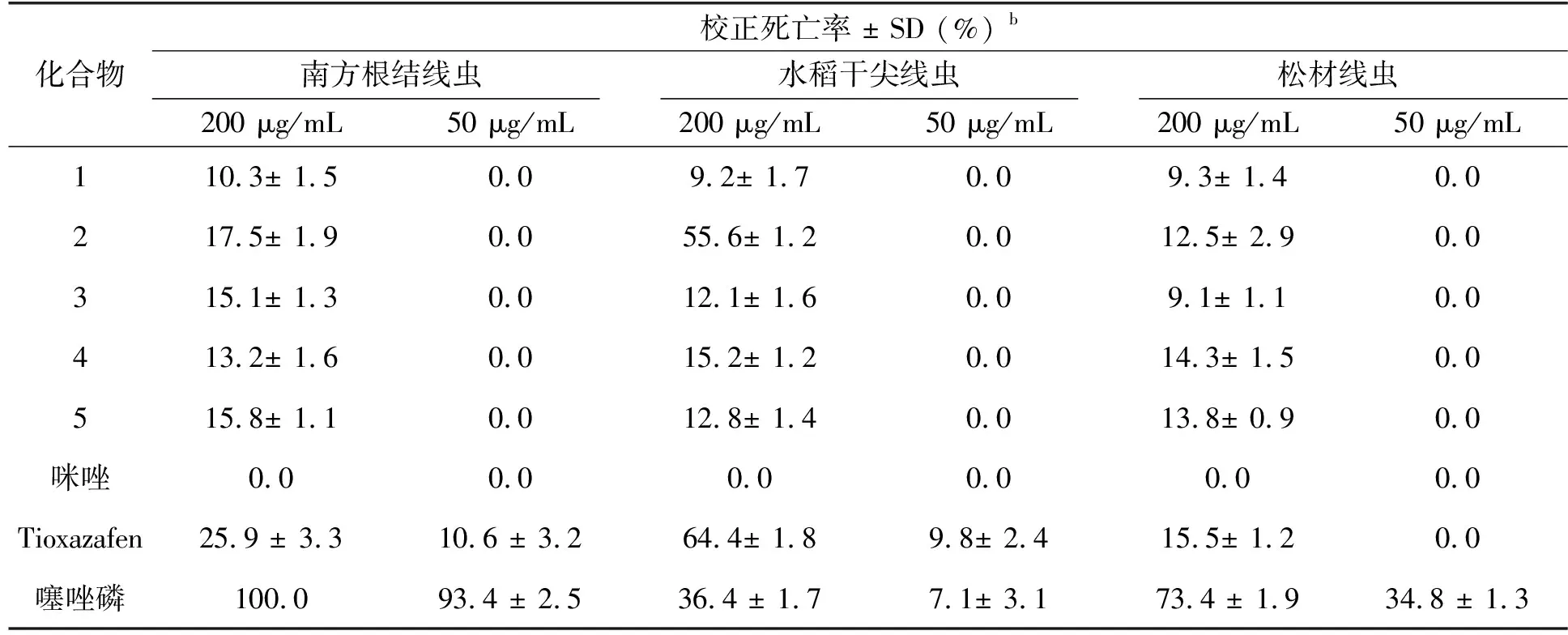
表2 目标化合物的离体杀线虫活性a
3 结论
本文将三氟甲基吡啶结构引入5种含氮杂环,得到5个含三氟甲基吡啶结构的含氮杂环化合物,其中1个为新化合物。对5-三氟甲基-2-溴吡啶与含氮杂环的C-N偶联反应条件进行探索,该偶联反应的最优反应条件如下:碘化亚铜为催化剂,碳酸钾为碱,L-脯氨酸为配体,二甲基亚砜为溶剂,氮气保护下于120 ℃反应12 h。对5个目标化合物针对南方根结线虫、松材线虫和水稻干尖线虫的离体杀虫活性进行了研究。结果显示, 在200 μg/mL 的浓度下,所有目标化合物对三种线虫表现出一定的抑制活性,5-三氟甲基-2-(1H-咪唑-1-基)吡啶对水稻干尖线虫表现出较好的杀线虫活性,致死率为55.6%,其杀线虫的活性可能主要来自于三氟甲基吡啶结构,该化合物可以作为一个先导化合物用于杀线虫剂的继续开发。
