左归丸对早发性卵巢功能不全大鼠卵巢组织Notch信号通路的影响
2022-07-14张兆萍曾丽华梁蕴仪朱玲
张兆萍, 曾丽华, 梁蕴仪, 朱玲
(1.广州中医药大学第一临床医学院,广东广州 510405;2.广州中医药大学第一附属医院,广东广州 510405)
发生于40岁以前的卵巢功能下降被称为早发性卵巢功能不全(premature ovarian insufficiency,POI),其特征为卵泡过早衰竭、月经紊乱,并伴有基础促卵泡生成激素(FSH)水平升高[1]。卵泡是女性生殖内分泌的基本功能单位,Notch 信号通路在卵泡组装和生长、减数分裂成熟及卵巢血管生成和类固醇激素产生等事件中起重要作用,也是目前认为参与生殖干细胞干性维持机制的重要信号通路[2-3]。Notch 信号通路异常可致卵泡生长发育障碍。相关临床研究表明,Notch 基因突变与POI的发病相关[4],上调Notch1 表达,激活Notch 信号通路,可以提高雌二醇(E2)、降低FSH 水平,促进POI 模型小鼠的卵泡成熟[5]。补肾填精代表方左归丸出自《景岳全书》,是治疗本病的常用方,有大补肾精、养血活血之功效。临床研究表明,左归丸可以改善高龄有生育要求妇女的卵巢储备功能[6]。本课题组前期临床研究发现,左归丸可有效改善POI 患者月经情况、全身症状和性激素水平,使月经复潮,成功妊娠[7-8],但其具体作用机制尚不明确。故本研究拟从Notch信号通路的角度探讨左归丸治疗POI的可能分子机制,现将研究结果报道如下。
1 材料与方法
1.1 动物30只SPF级8周龄SD雌性大鼠,平均体质量160 ~180 g,购自广东省医学实验动物中心,动物质量合格证号:44007200073465。饲养于广州中医药大学第一附属医院SPF 级动物实验室,许可证号:SYXK(粤)2018-0002。
1.2 药物、仪器与试剂左归丸(北京同仁堂制药厂生产,批号:国药准字Z110207735);戊酸雌二醇片(法国DELPHARM Lille S.A.S 生产,批号:国药准字J20130009);环磷酰胺(山西普德药业股份有限公司生产,批号:国药准字H14023686)。Notch1 抗体(美国CST 公司);Hes1 抗体(美国CST公司);Hes5抗体(美国Abcam公司);辣根过氧化物酶标记亲和纯化山羊抗兔免疫球蛋白[HRPconjugated Affinipure Goat Anti-Rabbit IgG(H+L)](武汉三鹰生物技术有限公司);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天公司);蛋白质标准品(美国Bio-Rad 公司);电化学发光(ECL)显影液(美国ThermoFisher公司);苏木素-伊红(HE)染色液(福州飞净生物科技有限公司)。组织脱水包埋机、冷冻台、切片机(金华科迪医疗器械有限公司);电泳及电转设备、凝胶成像系统(美国Bio-Rad公司);倒置荧光显微镜(日本Nikon公司)。
1.3 POI大鼠模型建立给予大鼠适应性喂养1 周,每日行阴道涂片观察动情周期。30只大鼠动情周期均规律,按随机数字表选取25只大鼠为造模组,5只为正常组。参考本课题组前期造模方法[9],造模组分别于第1天腹腔注射环磷酰胺负荷剂量50 mg/kg,继以5 mg·kg-1·d-1的维持剂量连续注射14 d。正常组每日腹腔注射与造模组等体积的生理盐水(10 mL·kg-1·d-1)至模型制备结束。造模第7天称体质量1次,根据体质量变化调整给药剂量。造模期间每日行阴道涂片观察动情周期,造模组大鼠均出现动情周期紊乱、间期延长、动情期缩短,提示造模成功,造模期间无大鼠死亡。本实验经广州中医药大学第一附属医院动物伦理委员会批准,伦理批号:TCMF1-2017008。
1.4 分组与干预措施造模成功后将25只大鼠按随机数字表随机分为5组,每组各5只,分别为模型组,左归丸低、高剂量组,戊酸雌二醇低、高剂量组。根据左归丸及戊酸雌二醇说明书换算标准体质量大鼠每日等效服药量[10],将其设置为低剂量,溶于蒸馏水中,故每日每只大鼠灌胃剂量为:左归丸低剂量组1.8510 g/kg,左归丸高剂量组3.7020 g/kg,戊酸雌二醇低剂量组0.1028 mg/kg,戊酸雌二醇高剂量组0.2067 mg/kg。正常组及模型组给予等体积生理盐水。各组从造模结束后第2天开始灌胃,连续30 d。期间每2 周称体质量1 次,根据体质量变化调整给药剂量,直至取材。
1.5 观察指标与方法完成灌胃30 d后的第2天,以水合氯醛麻醉后取大鼠双侧卵巢,用精密电子天平称取卵巢湿质量,计算卵巢系数。卵巢系数=卵巢湿质量(mg)/大鼠体质量(g)。随机选取各组大鼠的一侧卵巢放入冻存管中,-80 ℃保存,其余卵巢于4%多聚甲醛液固定。
1.5.1 HE染色法观察卵巢组织形态与卵泡计数 取出固定于4%多聚甲醛液的卵巢组织,梯度酒精脱水后浸没于无水乙醇二甲苯混合物中透明,浸蜡包埋。将卵巢蜡块连续切片后,展平捞片,60 ℃烤片2 h,置于生物制片透明剂松节油脱蜡。梯度酒精复水,苏木素染色3 min,蒸馏水反复浸洗。伊红染色2 min,70%酒精浸洗至镜检着色满意,中性树胶封片。显微镜观察并行卵泡计数。各级卵泡的分类参照Myers等的分类方法[11]。
1.5.2 Western Blot法检测卵巢组织Notch1、Hes1、Hes5蛋白的表达 取出-80 ℃冻存的卵巢组织,称取30 mg卵巢,按试剂说明书加裂解液混合液抽提卵巢组织总蛋白。制备蛋白标准品并绘制蛋白标准曲线,测定样品蛋白浓度,配胶、电泳、转膜,5%脱脂牛奶封闭,4 ℃孵育稀释后的一抗(Notch1、Hes1、Hes5、内参GAPDH 分别用抗体稀释液以1∶1000 稀释)过夜,室温孵育稀释后的二抗(用5%牛奶TBST 以1∶10000 稀释)1 h,TBST 洗膜后,显影。使用ImageJ 软件分析条带灰度值。
1.6 统计方法采用SPSS 26.0统计软件进行数据分析。服从正态分布的计量资料以均数±标准差(x±s)表示,2组比较采用t检验,多组比较采用方差分析并进行两两比较;否则采用非参数检验。不服从正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,采用非参数检验(秩和检验)进行统计分析。所有的统计分析检验均采用双侧假设检验,检验水准为α= 0.05,以P<0.05 为差异有统计学意义。
2 结果
2.1 左归丸对POI大鼠体质量及卵巢系数的影响造模前,正常组与模型组的体质量比较,差异无统计学意义(P>0.05)。造模第7、14天,与正常组比较,模型组体质量显著降低(P<0.05)。造模完成后,与正常组比较,模型组的双侧卵巢质量均降低(P<0.01),但双侧卵巢系数差异无统计学意义(P>0.05)。干预30 d 后,左归丸低、高剂量组及戊酸雌二醇低、高剂量组双侧卵巢质量、卵巢系数均较模型组增加,但差异无统计学意义(P>0.05)。具体结果见表1。
表1 各组大鼠实验期间体质量、卵巢系数比较Table 1 Comparison of body mass and ovarian coefficients among various groups of rats during the experiment(±s)
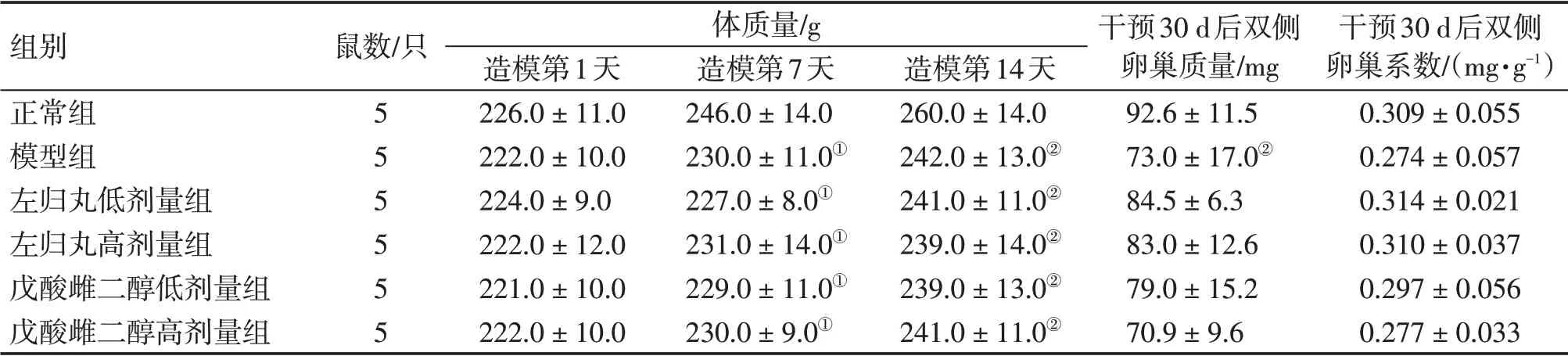
表1 各组大鼠实验期间体质量、卵巢系数比较Table 1 Comparison of body mass and ovarian coefficients among various groups of rats during the experiment(±s)
①P<0.05,②P<0.01,与正常组比较
组别正常组模型组左归丸低剂量组左归丸高剂量组戊酸雌二醇低剂量组戊酸雌二醇高剂量组鼠数/只555555体质量/g造模第1天226.0±11.0222.0±10.0224.0±9.0222.0±12.0221.0±10.0222.0±10.0造模第7天246.0±14.0230.0±11.0①227.0±8.0①231.0±14.0①229.0±11.0①230.0±9.0①造模第14天260.0±14.0242.0±13.0②241.0±11.0②239.0±14.0②239.0±13.0②241.0±11.0②干预30 d后双侧卵巢质量/mg 92.6±11.573.0±17.0②84.5±6.383.0±12.679.0±15.270.9±9.6干预30 d后双侧卵巢系数/(mg·g-1)0.309±0.0550.274±0.0570.314±0.0210.310±0.0370.297±0.0560.277±0.033
2.2 左归丸对POI大鼠卵巢组织形态及卵泡数量的影响正常组卵巢皮质、髓质结构清晰,皮质内含各级卵泡结构,卵泡数量丰富,发育良好,并有大量黄体分布;模型组卵巢萎缩,各级卵泡及黄体数量较正常组明显减少(P<0.05 或P<0.01),卵泡内结构破坏,形态不规则,卵巢颗粒细胞层较少,排列混乱,闭锁卵泡明显增多;左归丸低剂量组初级卵泡、次级卵泡、窦卵泡、黄体数量较模型组显著增加(P<0.05 或P<0.01),原始卵泡数量无明显变化(P>0.05),可见到少量闭锁卵泡,髓质内含丰富弹性纤维和血管;戊酸雌二醇低剂量组初级卵泡、窦卵泡、黄体数量较模型组显著增加(P<0.05 或P<0.01),卵巢边缘可见到少量原始卵泡,原始卵泡及次级卵泡数量无明显变化(P>0.05),可见到少量闭锁卵泡,髓质内含有丰富的弹性纤维和血管。各组卵巢组织形态变化如图1所示,卵泡及黄体数量比较如表2所示。
表2 各组大鼠各级卵泡及黄体数量比较Table 2 Comparison of the number of follicles at all levels and corpus luteum among various groups of rats [M(P25-P75)或±s]
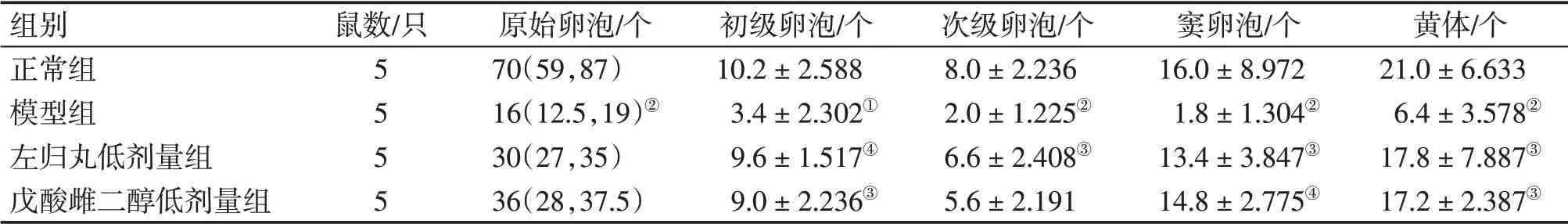
表2 各组大鼠各级卵泡及黄体数量比较Table 2 Comparison of the number of follicles at all levels and corpus luteum among various groups of rats [M(P25-P75)或±s]
①P<0.05,②P<0.01,与正常组比较;③P<0.05,④P<0.01,与模型组比较
组别正常组模型组左归丸低剂量组戊酸雌二醇低剂量组鼠数/只5555原始卵泡/个70(59,87)16(12.5,19)②30(27,35)36(28,37.5)初级卵泡/个10.2±2.5883.4±2.302①9.6±1.517④9.0±2.236③次级卵泡/个8.0±2.2362.0±1.225②6.6±2.408③5.6±2.191窦卵泡/个16.0±8.9721.8±1.304②13.4±3.847③14.8±2.775④黄体/个21.0±6.6336.4±3.578②17.8±7.887③17.2±2.387③

图1 各组大鼠卵巢组织形态比较(HE染色,×40)Figure 1 Comparison of ovarian histomorphology in various groups of rats(HE staining,×40)
2.3 各组大鼠卵巢组织Notch信号通路受体Notch1和下游分子Hes1、Hes5 蛋白表达比较与正常组比较,模型组大鼠卵巢组织Notch1、Hes1、Hes5 蛋白表达水平均有不同程度的下降,其中,Hes1 蛋白表达水平下降显著(P<0.01)。与模型组比较,左归丸低、高剂量组大鼠卵巢组织Notch1、Hes1蛋白表达水平均显著上升(P<0.05 或P<0.01),左归丸高剂量组Hes5 蛋白表达水平呈上升趋势,但差异无统计学意义(P>0.05),且2 个剂量组各蛋白表达水平组间比较,差异无统计学意义(P>0.05)。与模型组比较,戊酸雌二醇低剂量组大鼠卵巢组织Notch1、Hes1 蛋白表达水平均显著上升(P<0.05 或P<0.01),Hes5 蛋白表达水平呈上升趋势,但差异无统计学意义(P>0.05),戊酸雌二醇高剂量组的Notch1、Hes1、Hes5 蛋白表达水平差异无统计学意义(P>0.05)。各组卵巢组织Notch1、Hes1、Hes5 蛋白表达水平结果如表3 所示,蛋白电泳结果如图2所示。

图2 各组大鼠卵巢组织Notch1、Hes1、Hes5蛋白电泳结果Figure 2 Electrophoresis results of Notch1,Hes1 and Hes5 proteins in ovarian tissues of various groups of rats
表3 各组大鼠干预30 d后卵巢组织Notch1、Hes1、Hes5蛋白相对表达量比较Table 3 Comparison of the relative protein expression levels of Notch1,Hes1 and Hes5 in ovarian tissues among various groups of rats after 30 days of intervention (±s)
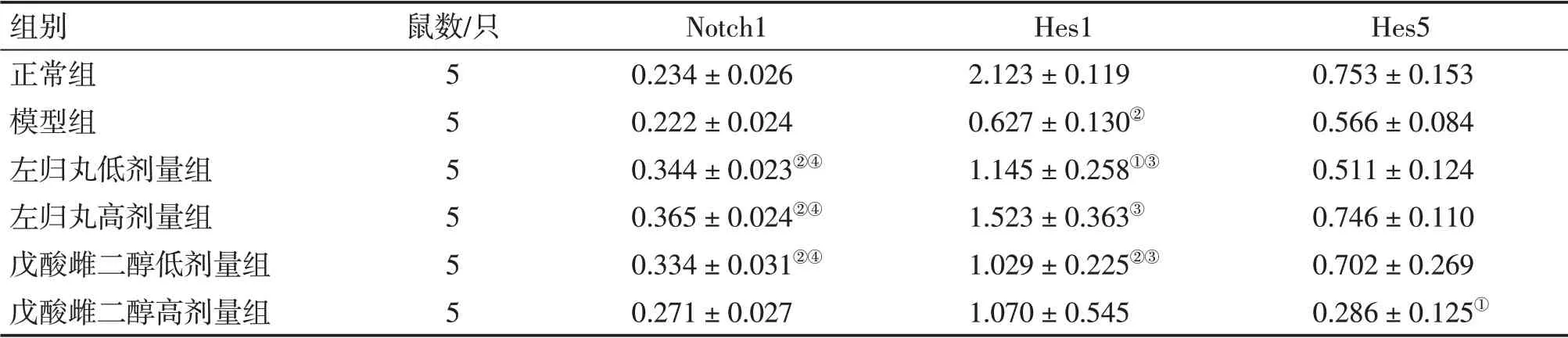
表3 各组大鼠干预30 d后卵巢组织Notch1、Hes1、Hes5蛋白相对表达量比较Table 3 Comparison of the relative protein expression levels of Notch1,Hes1 and Hes5 in ovarian tissues among various groups of rats after 30 days of intervention (±s)
①P<0.05,②P<0.01,与正常组比较;③P<0.05,④P<0.01,与模型组比较
组别正常组模型组左归丸低剂量组左归丸高剂量组戊酸雌二醇低剂量组戊酸雌二醇高剂量组鼠数/只555555 Notch10.234±0.0260.222±0.0240.344±0.023②④0.365±0.024②④0.334±0.031②④0.271±0.027 Hes12.123±0.1190.627±0.130②1.145±0.258①③1.523±0.363③1.029±0.225②③1.070±0.545 Hes50.753±0.1530.566±0.0840.511±0.1240.746±0.1100.702±0.2690.286±0.125①
3 讨论
中医古籍中未有早发性卵巢功能不全的病名,根据相似的临床症状,将其归属于中医“经水早断”“月水先闭”“经水不当绝而绝”“年未老而经水断”等范畴。肾者,先天之本,藏精,主生殖。《傅青主女科》云:“有年未至七七而经水先断者,人以为血枯经闭也,谁知是心肝脾气之郁乎……然则经水早断,似乎肾水衰涸。”虽然古今各医家观念有所不同,但基本形成了以肾虚为本,肝、脾、心、肾之间相互为病的认识。补肾填精法,即通过补益肾气、填精益髓的药物组合,使肾气充盛,精血满盈,从而达到改善卵巢功能的目的,是治疗本病的基本治法。其代表方左归丸出自明代张景岳的《景岳全书》,方中以熟地黄为君药,补肾养阴,填精益髓,山茱萸滋养肝肾,山药补脾益阴,枸杞子补肾益精,加龟胶、鹿胶为血肉有情之品,填精补髓养血之力尤甚,佐牛膝补肾强腰,活血化瘀,以菟丝子平补肾中阴阳,“阳化气,阴成形”,体现张景岳“善补阴者,必于阳中求阴,则阴得阳升而泉源不竭”的治法特点。
有研究表明,雌性大鼠在6周左右性成熟,而后进入成年期,在15~20个月(600 d)之间进入更年期[12],本研究选择实验动物为8 周龄SD 雌性大鼠,实验周期(含适应性喂养、造模和药物灌胃)共7周,在实验周期内大鼠均处于青壮年期,与临床POI患者年龄基本匹配。在POI的相关基础研究中,化疗损伤卵巢模型与免疫模型、雷公藤多苷模型、代谢模型等相比,具有成功率高、简便易行的特点[13]。研究发现,化疗源性卵巢功能损伤随着时间的推移可能出现不同程度的卵巢功能恢复[14]。本研究根据团队前期研究探索,利用环磷酰胺的生殖毒性建立POI 的大鼠模型[9],结果显示,本研究所采用的剂量造模死亡率低,并在造模30 d后仍能观察到模型组大鼠体质量、卵巢质量较正常组明显下降,HE 染色仍可见卵泡结构明显破坏,各级卵泡及黄体数量仍较正常组显著下降,模型效果较持久稳定。
Notch 信号通路是一条普遍存在且进化上保守的细胞内通路,参与卵子发生、卵巢激素分泌,调控生殖干细胞的增殖分化[2-3]。Notch1、Hes1、Hes5 是Notch 通路下游重要的受体和相关靶分子,其蛋白的表达量可以反映Notch 信号通路的强弱。卵泡的生长发育发生涉及多个周期的有丝分裂,卵泡细胞分化过程中从有丝分裂到内复制的转变受到Notch 信号通路的调控,抑制Notch 通路可阻止小鼠卵母细胞进入减数分裂[15];Notch 信号通路调控卵巢颗粒细胞分化和增殖的平衡,抑制Notch信号通路表达可抑制颗粒细胞增殖[16]。Notch 通过调控类固醇生物合成途径中的酶表达,调节性激素的分泌[17]。卵巢表面上皮细胞中的Notch1、Hes1和Hes5 以及生殖干细胞标记物Mvh 和Oct4 的水平随着生殖年龄的增长而显著降低[18]。通过RNA 串扰下调Notch信号通路受体,可导致生殖干细胞的死亡和衰减,卵巢功能衰退[17]。其中,Hes1 还与原始卵泡池的形成和募集调控[19]、卵母细胞的发育成熟密切相关,敲除Hes1 的小鼠卵母细胞发育受到抑制、细胞凋亡增加,卵母细胞数量显著下降[20]。本研究结果显示,与正常组大鼠比较,模型组大鼠动情周期紊乱,双侧卵巢萎缩,卵巢质量明显下降。病理切片显示:卵巢组织内各级生长卵泡较正常组显著减少,卵泡结构破坏,闭锁卵泡增加,颗粒细胞排列紊乱,卵巢组织中Notch1、Hes1、Hes5 蛋白表达均有不同程度下降,其中,Hes1 蛋白表达下降显著,提示POI 大鼠存在卵泡生长发育障碍,其作用机制可能与Notch信号通路的表达下调有关。
本研究给予左归丸及戊酸雌二醇干预30 d后,结果显示,与模型组比较,除戊酸雌二醇高剂量组外,各干预组的卵巢质量、卵巢系数均有所恢复,其中左归丸组的恢复速度较戊酸雌二醇组快,但未能得出统计学差异,原因可能与样本量偏小、干预时间不足有关。卵巢病理组织学观察各级生长卵泡和闭锁卵泡计数能直观地反映卵巢储备功能,可见左归丸组POI大鼠的各级生长卵泡和黄体数量较模型组显著增加,而戊酸雌二醇组初级卵泡、窦卵泡、黄体数量较模型组明显改善,但原始卵泡、次级卵泡数量变化不明显。肾藏精,主生殖。肾精是卵泡生长的物质来源,左归丸组方注重调节肾的阴阳平衡,虽以补肾阴为主,然补阴之中寓有补阳之用,又佐以牛膝补肾强腰、活血通经,合方有大补肾精、养血活血之功,可促进卵泡的生长发育,改善卵巢储备功能。左归丸各剂量组均能显著促进Notch信号通路关键组分Notch1、Hes1 蛋白表达,其中左归丸高剂量组还能增强Hes5 蛋白表达,戊酸雌二醇低剂量组能改善Notch1、Hes1、Hes5 蛋白表达,戊酸雌二醇高剂量组改善均不明显,提示左归丸可能通过调节Notch信号通路的表达,改善各级卵泡的生长发育,改善卵巢功能。
综上所述,左归丸可以有效改善环磷酰胺所致POI模型大鼠的卵巢功能,其机制可能与促进卵巢组织Notch信号通路的关键组分Notch1、Hes1蛋白表达,改善卵泡生长发育,缓解卵巢毒性损伤有关。今后的研究中可添加Notch信号通路抑制剂进行比较分析,进一步验证实验结论,深入探讨左归丸的具体作用靶点。
