基于全基因组的荷花SBP基因家族的生物信息学及表达分析
2022-07-14曹小汉邓贤会毛惠敏殷丹丹万文阳任莉萍
曹小汉, 邓贤会, 毛惠敏, 殷丹丹, 闫 欢, 万文阳, 任莉萍
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
荷花(Nelumbonucifera)为莲科莲属多年生挺水植物,是我国十大传统名花中唯一的水生花卉。荷花在我国有3 000多年的栽培历史,具有很高的观赏价值、药用价值及文化价值[1-3]。荷花喜静水,多分布于淡水湖泊集中分布的地区,耐盐能力差[4];喜温,不耐寒,栽植季节的气温在18 ℃以上[5];喜光,极不耐荫,弱光下生长缓慢开花迟[6]。
转录因子通过激活或抑制下游靶基因的表达,在生物的生长发育、激素信号转导和逆境胁迫应答中发挥着重要的调控作用。SBP(SQUAMOSA promoter binding protein)转录因子为植物所特有,又被称为SPL(SQUAMOSA promoter binding protein llike)蛋白,该家族具有高度保守的SBP结构域,该结构域由74个氨基酸构成,保守结构域包含3个特征性结构,其中有2个锌指结构,还有1个核定位信号结构[7-8]。研究表明,SBP转录因子参与叶片发育、花的形成、发育阶段转变、果实成熟、植物育性以及激素、光周期、生物和非生物等各种胁迫响应[9]。水稻共有19个SBP基因,OsSPL16调控水稻谷粒的形状、大小和品质[10],OsSPL14在营养生长阶段通过与miR156相互作用调控水稻分蘖[11]。柑橘CclSBP7促进开花且参与开花过程[12];菠萝中SBP基因家族响应冷、热、盐和干旱等非生物胁迫[13]。
自SBP蛋白首次在金鱼草中发现后[14],SBP转录因子家族已经先后在拟南芥[15]、水稻[16]、小麦[17]、大麦[18]、谷子[19]、狼尾草[20]、茶树[21]、杨树[8]、黑胡椒[7]等多个物种中进行了全基因组水平的鉴定和分析,而荷花SBP基因家族的研究尚未见报道。本研究在全基因组水平上利用生物信息学手段对荷花SBP基因家族进行鉴定、基本理化性质分析、保守结构域分析、系统进化分析、染色体定位分析、顺式作用元件分析及组织表达模式分析,为阐明荷花SBP基因家族成员在调控生长发育及胁迫应答等方面的生物学功能提供研究基础。
1 材料与方法
1.1 供试材料
荷花SBP蛋白序列来源于荷花基因组数据库the Nelumbo Genome Database;拟南芥SBP蛋白序列来源于数据库TAIR。
1.2 实验方法
从Pfam数据库下载SBP保守结构域的HMM-Hidden Markov Model文件PF03110,采用HMMER 3.0软件鉴定SBP蛋白。利用SMART预测荷花SBP蛋白的保守结构域;利用DNAMAN软件筛除重复序列,最终获得荷花所有的SBP基因家族成员。
利用Expasy计算蛋白质分子量和理论等电点、不稳定性指数、亲水性总平均值。利用在线网站Softberry对荷花SBP蛋白进行亚细胞定位。
使用Clustal X软件对荷花SBP蛋白进行多序列比对,并将结果提交GeneDoc 2.7进行优化;利用TBtools对SBP基因家族的基因结构进行可视化;利用MEME分析荷花SBP保守基序;利用MEGA 7.0软件(邻接法,Bootstrap设为1 000次)构建系统进化树;利用Plant CARE在线数据库鉴定启动子区的顺式作用元件。从荷花基因组数据库获取转录组数据,生成10组荷花不同发育阶段的组织特异性表达数值;对同一组织的多个样品数据取均值后采用log2(FPKM+1)对数据进行转换,用TBtools软件创建热图。
2 结果与分析
2.1 荷花NnSBP基因家族的鉴定及理化性质分析
基于荷花基因组数据库,最终鉴定出20个荷花SBP基因,分别命名为NnSBP1~NnSBP20(表1)。理化性质分析表明,SBP蛋白长度为189~1 085 aa;对应的蛋白质相对分子质量为21 404.02~120 066.40 Da,平均值为65 734.98 Da;SBP蛋白的等电点为5.81~9.38,均值为8.14,表明家族中80%的SBP蛋白呈弱碱性(表1)。总平均疏水性为-1.165~-0.322,该家族成员均为亲水性蛋白。不稳定指数在45.94~80.69之间,说明该家族成员均为不稳定蛋白(Instability Index>40)。经亚细胞定位预测,16个荷花SBP蛋白定位于细胞核,另外4个蛋白定位在细胞外。
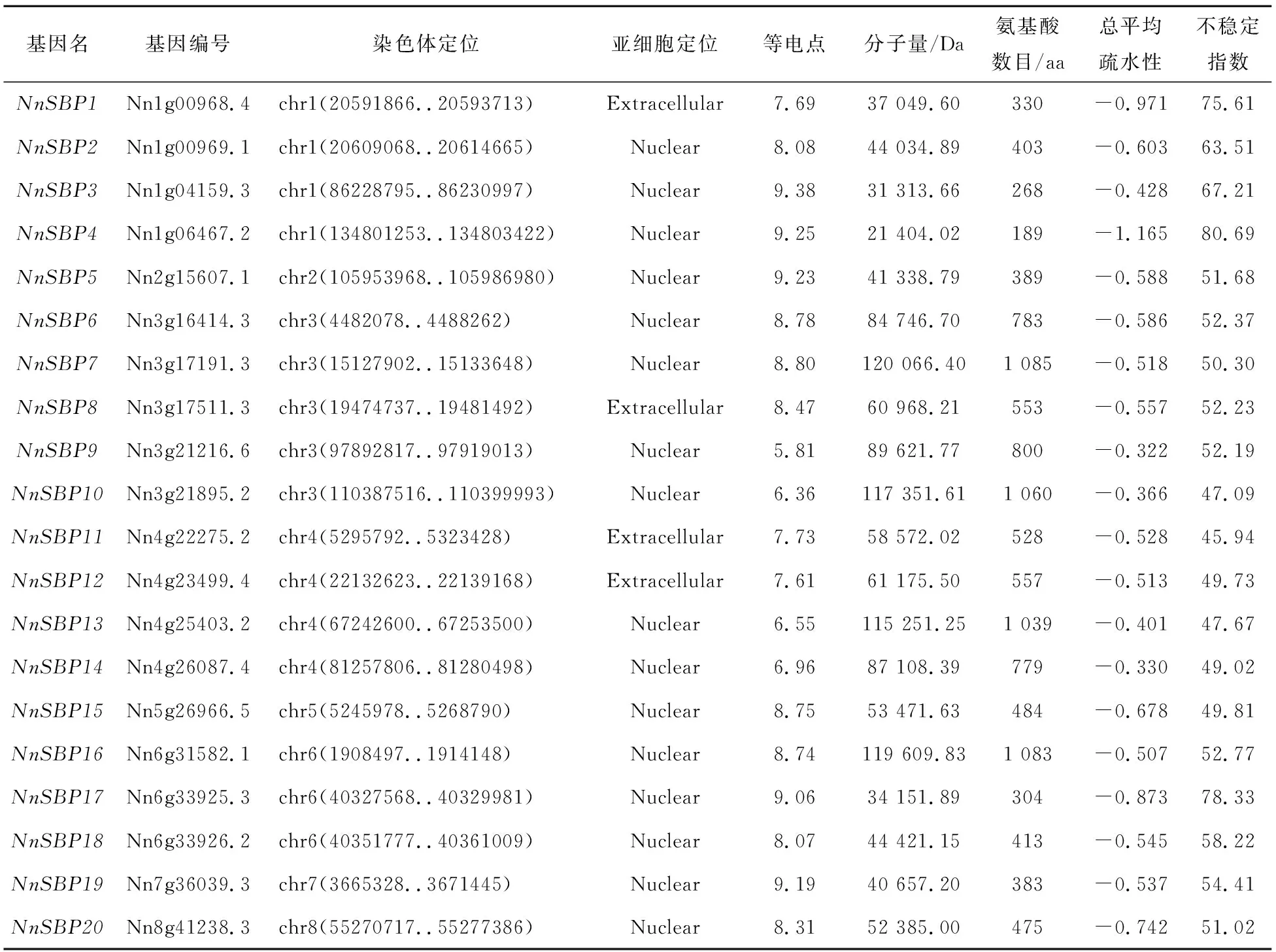
表1 荷花SBP转录因子家族基因基本信息
2.2 荷花SBP基因家族的进化分析
为了解荷花SBP蛋白与拟南芥SBP蛋白的系统进化关系,首先将荷花SBP蛋白序列和拟南芥SBP蛋白序列进行多序列比对,然后利用MEGA 7.0对构建系统进化树。根据进化树亚组的分类标准,若进化树中成员位于同一聚类分支,则被认为具有较近的亲缘关系,即视为同一个亚组。结果表明,20个荷花SBP蛋白共分为8个亚组。Group 6亚族成员个数最多,有8个成员,包括4个荷花SBP蛋白和4个拟南芥SBP蛋白;其次是Group 1亚族,包括4个荷花SBP蛋白和2个拟南芥SBP蛋白;Group 4亚族和Group 5亚族各包括4各成员;Group 2亚族、Group 3亚族和Group 8亚族各包括3个成员(图1)。

图1 荷花SBP蛋白的系统进化分析
2.3 荷花SBP转录因子家族的蛋白质保守基序分析
通过对荷花SBP蛋白进行多序列比对,利用GeneDoc对比对结果进行作图,结果表明所有荷花SBP蛋白序列均包含3个保守结构域,2个锌指结构和1个核定位信号(图2)。利用MEME在线分析20个荷花SBP蛋白序列,共鉴定出10种不同的保守基序(图3)。参照系统进化树分类,不同分支的SBP蛋白含有Motif的数目和种类差异较大(图3 B):Group 6成员中NnSBP3和NnSBP4仅包含3种基序;Group 1、Group 2、Group 7和Group 6(NnSBP1和NnSBP17)包含4种基序;Group 3含有5种保守基序;Group 8含有7种保守基序;Group 4和Group 5含有10种保守基序。
2.4 荷花SBP基因家族在染色体上的分布
从基因组数据库下载荷花SBP基因染色体定位信息,绘制染色体定位分布图。结果表明,荷花SBP基因在染色体上的分布不均匀,20个基因分布于8条染色体上,染色体3上分布5个基因,分布最多;染色体1和4,分布4个基因;染色体6分布3个基因,染色体2、5、7、8均各分布1个基因。

图2 荷花SBP蛋白保守结构域分析
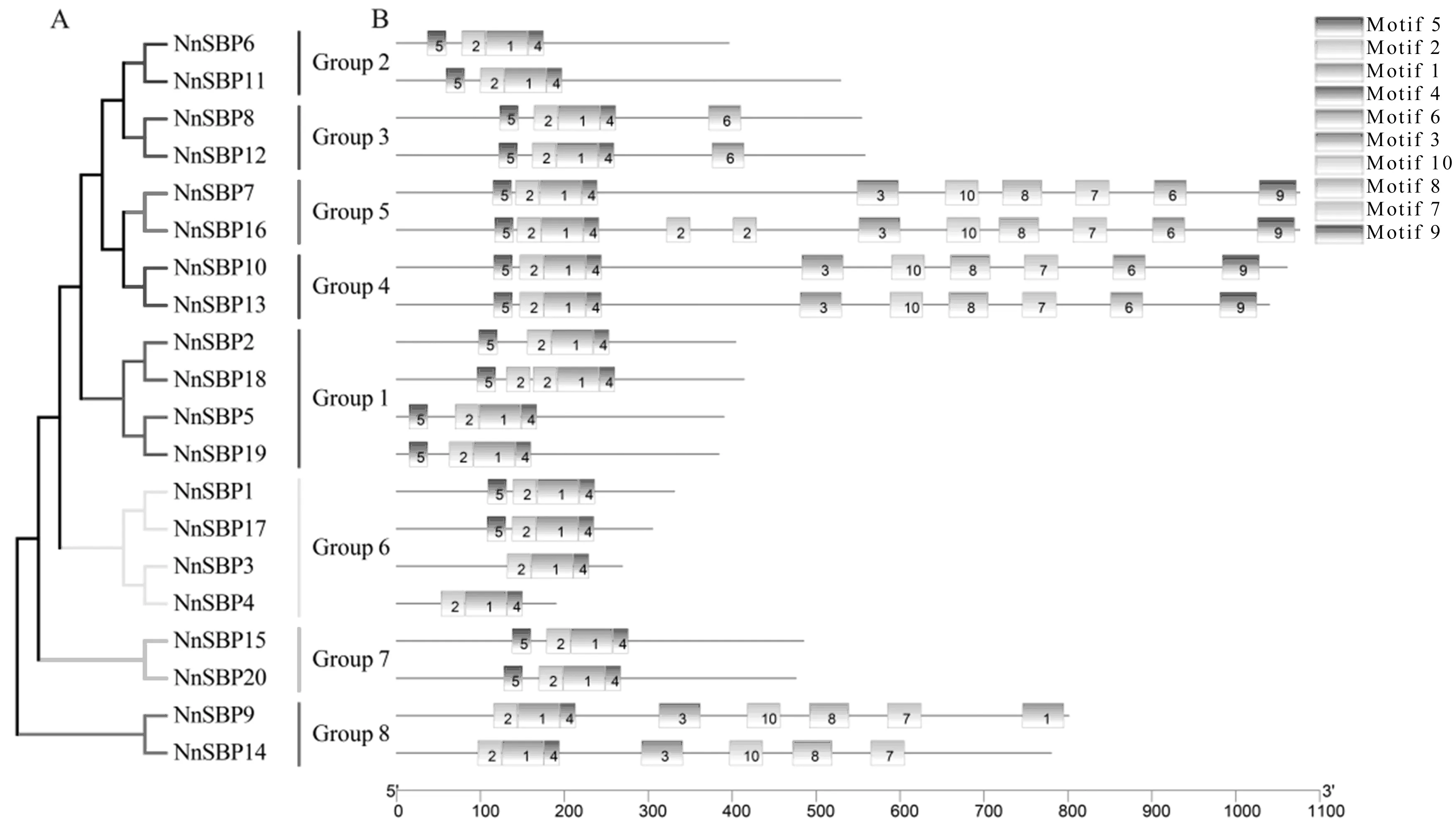
图3 荷花SBP转录因子的系统进化及保守基序分析

图4 荷花SBP基因的染色体定位
2.5 荷花SBP基因的顺式作用元件分析
启动子序列分析表明,荷花SBP基因家族启动子元件共分为5个类型,分别为光响应元件、厌氧诱导元件、分生组织表达元件、相关激素响应元件、胁迫响应元件(表2)。激素响应元件种类较多,包括赤霉素响应元件、茉莉酸甲酯响应元件、脱落酸响应元件、生长素响应元件和水杨酸响应元件,说明它们可能通过响应不同的激素信号,在荷花生长发育和胁迫响应中起不同的调控作用。

表2 荷花SBP基因顺式作用元件分析
2.6 荷花SBP基因家族的表达分析
为了进一步分析荷花SBP基因在发育过程中的作用,对荷花SBP基因在不同组织(种皮、子叶、根茎、节间、叶柄、成熟花托、花瓣、授粉心皮、成熟雄蕊)的表达情况进行聚类分析(图5)。根据图5可以将荷花SBP基因在不同组织中的表达情况大致分为四类:第一类基因(NnSBP4、NnSBP7、NnSBP10、NnSBP13、NnSBP16)在每种组织中都表现为较高表达水平;第二类基因(NnSBP2、NnSBP6、NnSBP12、NnSBP15、NnSBP18、NnSBP19、NnSBP20)在各类组织中都表现为较低表达水平;第三类基因(NnSBP9、NnSBP11、NnSBP14)在多种组织中都表现为较高表达水平;第四类基因(NnSBP1、NnSBP3、NnSBP5、NnSBP8、NnSBP17)仅在少数组织中表现为较高表达水平。有趣的现象是,除了NnSBP2外的所有NnSBPs在成熟花托和授粉心皮中均表现为较高表达水平。

图5 荷花SBP基因在不同组织中表达分析
3 结论与讨论
植物SBP转录因子不仅参与植物成花途径、生长发育的的调控[22],还在植物响应非生物胁迫方面发挥着重要作用,包括过量的铜离子胁迫、盐胁迫、温度和干旱胁迫[23-24],另外,还对花青素的生物合成产生负调控作用[25-26]。因此,在全基因组水平上对荷花SBP基因家族进行生物信息学及表达模式分析,为深入探讨SBP基因家族成员在荷花生长发育及胁迫响应的调控功能研究中提供理论基础。
目前,许多重要植物已经开展了SBP基因家族的研究,拟南芥、水稻和番茄的SBP转录因子家族成员较少,不到20个,而茶树、猕猴桃等成员则较多,多于20个[27]。本研究在全基因水平上共鉴定出20个荷花SBP基因。荷花SBP蛋白的等电点介于5.81~9.38之间,表明大部分NnSBP蛋白富含碱性氨基酸,可能会在酸性亚细胞环境发挥作用,这与杜仲[27]、黄瓜[28]、大麦[18]的SBP成员蛋白性质基本一致。所有荷花NnSBP蛋白均含有的2个锌指结构,推测其能特异识别SQUAMOSA (SQ-UA)启动子,而位于C端的核定位信号区域则能够指导蛋白进入细胞核行使功能。从系统发育分析中可知,荷花和拟南芥的SBP成员可以分为8个类,相同类型的基因具有相似的基因结构和基序。通过顺式作用元件分析发现,除了光响应元件、分生组织表达元件外还包括多个激素响应元件和胁迫响应元件,说明它们可能通过响应不同的激素信号,在植物生长发育和胁迫响应中具有重要的调控作用,这与谷子[19]、茶树[29]预测结果一致。