不同穿膜肽载体转染对猪精子受精能力的影响
2022-07-14陈集成黄秀芸郑自华韦英明杨素芳
陈集成 黄秀芸 郑自华 韦英明 杨素芳



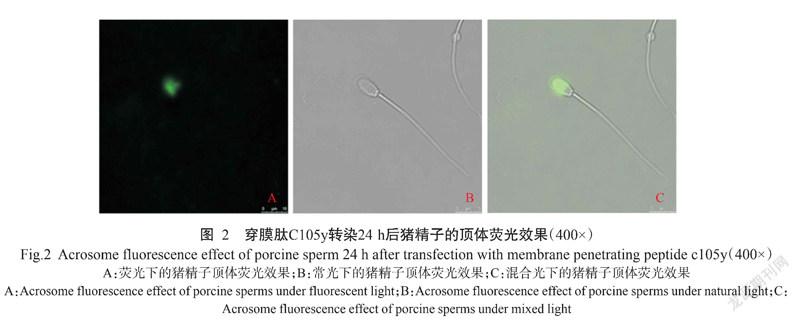


摘要:【目的】明确修饰基因组通过穿膜肽载体转染精子的可行性及穿膜肽载体对精子和受精卵的影响,为实现安全有效地大批量制备猪转基因胚胎提供技术支撑。【方法】以水牛Sohlh2基因为目的基因,通过细胞穿膜肽(C105y、MPG和TAT)和慢病毒介导转染猪精子后,采用激光共聚焦扫描显微镜观察转染精子形态特征的变化,利用精子图像分析仪(CASA)检测精子活率、平均曲线运动速度(VCL)、平均直线运动速度(VSL)和前向性(STR)等指标,运用精子顶体染色试剂盒测定猪精子顶体反应,并通过体外受精进一步验证不同载体转染制备生产转Sohlh基因猪胚胎的效果。【结果】转染后的猪精子顶体结构完整,细胞膜未见破裂;不同细胞穿膜肽(C105y、MPG和TAT)的猪精子转染阳性率分别为56.74%、50.44%和43.58%,低于慢病毒的转染阳性率(61.48%),但差异不显著(P>0.05,下同)。经穿膜肽C105y转染24 h,猪精子活率(70.09%)、平均直线运动速度(35.36 μm/s)、平均曲线运动速度(42.20 μm/s)、前向性(1.03 μm/s)与对照组相比差异均不显著;而经穿膜肽MPG和TAT及慢病毒转染后,猪精子的各项指标均呈一定程度的下降趋势。细胞穿膜肽转染猪精子的自发顶体反应率与对照组相比无显著差异,慢病毒转染则呈显著的上升趋势(P<0.05,下同);在诱发顶体反应率方面,慢病毒转染猪精子的诱发顶体反应率较对照组呈显著下降趋势,而不同细胞穿膜肽转染对猪精子诱发顶体反应率也无显著影响。慢病毒和穿膜肽C105y转染猪精子经体外受精获得的受精卵继续培养24 h后其卵裂率为64.82%和65.91%,与对照组受精卵的卵裂率(64.52%)差异不显著;穿膜肽C105y转染组的囊胚率(15.82%)与对照组间无显著差异,而慢病毒转染组的囊胚率(9.11%)显著低于对照组;在转基因胚胎阳性率方面,穿膜肽C105y转染组显著低于慢病毒轉染组(8.54% vs 10.38%)。【结论】穿膜肽C105y对猪精子的受精能力及转基因猪胚胎发育影响小,且毒害作用不明显,是一个能高效转导外源基因的安全载体。
关键词: 穿膜肽载体;猪精子;慢病毒;受精能力;体外受精;转染
中图分类号: S828.34 文献标志码: A 文章编号:2095-1191(2022)04-0958-11
Effects of different transmembrane peptide carriers on pig sperm insemination ability
CHEN Ji-cheng1,2, HUANG Xiu-yun3, ZHENG Zi-hua1, WEI Ying-ming1*, YANG Su-fang1*
(1State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources/Guangxi University, Nanning,Guangxi 530004, China; 2Guangxi Agricultural Vocational University, Nanning, Guangxi 530007, China; 3Guangxi Polytechnic of Construction, Nanning, Guangxi 530007, China)
Abstract:【Objective】To clarify the feasibility of transfection of modified genome into spermatozoa by transmembrane peptide and the effect of transmembrane peptide on spermatozoa and fertilized eggs, so as to provide technical support for the safe and effective mass production of pig transgenic embryos. 【Method】 With buffalo Sohlh2 gene as the target gene, pig spermatozoa were transfected by cell membrane penetrating peptide (C105y, MPG and TAT) and lentivirus. Morphological characteristics of transfected spermatozoa were observed by laser confocal scanning microscope. Sperm viability, mean curvilinear velocity (VCL), mean linear velocity (VSL) and forward tropism (STR) were detected by sperm image analyzer (CASA), Sperm acrosome staining kit (psa-fitc) was used to detect pig sperm acrosome reaction, and in vitro fertilization was used to further verify the effect of different vector transfection on the production of Sohlh transgenic pig embryos. 【Result】The acrosome structure of transfected pig sperm was intact, and the cell membrane was not broken. The positive rates of pig sperm transfection with different cell penetrating peptides (C105y, MPG and TAT) were 56.74%, 50.44% and 43.58% respectively, which were lower than that of lentivirus (61.48%), but the difference was not significant (P>0.05, the same below). After transfection with membrane penetrating peptide C105y for 24 hours, the pig sperm viability (70.09%) and the average linear velocity (35.36 μm/s), average curve velocity (42.20 μm/s), forward directivity (1.03 μm/s), compared with the control group, the difference was not significant. After transfection with membrane penetrating peptides MPG, TAT and lentivirus, the indexes of pig sperm showed a downward trend to some extent. There was no significant difference in the incidence of spontaneous acrosome reaction in pig spermatozoa transfected with cell penetrating peptide compared with the control group, but there was a significant upward trend in lentivirus transfection (P<0.05, the same below). In the aspect of inducing acrosome reaction rate, the rate of inducing acrosome reaction in pig sperm transfected with lentivirus was significantly lower than that in the control group, while the rate of inducing acrosome reaction in pig sperm transfected with different cell penetrating peptides had no significant effect. The cleavage rates of the fertilized eggs obtained from porcine sperm transfected with lentivirus and transmembrane peptide C105y after in vitro fertilization were 64.82% and 65.91% after 24 hours of culture, which were not significantly different from those of the control group (64.52%). There was no significant difference in the blastocyst rate (15.8%) between the transfected group and the control group, but the blastocyst rate (9.11%) in the lentivirus transfected group was significantly lower than that in the control group. In terms of the positive rate of transgenic embryos, the membrane penetrating peptide C105y transfection group was significantly lower than that of the lentivirus transfection group (8.54% vs 10.38%). 【Conclusion 】Membrane penetrating peptide C105y has little effect on the fertilization ability of pig sperm and the development of transgenic pig embryos, and its toxic effect is not obvious. It is a safe vector for efficient transduction of foreign genes.
Key words: transmembrane peptide; pig sperm; lentivirus; fertilization ability; in vitro fertilization; transfection
Foundation items: National Natural Science Foundation of China (31860644); National Modern Agricultural Industrial Technology System Guangxi Innovation Team Construction Project (nycytxgxcxtd-2021-09-01); Guangxi Natural Science Foundation Project (2019GXNSFDA185002)
0 引言
【研究意义】猪和人类在解剖学、生理学上具有极大的相似性,是人类异种器官移植的理想来源(兰宗宝等,2008;潘斌等,2011;孙武和娜日苏,2015),但强烈的排斥反应阻碍着该设想的临床实施,而通过转基因技术改造猪的遗传性状以适应人类性状有望解决超排斥的问题。据报道,2022年1月7日美国马里兰大学医学院团队成功对一名晚期心脏病男性患者实施全球首例转基因猪心脏移植(Servick,2022),进一步证实经基因编辑后的猪器官可作为异种器官移植来源。转基因猪的获得方法有逆转录病毒感染法、DNA显微注射法、基因打靶技术及精子载体法等(高晗和钟蓓,2020),其中,精子载体法的原理是利用精子具有自主结合并内化转运外源DNA的能力,可作为载体携带外源DNA进入卵母细胞,具有简单便捷、应用广泛和成本低等特点,是生产转基因动物的有效途径之一,利用该技术已成功获得小鼠、家兔、猪、牛、鸡、绵羊等转基因动物(Sperandio et al.,1996;Lavitrano et al.,2003;Shen et al.,2006;Harel-Markowitz et al.,2009)。但精子载体法也存在重复率较低及外源DNA未能整合进入基因组而游离在外的问题(Chaparian et al.,2016),精子细胞膜阻止外源基因进入是主要原因,且利用慢病毒等载体易对精子的受精能力产生一定影响(蔡伟光等,2013)。穿膜肽载体具有安全低毒的特点,可有效穿透精子细胞膜(陈厚仰等,2014;Rádis-Baptista et al.,2017),但其对精子受精能力的影响尚未明确。因此,探究穿膜肽载体对精子受精能力的影响,对成功安全开展猪精子载体法大量培育转基因猪及有效解决临床医学中异种器官移植的超排斥问题具有重要意义。【前人研究进展】早在20世纪70年代,Brackett等(1971)就将家兔精子与H3标记的SV40基因共培养后进行体外受精,结果发现家兔精子在受精过程中能将外源DNA带入卵母细胞,由此开启了精子介导外源DNA转移的研究工作。但精子载体法一直存在阳性率不高的问题,主要是缺乏有效载体将外源基因送入精子內(Gandolfi,2000)。慢病毒载体是一种外源性的转基因载体,是以人类免疫缺陷I型病毒(HIV-1)为基础构建的载体系统(汤晗等,2017),可有效将外源基因整合到宿主染色体上,但慢病毒有一定细胞毒性及遗传毒性,有报道称慢病毒易导致细胞肿瘤化(Montini et al.,2006)。细胞穿膜肽(Cell-penetrating peptides,CPPs)是一种以内吞方式直接穿过细胞膜的多肽,自1988年被发现以来,已有数百种细胞穿膜肽被发现报道(Wang et al.,2014),根据其结构特点可分为阳离子型、两亲性型和疏水型(Guidotti et al.,2017)。Li等(2018)研究表明,与慢病毒等载体相比,细胞穿膜肽只有在2 μmol/L的高剂量下才表现出细胞毒性。在穿膜活性方面,TAT、MPG-8及Bac-7等穿膜肽能显著将生物活性亲水性分子,如药物、核酸(DNA和RNA)甚至高分子量蛋白,转运至细胞质和细胞器内(梅隽彦,2020)。闫可心等(2021)研究表明穿膜肽R9和TAT均可轻易通过血脑屏障,即以穿膜肽作为药物的高效载体能将药物转运到大脑,使其对大脑有更强更好的药效。除了传导药物外,穿膜肽还能转导外源基因,促使基因和蛋白表达的改变、诱导多能干细胞重编程和分化,以及推进细胞疫苗制备。王军(2013)利用重叠PCR将细胞穿膜肽TAT与c-Myc和Nanog基因片段融合,成功将外源基因Oct4、c-Myc等导入成体细胞使其重编程,最终获得具有类似于干细胞性质的诱导多功能干细胞。陈厚仰等(2014)通过构建细胞穿膜肽TAT与EGFP融合蛋白的原核表达系统,并鉴定其对人类成熟精子的活性,结果表明穿膜肽对精子也有穿膜作用,将外源基因带入人类精子的穿膜效率达65.27%。此外,已有研究证实将精子载体法(Sperm-mediated gene transfer,SMGT)与体外受精(In vitro fertilization,IVF)相结合能高效制备转基因小鼠(Lavitrano et al.,1989),但体外受精需要完全正常的精子才能进行。【本研究切入点】目前,有关细胞穿膜肽作用于精子的研究主要集中在穿膜肽对精子的穿膜活性方面(Jones,2013;陈厚仰等,2014),而针对细胞穿膜肽影响动物精子受精能力及通过体外受精生产转基因胚胎阳性率的研究鲜见报道。【拟解决的关键问题】以水牛Sohlh2基因为目的基因,通过穿膜肽介导转染猪精子后观察转染精子形态特征的变化,使用精子全自动分析系统检测不同载体对转染猪精子各生化指标的影响,并通过体外受精制备转Sohlh2基因猪胚胎,明确修饰基因组通过穿膜肽载体转染精子的可行性及穿膜肽载体对精子和受精卵的影响,为实现安全有效地大批量制备转基因猪胚胎提供技术支撑。
1 材料与方法
1. 1 试验材料
新鲜猪精液由广西畜禽品种改良站采集提供,水牛Sohlh2基因由亚热带生物资源保护利用国家重点试验室克隆获得。猪精液常温稀释剂基础液参照陈东峰(2013)的方法进行配制,具体成分如表1所示。胚胎培养液(PCM):NCSU.23基础液+0.5%牛血清白蛋白(BSA)。卵巢保存及运输液:含K+、Ca2+及Mg2+的生理盐水。受精液(PFM):mTBM液+113.1 mmol/L NaCl+3.0 mmol/L KCl+7.5 mmol/L CaCl2·2H2O+20.0 mmol/L Tris+11.0 mmol/L葡萄糖+5.0 mmol/L丙酮酸钠(含0.5 mmol/L咖啡因和0.2% BSA)。0.1%透明质酸酶:称取100 mg透明质酸酶,以胚胎培养液溶解,最终定容至100 mL。以上配制好的试剂均采用孔径0.22 μm的微孔滤膜过滤消毒,分装后置于4 ℃冰箱保存备用。
1. 2 精液稀释与保存
精液稀释液先在水浴锅中预热,使其温度保持在35.0 ℃左右。采集的猪精液要求在45 min内保温运回实验室,放入水浴锅中静止5 min,以确保与稀释液温度一致。取混匀后的原精液5 µL制片(载玻片和盖玻片先预热至38.0 ℃),通过精子图像分析仪(CASA)对猪精子的活力和密度等进行观察并记录(精子活力要求在0.7以上,密度要求在1.5亿个/mL以上),然后按照3倍稀释的原则对原精液进行稀释,稀释时将稀释液沿着管壁缓慢加入猪精液中,边加入边轻微晃动,使精液与稀释液充分接触(李平等,2020)。猪精液稀释后的密度保持在3.0×107~5.0×107个/mL。在室温环境(20.0~25.0 ℃)下避光放置1 h后进行温度平衡,然后用毛巾包裹数十层,放入17.0 ℃恒温箱中保存(陈东峰,2013)。
1. 3 慢病毒载体构建及包装
采用EcoR I和Xba I分别双酶切pLvx-ires-zsgreen载体和pMD18-T-Sohlh2,回收酶切产物,通过T4连接法将Sohlh2基因连接至pLvx-ires-zsgreen载体上,即构建获得慢病毒载体(pLvx-ires-zsgreen-Sohlh2)。pLvx-ires-zsgreen-Sohlh2逆转录病毒包装:在病毒包装前16~20 h将Plat-GP包装细胞接种至60 mm的细胞培养皿中,并于转染前2~4 h换取3 mL的无血清DMEM。在1 mL的无血清DMEM中加入9 μg 慢病毒载体和9 μL Plus,混匀,室温孵育5 min;再加入12 μL LTX,混匀,室温孵育30 min后均匀滴加至细胞培养皿中;4~6 h后换取正常的培养基;转染48 h后荧光显微镜观察,并收集病毒上清液,0.45 μm滤器过滤备用。
1. 4 精子转染及激光共聚焦扫描显微镜观察
细胞穿膜肽室温放置30 min,于28.0 ℃水浴锅中平衡液体。向1.5 mL的离心管中加入50 μL无血清DMEM及4 μL细胞穿膜肽,同时向另一支1.5 mL的离心管中加入50 μL无血清DMEM及2 μg制备好的Sohlh2基因质粒;混匀2支离心管中的液体,放入37.0 ℃恒温箱中静置20 min。以4 μL去离子水混合50 μL无血清DMEM为对照组。将100 μL转染液体滴加至经3倍稀释猪精液(300 μL)中;混合后的猪精液在室温下避光放置1 h后进行温度平衡,在荧光显微镜450~490 nm激发光下油镜观察涂片。同时利用血细胞计数器计数400个以上猪精子,统计其中的发光精子数量。备用的猪精液以0.85% NaCl洗涤2次后,3500 r/min离心10 min,弃上清液,再沿离心管内壁缓慢加入2.5%戊二醛固定液,4.0 ℃冰箱内固定2~4 h,蒸馏水清洗,以激光共聚焦扫描显微镜进行观察,重点观察精子发光部位。
1. 5 精子质量检测
检测时先将从恒温箱中取出的精液样品放入35.0~37.0 ℃水浴锅中预热20~30 min,用移液枪轻轻吹打精液样品使其混合均匀,随机吸取3~5 μL精液样本滴在载玻片(预热38.0 ℃)上,盖上盖玻片(预热38.0 ℃)后置于恒热加热板上,待精液样品静止稳定再通过精子图像分析仪(CASA)检测精子活率(Motility)、平均曲线运动速度(VCL)、平均直线运动速度(VSL)及前向性(STR)。
1. 6 卵母细胞采集与培养
猪卵巢采自屠宰场的青年母猪,将卵巢放入装有35.0 ℃生理盐水的保温瓶内,运送回实验室的时间控制在1 h内。采用眼科剪去除卵巢周围的脂肪及结缔组织,于超净恒温操作台上用一次性的10 mL注射器抽取直径2~6 mm卵泡内的卵泡液(含卵母细胞),实体视显微镜下挑选出卵母细胞,将具有完整形态的卵丘卵母细胞复合体移入盛有l mL成熟培养液(PMH)的培养皿中,每皿200枚,置于38.5 ℃、5% CO2及最大饱和湿度的培养箱中体外成熟培养24 h,再转移至成熟液(PM)培养22 h。成熟培养结束后,用200 mL移液枪反复吹打去除卵母细胞周围的卵丘细胞,放入添加有0.1%透明质酸酶的胚胎培養液中继续吹打1 min,以除去剩余的卵丘细胞,经培养液洗涤后挑选出具有第一极体的成熟卵母细胞,备用。
1. 7 精子准备处理
将新鲜采集且3倍稀释的猪精液迅速带回实验室,取200 mL稀释精液小心置于含2 mL受精液(预热38.5 ℃)的圆底试管底部,悬浮30 min后将上层液吸出,1900 r/min离心3 min,弃上清液,再添加洗清液至2 mL,800 r/min离心3 min,弃上清液,最后将试管底部的沉淀用1 mL受精液重悬,室温(26.0 ℃)下存放备用。
1. 8 精子顶体染色试剂盒测定猪精子顶体反应
依照ARIC检测试剂盒说明,采用密度梯度离心法联合上游法处理液化好的精液,调整浓度至1×106个/mL后等分成2管,置于5% CO2、37.0 ℃下孵育3 h,以诱导精子获能。其中一管加入钙离子载体A23187诱发15 min(诱发管),另一管不加钙离子载体A23187但同步孵育15 min(自发管),顶体反应结束后,500 r/min离心5 min,PBS清洗1次,然后以50 μL PBS重悬获得精子悬液。涂片(每片10 μL)后在空气中完全干燥,4% PFA室温固定10 min,PBS洗5 min,重复2次。以豌豆凝集素荧光标记(PSA-FITC)4.0 ℃孵育过夜,荧光显微镜450~490 nm激发光下油镜观察涂片以检测精子顶体反应。利用血细胞计数器计数400个以上猪精子,统计诱发顶体发生数量及自发顶体发生数量。自发顶体反应率(%)=自发顶体发生数/检测精子总数×100;诱发顶体反应率(%)=诱发顶体发生数/检测精子总数×100。
1. 9 精子载体法+体外受精(SMGT+IVF)
将预处理的猪精液(约20 μL)与30个具有第一极体的成熟猪卵母细胞置于受精液滴(50 μL)中,精卵比例约1000∶1,置于5% CO2、38.5 ℃和最大饱和湿度的培养箱中共孵育6 h,然后取出以洗卵液充分洗涤,再放入50 μL的胚胎培养液滴中,继续培养观察其发育情况,并做好记录。
1. 10 统计分析
试验数据分别采用SPSS 22.0进行单因素方差分析(One-way ANOVA)及Duncanʼs多重比较。
2 结果与分析
2. 1 转染前后猪精子形态特征的变化情况
3种细胞穿膜肽(C105y、MPG和TAT)转染猪精子24 h的效果如图1所示。经细胞穿膜肽转染后各处理组的猪精子顶体结构完整,细胞膜未见破裂;C105y组、MPG组、TAT组和慢病毒组均有精子发出绿色荧光,在不同细胞穿膜肽(C105y、MPG和TAT)处理组中以穿膜肽C105y转染后获得的发绿色荧光精子数量最多。经统计,C105y组、MPG组、TAT组的猪精子转染阳性率分别为56.74%、50.44%和43.58%,均低于慢病毒组(61.48%),但差异不显著(P>0.05,下同)。图2所示为穿膜肽C105y转染猪精子后其顶体部位发出绿色荧光,说明外源水牛Sohlh2基因已成功转染猪精子。
2. 2 不同穿膜肽载体转染对猪精子活率的影响
采用精子图像分析仪(CASA)检测转染后的猪精子活率,结果如表2所示。3种细胞穿膜肽(C105y、Mpg和TAT)转染24 h的猪精子活率分别为70.09%、66.40%和64.73%,与对照组的猪精子活率(74.02%)差异不显著,以穿膜肽C105y转染对猪精子活率的影响最小;经慢病毒转染24 h后猪精子活率降至60.69%,显著低于对照组和C105y组(P<0.05,下同)。不同载体转染48 h后,猪精子活率呈明显下降趋势,与对照组的差异均达显著差异水平。
2. 3 不同穿膜肽载体转染对猪精子平均直线运动速度的影响
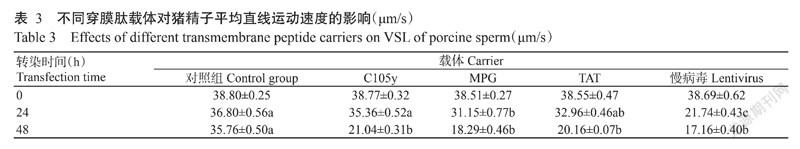
采用精子图像分析仪(CASA)检测转染后的猪精子平均直线运动速度,结果如表3所示。穿膜肽C105y转染24 h,猪精子平均直线运动速度为35.36 μm/s,与对照组相(36.80 μm/s)的差异不显著,但显著高于MPG组(31.15 μm/s)和慢病毒组(21.74 μm/s)。不同载体转染48 h后,转染猪精子平均直线运动速度均显著低于对照组。
2. 4 不同穿膜肽载体转染对猪精子平均曲线运动速度的影响
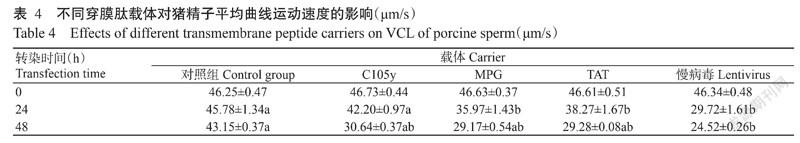
采用精子图像分析仪(CASA)检测转染后的猪精子平均曲线运动速度,结果如表4所示。经穿膜肽C105y转染24 h,猪精子平均曲线运动速度(42.20 μm/s)与对照组(45.78 μm/s)相比差异不显著,而经其他细胞穿膜肽(MPG和TAT)和慢病毒转染后的猪精子平均曲线运动速度与对照组间存在显著差异。不同载体转染48 h后,以慢病毒转染对猪精子平均曲线运动速率的影响最大,与对照组间存在显著差异,而不同细胞穿膜肽(C105y、MPG和TAT)转染的猪精子平均曲线运动速率(30.64、29.17和29.28 μm/s)与对照组相比差异均不显著。
2. 5 不同穿膜肽载体转染对猪精子前向性的影响
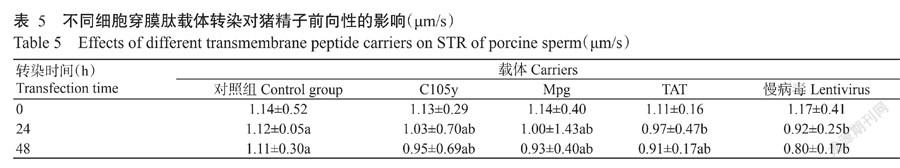
由表5可得知,经穿膜肽TAT和慢病毒转染24 h,猪精子前向性分别为0.97和0.92 μm/s,与对照组(1.12 μm/s)间存在显著差异,但与穿膜肽C105y和MPG转染的猪精子相比差异不显著。至转染48 h后,慢病毒轉染的猪精子前向性(0.80 μm/s)显著低于比对照组(1.11 μm/s),但与不同细胞穿膜肽(C105y、MPG和TAT)转染的猪精子前向性(0.95、0.93和0.91 μm/s)相比差异均不显著。
2. 6 转染后猪精子顶体反应率变化的测定结果
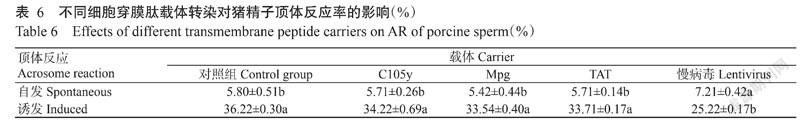
由表6可知,细胞穿膜肽(C105y、MPG和Tat)转染1 h后,猪精子的自发顶体反应率分别为5.71%、5.42%和5.71%,与对照组猪精子的自发顶体反应率(5.80%)无显著差异,而经慢病毒转染后猪精子的自发顶体反应率(7.21%)呈显著上升趋势。在诱发顶体反应率方面,慢病毒转染猪精子的诱发顶体反应率(25.22%)较对照组(36.22%)呈显著下降趋势,而不同细胞穿膜肽转染对猪精子诱发顶体反应率无显著影响。
2. 7 慢病毒和穿膜肽C105y转染对转Sohlh2基因猪胚胎发育的影响
通过体外受精进一步验证不同载体转染制备生产转Sohlh基因猪胚胎的效果,结果发现经慢病毒和穿膜肽C105y转染的猪精子与体外培养成熟猪卵母细胞进行体外受精均能获得受精卵,在荧光显微镜下能观察到均匀的绿色荧光,且慢病毒转染的受精卵发出绿色荧光较强烈(图3),而对照组的受精卵未观察到绿色荧光。转Sohlh基因猪胚胎发育结果(表7)显示,慢病毒和穿膜肽C105y转染的受精卵体外继续培养24 h后,其卵裂率为64.82%和65.91%,与对照组受精卵的卵裂率(64.52%)差异不显著;穿膜肽C105y转染组的囊胚率(15.82%)与对照组(13.80%)间无显著差异,而慢病毒转染组的囊胚率(9.11%)显著低于对照组;在转基因胚胎阳性率方面,穿膜肽C105y转染组显著低于慢病毒转染组(8.54% vs 10.38%)。
3 讨论
3. 1 穿膜肽载体转染方式对猪精子功能的影响
精子载体法是制备转基因猪的重要手段,而介导外源基因进入精子的穿膜肽安全性及其对精子功能的影响,是利用精子载体法+体外受精成功制备转基因猪的关键,目前国内外针对精子正常功能的研究主要涉及精子能动性参数、精子顶体反应及体外受精能力。采用精液稀释剂可有效延长猪精液保存期限。陈东峰(2013)研究表明,使用稀释剂3倍稀释猪精液,7 d后的活精子数(70.84±1.81)与刚稀释時(88.20±1.48)无显著差异,精子质膜完整率及顶体完整率也无显著变化,说明稀释剂能有效延长猪精液保存期限,且对精子的受精能力无显著影响。顶体反应是完成受精的必要条件,不仅促使精子穿透卵母细胞,还能释放顶体内容物中的大量水解酶而激活精子与卵母细胞相互融合,只有发生顶体反应的精子才能完成体外受精(何晨,2020)。已有研究表明,精子在与透明带结合前发生顶体反应会影响其受精能力,因此检测精子是否存在自发顶体反应是判断其受精能力的重要手段(刘树沅等,2018),当精子自发顶体反应率≥9.52%时,其受精能力受到明显影响,需要人工助孕措施(陈其桂等,2020)。在本研究中,慢病毒转染致使猪精子的自发顶体反应率显著升高,而经细胞穿膜肽(C105y、Mpg和Tat)转染的猪精子自发顶体反应率与对照组无显著差异。此外,使用钙离子载体A23187体外诱导Ca2+进入精子内部获能后即发生顶体反应,是世界卫生组织(World health organization,WHO)推荐的精子受精能力评估指标(许世艳等,2021)。Katsuki等(2005)预测表明,体外受精时完全不受精的顶体反应率阈值是21.00%,建议当顶体反应率<21.00%时宜选择人工助孕。本研究结果表明,细胞穿膜肽(C105y、Mpg和TAT)和慢病毒转染的猪精子诱发顶体反应率均在21.00%以上,慢病毒转染的猪精子诱发顶体反应率显著低于对照组,而细胞穿膜肽转染对猪精子诱发顶体反应率无显著影响,说明细胞穿膜肽对猪精子顶体反应的影响不明显。
除了顶体反应外,精子能动性参数也影响其受精能力,包括精子活率、平均直线运动速度、平均曲线运动速度及前向性(陈永霞等,2018)。根据GB/T 25172—2010《猪常温精液生产与保存技术规范》和GB 23238—2009《种猪常温精液》的定义,精子活率是指在37.0 ℃下呈直线前进运动精子数占精子总数的百分率。因此,利用全自动精子分析仪测定猪精液中呈直线前进运动的精子数量即可获知猪常温下的精子活率。精子活率是反映精子质量和衡量转染精子能否受精的一项重要指标。除了常规指标外,动态指标也能间接反映精子的受精能力。胡国娟(2020)研究表明,猪精子能动性参数和正常形态精子的比例与其体外受精率及妊娠率显著相关;范妮等(2021)研究发现精子密度、精子活率、前向运动率及正常形态率与人类精子的受精能力呈正相关。精子活率是精液品质的重要指标,猪的人工授精成功率主要受精子活率的影响,一般要求精子活率在60.00%以上。冯文武等(2021)对长白猪、杜洛克及柯乐猪等3个品种的精子活率和能动性参数进行测定,发现精子的动态指标对其存活时间影响显著,且柯乐猪的精子活率高于其他良种猪。为此,本研究通过测定精子活率、平均曲线运动速度、平均直线运动速度及前向性等指标,以确定各种载体转染对猪精子受精能力的影响,结果表明,C105y、TAT和Mpg等3种细胞穿膜肽转染对猪精子活率的影响相对较小,具体表现为穿膜肽C105y和TAT转染对猪精子直线运动速度影响较小,穿膜肽C105y转染对猪精子平均曲线运动速度影响最小,穿膜肽C105y和Mpg转染对猪精子前向性影响不明显。以慢病毒转染的猪精子各项指标均呈显著下降趋势,说明慢病毒对猪精子有毒性。综上所述,C105y是最适于猪体外受精的穿膜肽载体,对各项指数影响较小。C105y属于疏水性穿膜肽,而疏水性是其高效率运输修饰基因组通过细胞膜到达精子内部的关键(Pärnaste et al.,2017)。Jones等(2013)利用3种穿膜肽(C105y、Cyt c5–13和Camptide)转染处理人类精子3 h,结果发现这3种穿膜肽对精子活率的影响都很小。本研究也发现,经穿膜肽C105y转染24 h,猪精子活率仍高达70.09%,与对照组的猪精子活率差异不显著,即穿膜肽C105y转染对猪精子活率的影响最小。
3. 2 穿膜肽C105y对转Sohlh基因猪胚胎发育的影响
精子的受精能力除了体现在各项指标正常外,更表现在受精卵的正常发育方面,只有制备产生的转基因胚胎阳性率高且不受影响,才能真正体现出穿膜肽既有穿透效率又对精子低毒的价值。精子获取外源基因的能力可因新介质的使用而显著增加(Gong et al.,2018)。最新研究表明,许多穿膜肽已成功将寡核苷酸、蛋白质和载药纳米颗粒等物质运送至哺乳动物细胞群体,精子作为重要的动物细胞群体之一,还具有产生下一代基因载体的作用(Hadar et al.,2018)。精子的运动状态受大剂量DNA抑制影响,究其原因可能是精子内容物受大剂量脂质体的毒性影响。Rostami等(2018)使用新型穿膜肽M918成功将热休克蛋白(Hsp)基因转运至HEK-293T哺乳动物细胞系中,并证实穿膜肽M918的转染效率显著高于单一使用Nef或Hsp20-Nef的转染效率,即穿膜肽M918能有效增加Hsp20-Nef的穿透效果。慢病毒等介质虽然也能有效介导外源基因进入靶细胞内,但对靶细胞具有一定的毒害作用(蔡伟光等,2013)。穿膜肽不仅可有效促使生殖细胞摄取外源基因,且对精子无毒害作用,不影响其受精能力。
本研究以浓缩滴度达108的慢病毒为阳性对照载体,结果显示,慢病毒转染猪精子体外受精获得的转基因胚胎阳性率(10.38%)略高于穿膜肽C105y转染的猪精子(8.54%),但二者差异不显著。由于慢病毒对精子具有一定的毒害作用,因此其受精卵的囊胚率(9.11%)显著低于穿膜肽C105y(15.82%)。冉林武等(2017)研究表明,通过睾丸注射慢病毒载体能制备获得转基因小鼠,其仔代转基因小鼠阳性率最高为35%,即慢病毒孵育精子可得到阳性后代。尽管慢病毒转染效率高,但利用精子载体法进行人工授精时显著影响其受胎率,孙克宁(2011)以慢病毒先孵育精子后进行体外受精,并未得到阳性结果,但采用低滴度的慢病毒(106 TU/mL)转染小鼠受精卵,结果发现受精卵的阳性率为8.3%。此外,慢病毒具有一定的遗传毒性,易导致转基因动物触发癌症(陈彩云等,2012)。本研究采用精子载体法联合体外受精,结果获得8.54%的转基因胚胎阳性率,略高于孙克宁(2011)直接以慢病毒感染受精卵的阳性率,但今后仍需进一步提高转基因胚胎阳性率以满足制备生产转基因猪的需求。
4 结论
穿膜肽C105y对猪精子的受精能力及转基因猪胚胎发育影响小,且毒害作用不明显,是一个能高效转导外源基因的安全载体。
参考文献:
蔡伟光,习欠云,肖敏,关立增,孟繁明,束刚,朱晓彤,江青艳,吴珍芳,张永亮. 2013. 精子与慢病毒共孵育条件的优化以及转基因猪的制备[J]. 中国农业科学,46(9):1903-1914. [Cai W G,Xi Q Y,Xiao M,Guan L Z,Meng F M,Shu G,Zhu X T,Jiang Q Y,Wu Z F,Zhang Y L. 2013. Optimization of incubation of sperm and lentivirus and transgenic pigs production[J]. Scientia Agricultura Sinica,46(9):1903-1914.] doi:10.3864/j.issn. 0578-1752.2013.09.018.
陳彩云,刘亚京,牛忠英. 2012. 慢病毒载体的研究进展及应用[J]. 口腔颌面修复学杂志,13(2):117-120. [Chen C Y,Liu Y J,Niu Z Y. 2012. Research progress and application of lentivirus vector[J]. Chinese Journal of Prostho-dontics,13(2):117-120.] doi:10.3969/j.issn.1009-3761. 2012.02.017.
陈东峰. 2013. 公猪精液在不同温度下保存和稀释剂添加不同添加剂保存公猪精液后的一些生理生化变化[D]. 南宁:广西大学. [Chen D F. 2013. The physiological and biochemical variations of boar sperm which diluted by extenders with different additives and stored under diffe-rent temperature[D]. Nanning:Guangxi University.] doi:10.7666/d.Y2407959.
陈厚仰,仇克清,孙捷,黄志辉,应志伟,吴丽萍,曾韩,伍琼芳. 2014. 穿膜肽EGFP的构建及其对人成熟精子的穿膜活性鉴定[J]. 中国男科学杂志,28(11):8-13. [Chen H Y,Qiu K Q,Sun J,Huang Z H,Ying Z W,Wu L P,Zeng H,Wu Q F. 2014. Construction of CPPs EGFP and veriifcation of its transmembrane activity on human mature sperm[J]. Chinese Journal of Andrology,28(11):8-13.] doi:10.3969/j.issn.1008-0848.2014.11.002.
陈其桂,李大文,谭卫红,成俊萍,薛林涛,李金燕,何泳志,庞太森,韦福,黄泰帅. 2020. 精子正常形态率、顶体完整率及顶体反应率与补救ICSI结局相关性研究[J]. 生殖医学杂志,29(12):1581-1586. [Chen Q G,Li D W,Tan W H,Cheng J P,Xue L T,Li J Y,He Y Z,Pang T S,Wei F,Huang T S. 2020. Relationship between normal sperm morphology rate,sperm acrosome integrity rate,acrosome reaction rate and outcome of rescue ICSI[J]. Journal of Reproductive Medicine,29(12):1581-1586.] doi:10.3969/j.issn.1004-3845.2020.12.008.
陈永霞,张群,马静,杨剑波,邢军,吴井生. 2018. 不同品种公猪精子活力的定量检测和比较[J]. 黑龙江畜牧兽医,(10):71-74. [Chen Y X,Zhang Q,Ma J,Yang J B,Xing J,Wu J S. 2018. Quantitative detection and comparison of sperm motility of different boars[J]. Heilongjiang Animal Science and Veterinary Medicine,(10):71-74.] doi:10.13881/j.cnki.hljxmsy.2017.08.0370.
范妮,张海波,王康扬,符雄. 2021. 抗精子抗体与精子密度、精子活率、精子正常形态及人工授精助孕结局关系[J]. 中国计划生育学杂志,29(10):2109-2111. [Fan N,Zhang H B,Wang K Y,Fu X. 2021. Relationship between anti-sperm antibody positive rate, concentration of sperm, forward motility of sperm, and atypical forms of sperm of the man and their pregnancy outcomes after artificial insemination[J]. Chinese Journal of Family Planning,29(10):2109-2111.] doi:10.3969/j.issn.1004-8189. 2021.10.022.
馮文武,李平,陈大芳,李俊,杨蓉,蒋桂荣,王钦,苏娜芬. 2021. 柯乐猪与国外品种猪精子活力的比较分析[J]. 养猪,(3):47-49. [Feng W W,Li P,Chen D F,Li J,Yang R,Jiang G R,Wang Q,Su N F. 2021. Study on the comparison of Kele boar sperm vitality with two foreign species[J]. Swine Production,(3):47-49.] doi:10.3969/j.issn. 1002-1957.2021.03.019.
高晗,钟蓓. 2020. 转基因技术和转基因动物的发展与应用[J]. 现代畜牧科技,(6):1-4. [Gao H,Zhong B. 2020. The development and application of transgenic techno-logy and transgenic animals[J]. Modern Animal Husban-dry Science & Technology,(6):1-4.] doi:10.19369/j.cnki. 2095-9737.2020.06.001.
何晨. 2020. AC220和ZK 93426对精子获能和顶体反应的影响研究[D]. 上海:上海交通大学. [He C. 2020. Effects of AC220 and ZK 93426 on sperm capacitation and acrosome reaction[D]. Shanghai :Shanghai Jiaotong University.] doi:10.27307/d.cnki.gsjtu.2020.003649.
胡国娟. 2020. 不同影响因素下大白猪精子活力和保存时间的研究[J]. 甘肃畜牧兽医,50(1):66-69. [Hu G J. 2020. Study on sperm viability and preservation time of large white pigs under different influencing factors[J]. Gansu Animal and Veterinary Sciences,50(1):66-69.] doi:10. 3969/j.issn.1006-799X.2020.01.025.
兰宗宝,王修文,许惠艳. 2008. 猪器官异种移植研究进展[J]. 广西农业科学,39(3):380-384. [Lan Z B,Wang X W,Xu H Y. 2008. Progress of porcine organs xenotransplantation[J]. Guangxi Agricultural Sciences,39(3):380-384.] doi:10.3969/j.issn.2095-1191.2008.03.030
李平,唐明宗,申金容,陈大芳,龙清孟,曾金,张云淞,时颖,吴光松,李维. 2020. 不同检测时间下种猪常温精液精子活力的研究[J]. 养猪,(5):33-35. [Li P,Tang M Z,Shen J R,Chen D F,Long Q M,Zeng J,Zhang Y S,Shi Y,Wu G S,Li W. 2020. Study on sperm motility of normal temperature semen of breeding pigs at different detection times[J]. Swine Production,(5):33-35.] doi:10.3969/j.issn.1002-1957.2020.05.011.
刘树沅,韦剑洪,陈伟辉,霍骏业. 2018. 精子自发顶体反应率与体外受精胚胎质量的相关性研究[J]. 检验医学与临床,15(1):16-18. [Liu S Y,Wei J H,Chen W H,Huo J Y. 2018. Correlation between sperm spontaneous acrosome reaction and in vitro fertilization embryo quality[J]. Laboratory Medicine and Clinic,15(1):16-18.] doi:10.3969/j.issn.1672-9455.2018.01.005.
梅隽彦. 2020. 基于细胞穿膜肽的药物递送研究进展[J]. 广州化学,45(2):64-75. [Mei J Y. 2020. Advances in drug delivery based on cell-penetrating peptides[J]. Guangzhou Chemistry,45(2):64-75.] doi:10.16560/j.cnki.gzhx.2020 0213.
潘斌,杨辉,郭亚芬,范晶,兰干球,蒋钦杨,朱祁明,王爱德. 2011. 4个品种猪血清中sLAIR-1表达量的ELISA检测[J]. 南方农业学报,42(1):102-104. [Pan B,Yang H,Guo Y F,Fan J,Lan G Q,Jiang Q Y,Zhu Q M,Wang A D. 2011. ELISA detection of sLAIR-1 expression in the serum of four swine species[J]. Journal of Southern Agriculture,42(1):102-104.] doi:10.3969/j.issn.2095-1191. 2011.01.024.
冉林武,张文文,荣瑞奇,姚涛贵,杨文,陈健茂,李红兵. 2017. 睾丸注射慢病毒载体制备转基因小鼠研究[J]. 宁夏医科大学学报,39(1):34-37. [Ran L W,Zhang W W,Rong R Q,Yao T G,Yang W,Chen J M,Li H B. 2017. Study on generation of transgenic mice by intratesticular injection of lentiviral vector[J]. Journal of Ningxia Medical University,39(1):34-37.] doi:10.16050/j.cnki.issn 1674-6309.2017.01.009.
孙克宁. 2011. 利用慢病毒载体制备转基因小鼠和牛胚胎的研究[D]. 郑州:河南农业大学. [Sun K N. 2011. Study on the generation of transgenic embryos of cattle and mouse with lentiviral vector[D]. Zhengzhou:Henan Agricultural University.] doi:10.7666/d.y1999567.
孙武,娜日苏. 2015. 转基因猪的研究进展[J]. 畜牧与兽医,47(4):134-137. [Sun W,Na R S. 2015. Progress in research of transgenic pig[J]. Animal Husbandry & Veterinary Medicine,47(4):134-137.]
湯晗,聂建云,李文斌,董凤萍. 2017. 慢病毒载体系统的发展及在肿瘤基因治疗中的应用[J]. 现代肿瘤医学,25(10):1659-1662. [Tang H,Nie J Y,Li W B,Dong F P. 2017. Research progress of lentiviral vector system based on HIV-1[J]. Journal of Modern Oncology,25(10):1659-1662.] doi:10.3969/j.issn.1672-4992.2017.10.038.
王军. 2013. 细胞穿膜肽TAT与诱导多功能干细胞相关转录因子的融合表达及其穿膜能力研究[D]. 无锡:江南大学. [Wang J. 2013. Fusion expression and penetrating ability study of cell penetrating peptide TAT and induced pluripotent stem cell transcriptional factors[D]. Wuxi:Jiangnan University.]
许世艳,涂文娇,朱科衡,刘瑜. 2021. 精子功能指标在辅助生殖助孕方式选择中的作用[J]. 生殖医学杂志,30(3):337-342. [Xu S Y,Tu W J,Zhu K H,Liu Y. 2021. Effect of sperm function parameters on selection of assisted reproductive methods[J]. Journal of Reproductive Medicine,30(3):337-342.] doi:10.3969/j.issn.1004-3845.2021. 03.010.
闫可心,闫宗斌,韩金成,张雪梅,薛书江,许应天. 2021. 细胞穿膜肽作为载体的研究进展[J]. 特产研究,43(6):147-150. [Yan K X,Yan Z B,Han J C,Zhang X M,Xue S J,Xu Y T. 2021. Research progress of cell penetrating peptides as carriers[J]. Special Wild Economic Animal and Plant Research,43(6):147-150.] doi:10.16720/j.cnki.tcyj. 2021.147.
Brackett B G,Baranska W,Sawicki W,Koprowski H. 1971. Uptake of heterologous genome by mammalian spermatozoa and its transfer to ova through fertilization[J]. Proceedings of the National Academy of Sciences of the United States of America,68(2):353-357. doi:10.1073/pnas.68.2.353.
Chaparian S,Abdulahnejad A,Rashidi F,Toghyani M,Gheisari A,Eghbalsaied S. 2016. Is passive transmission of non-viral vectors through artificial insemination of sperm-DNA mixtures sufficient for chicken transgenesis?[J]. The Journal of Reproduction & Development,62(3):265-270. doi:10.1262/jrd.2015-176.
Gandolfi F. 2000. Sperm-mediated transgenesis[J]. Theriogeno-logy,53(1):127-137. doi:10.1016/s0093-691x(99)00246-0.
Gong Z F,Ikongmova S P,Karlsson A J. 2018. Secondary structure of cell-penetrating peptides during interaction with fungal cells[J]. Protein Science,27(3):702-713. doi:10.1002/pro.3364.
Guidotti G,Brambilla L,Rossi D. 2017. Cell-penetrating peptides:From basic research to clinics[J]. Trends in Pharmacological Sciences,38(4):406-424. doi:10.1016/j.tips. 2017.01.003.
Hadar M,de Laté P L,Kennedy E J,Langsley G. 2018. Cell penetratingpeptides to dissect host-pathogen protein-protein interactions in Theileria-transformed leukocytes[J]. Bioorganic & Medicinal Chemistry,26(6):1127-1134. doi:10.1016/j.bmc.2017.08.056.
Harel-Markowitz E,Gurevich M,Shore L S. 2009. Use of sperm plasmid DNA lipofection combined with REMI (restriction enzyme-mediated insertion) for production of transgenic chickens expressing eGFP(enhanced green fluorescent protein) or human follicle-stimulating hormone[J]. Biology of Reproduction,80(5):1046-1052. doi:10. 1095/biolreprod.108.070375.
Jones S,Lukanowska M,Suhorutsenko J,Oxenham S,Barratt C,Publicover S,Copolovici D M,Langel Ü,Howl J. 2013. Intracellular translocation and differential accumulation of cell-penetrating peptides in bovine spermatozoa:Evaluation of efficient delivery vectors that do not compromise human sperm motility[J]. Human Reproduction,28(7):1874-1889. doi:10.1093/humrep/det064.
Katsuki T,Hara T,Ueda K,Tanaka J,Ohama K. 2005. Prediction of outcomes of assisted reproduction treatment using the calcium ionophore-induced acrosome reaction[J]. Human Reproduction,20(2):469-475. doi:10.1093/humrep/deh636.
Lavitrano M,Camaioni A,Fazio V M,Dolci S,Farace M G,Spadafora C. 1989. Sperm cells as vectors for introducing foreign DNA into eggs:Genetic transformation of mice[J]. Cell,57(5):717-7231. doi:10.1016/0092-8674(89)90787-3.
Lavitrano M,Forni M,Bacci M L,Di Stefano C,Varzi V,Wang H J,Seren E. 2003. Sperm mediated gene transfer in pig:Selection of donor boars and optimization of DNA uptake[J]. Molecular Reproduction and Development,64(3):284-291. doi:10.1002/mrd.10230.
Li Z Z,Wang X,Teng D,Mao R Y,Hao Y,Yang N,Chen H x,Wang X M,Wang J H. 2018. Improved antibacterial activity of a marine peptide-N2 against intracellular Salmonella typhimurium by conjugating with cell-penetrating peptides-bLFcin6/Tat11[J]. European Journal of Medicinal Chemistry,145(10):263-272. doi:10.1016/j.ejmech.2017. 12.066.
Montini E,Cesana D,Schmidt M,Sanvito F,Ponzoni M,Bartholomae C,Sergi L S,Benedicenti F,Ambrosi A,Di Serio C,Doglioni C,von Kalle C,Naldini L. 2006. Hematopoietic stem cell gene transfer in a tumor-prone mouse model uncovers low genotoxicity of lentiviral vector integration[J]. Nature Biotechnology,24(6):687-696. doi:10. 1038/nbt1216.
Pärnaste L,Arukuusk P,Langel K,Tenson T,Langel Ü. 2017. The formation of nanoparticles between small interfering RNA and amphipathic cell-penetrating peptides[J]. Molecular Therapy,7:1-10. doi:10.1016/j.omtn.2017.02.003.
Rádis-Baptista G,Campelo I S,Morlighem J É R L,Melo L M,Freitas V J F. 2017. Cell-penetrating peptides (CPPs):From delivery of nucleic acids and antigens to transduction of engineered nucleases for application in transgenesis[J]. Journal of Biotechnology,252(20):15-26. doi:10.1016/j.jbiotec.2017.05.002.
Rostami B,Irani S,Bolhassani A,Cohan R A. 2018. M918:A novel cell penetrating peptide for effective delivery of HIV-1Nef and Hsp20-Nef proteins into eukaryotic cell lines[J]. Current HIV Research,16(4):280-287. doi:10. 2174/1570162X17666181206111859.
Servick K. 2022. Hereʼs how scientists pulled off the first pig-to-human heart transplant[J]. Science. doi:10.1126/science.ada0089.
Shen W,Li L,Pan Q J,Min L J,Dong H S,Deng J X. 2006. Efficient and simple production of transgenic mice and rabbits using the new DMSO-sperm mediated exogenous DNA transfer method[J]. Molecular Reproduction and Development,73(5):589-594. doi:10.1002/mrd.20401.
Sperandio S,Lulli V,Bacci M L,Forni M,Maione B,Spadafora C,Lavitrano M.1996. Sperm-mediated DNA transfer in bovine and swine species[J]. Animal Biotechnology,7(1):59-77. doi:10.1080/10495399609525848.
Wang F H,Wang Y,Zhang X,Zhang W J,Guo S R,Jin F. 2014. Recent progress of cell-penetrating peptides as new carriers for intracellular cargo delivery[J]. Journal of Controlled Release,174:126-136. doi:10.1016/j.jconrel.2013. 11.020.
收稿日期:2022-01-20
基金项目:国家自然科学基金项目(31860644);国家现代农业产业技术体系广西创新团队建设项目(nycytxgxcxtd-2021-09-01);广西自然科学基金项目(2019GXNSFDA185002)
通讯作者:韦英明(1962-),https://orcid.org/0000-0003-4458-9139,研究员,主要从事动物遗传育种与繁殖研究工作,E-mail:dkywym@163.com;杨素芳(1972-),https://orcid.org/0000-0002-4648-0201,博士,教授,主要从事动物遗传育种与繁殖研究工作,E-mail:85997362@qq.com
第一作者:陳集成(1986-),https://orcid.org/0000-0002-9091-1013,研究方向为动物遗传育种与繁殖,E-mail:2035977949@qq.com
