陆川猪和杜长大猪Nrf2基因克隆及其在背最长肌中的表达分析
2022-07-14涂羽昂蔡沛燃余嘉懿罗云彦蒋钦杨黄艳娜
涂羽昂 蔡沛燃 余嘉懿 罗云彦 蒋钦杨 黄艳娜






摘要:【目的】明確核因子NF-E2相关因子(Nrf2)基因生物学特性,并探究其在陆川猪和杜长大猪背最长肌中的表达差异,为深入研究陆川猪优质肌肉抗氧化性能的分子机制打下基础。【方法】以150日龄的陆川猪和杜长大猪背最长肌组织总RNA为模板,分段克隆Nrf2基因编码区(CDS)序列,并通过ExPASy ProtScale、ExPASy ProtParam及SWISS-MODEL等在线软件进行生物信息学分析,同时应用实时荧光定量PCR和Western blotting检测Nrf2基因在150日龄陆川猪和杜长大猪背最长肌中的表达差异。【结果】陆川猪和杜长大猪Nrf2基因CDS序列长1686 bp,与GenBank中已公布的野猪、杜长大猪、牛、绵羊、黑猩猩、猕猴、狼、人类、家鼠、大白鼠、鸵鸟和普通家鸡的Nrf2基因CDS序列的同源相似性分别为99.7%、99.5%、91.2%、90.6%、90.5%、90.1%、89.5%、86.5%、81.9%、81.7%、72.0%和70.6%。陆川猪与杜长大猪的遗传距离最近,与狼的遗传距离最远。陆川猪和杜长大猪的Nrf2蛋白都由561个氨基酸组成,且以丝氨酸含量最高,占比12.5%,色氨酸含量最低,仅占0.4%,均具有较强的亲水性。在Nrf2蛋白二级结构中,杜长大猪Nrf2蛋白的无规则卷曲占57.75%,α-螺旋占34.05%,延伸链占5.35%,β-转角占2.85%;陆川猪Nrf2蛋白的无规则卷曲占57.93%,α-螺旋占33.51%,延伸链占6.06%, β-转角占2.50%。150日龄陆川猪背最长肌中Nrf2基因相对表达量显著高于同日龄杜长大猪背最长肌中Nrf2基因的相对表达量(P<0.05);且陆川猪Nrf2蛋白表达量极显著高于同日龄杜长大猪背最长肌中Nrf2蛋白表达量(P<0.01)。【结论】成功克隆陆川猪和杜长大猪Nrf2基因CDS序列,陆川猪背最长肌中Nrf2基因表达量显著高于同日龄杜长大猪,推测陆川猪肌肉具有比杜长大猪更加优良的抗氧化性能。
关键词: 陆川猪;杜长大猪;核因子NF-E2相关因子;基因克隆;生物信息学分析;抗氧化性能;实时荧光定量PCR
中图分类号: S828.89 文献标志码: A 文章编号:2095-1191(2022)04-0908-10
Cloning and expression analysis of Nrf2 gene in longissimus dorsi of Luchuan pig and Duroc×Landrace×Yorkshire pig
TU Yu-ang, CAI Pei-ran, YU Jia-yi, LUO Yun-yan, JIANG Qin-yang, HUANG Yan-na*
(College of Animal Science and Technology, Guangxi University, Nanning, Guangxi 530004, China)
Abstract:【Objective】To clarify biological characteristics of NF-E2-related factor (Nrf2) gene in Luchuan pig and Duroc×Landrace×Yorkshire(DLY)pig,and to explore the expression difference of Nrf2 gene in longissimus dorsi muscle of Luchuan pig and DLY pig, so as to lay a foundation for further study on the molecular mechanism of antioxidant properties of high-quality Luchuan pig muscle. 【Method】The coding DNA sequence(CDS), sequence of Nrf2 gene was cloned from the total RNA of longissimus dorsi muscle of 150-day-old Luchuan pigs and the same day old DLY pigs,and the bioinformatics analysis was carried out through online softweres ExPASy ProtScale,ExPASy ProtParam and SWISS-MODEL. The expression difference of Nrf2 gene in the longissimus dorsi muscle of 150-day-old Luchuan pigs and the DLY pigs of the same age was detected by qRT-PCR and Western-blotting. 【Result】The length of the CDS of Nrf2 gene of Luchuan pig and DLY pig was 1686 bp,which was compared with the CDS sequences of Sus scrofa, DLY pig, cattle,sheep, Chimpanzee,macaque,wolf,human,domestic rat,Rattus norvegicus,ostrich,ordinary domestic chicken that published in GenBank. The similarity were, 99.7%, 99.5%, 91.2%, 90.6%, 90.5%, 90.1%, 89.5%, 86.5%, 81.9%, 81.7%, 72.0% and 70.6%,respeetively. The genetic distance between Guangxi Luchuan pig and DLY pig was the nearest,and the farthest was Canis lupus. Nrf2 protein of DLY pig and Luchuan pig was composed of 561 amino acids,and serine was the highest in the amino acid content,accounting for 12.5%,and tryptophan was the lowest,accounting for only 0.4%. In the secondary structure of Nrf2 protein,random coil accounted for 57.75%,α-helix accounted for 34.05%,extended strand accounted for 5.35%,β-turn accounted for 2.85% in DLY pig Nrf2 protein. The percentage of random coil,α-helix,extended strand and β-turn were 57.93%,33.51%,6.06% and 2.50% respectively in Luchuan pig Nrf2 protein;The relative expression of Nrf2 gene in longissimus dorsi muscle of 150-day-old Luchuan pigs was significantly higher than that of DLY pigs(P<0.05);The expression of Nrf2 protein in the longissimus dorsi muscle of 150-day-old Luchuan pigs was extremely significantly higher than that of DLY pigs(P<0.01). 【Conclusion】Nrf2 gene CDS seqnence of Luchuan pig and DLY pig are cloned successfully,and the expression of Nrf2 in Luchuan pig is significantly higher than that in DLY pig at the same age. It is suggested that the muscle of Luchuan pig has better antioxidant activity than that of DLY pig.
Key words: Luchuan pig; Duroc×Landrace×Yorkshire(DLY) pig; nuclear factor erythroid 2-related factor 2; gene cloning; bioinformatics analysis; oxidation resistance;real-time fluorescence quantitative PCR
Foundation items: National Natural Science Foundation of China(31760672); Guangxi Natural Science Foundation Project(2022GXNSFAA035525)
0 引言
【研究意义】畜禽机体在遭受某种氧化反应刺激时,可能会产生过量的亲电体和活性氧自由基(ROS),抗氧化系统清除这些亲电体和ROS时可引起机体内氧化还原态破坏、抗氧化系统稳态失衡(Harrison,2002),导致体内脂质过氧化水平显著升高、核苷酸和染色体氧化损伤及氨基酸和蛋白质损伤破坏等,使机体产生各种组织生理性病变,胴体品质严重下降(Hernández et al.,2004;Rowe et al.,2004)。面对氧化应激,机体形成一套复杂的抗氧化防御机制,能有效控制ROS水平,防止其水平过高和在机体内累积,其中核因子NF-E2相关因子(NF-E2-related factor 2,Nrf2)是重要的转录因子,具有氧化还原敏感性,可通过Keap1-Nrf2/ARE信号通路诱导调控细胞内I/II/III相解毒酶和抗氧化酶等抗氧化性基因的转录激活,使细胞由氧化应激状态逐渐恢复至常规细胞状态(窦彩霞等,2019)。细胞抵御氧化应激关键性通路是Keap1-Nrf2/ARE信号通路(Sajadimajd and Khazaei et al.,2017),普遍认为Keap1-Nrf2/ARE信号通路是预防和治疗因氧化应激和炎症引发疾病的关键(Goldstein et al.,2016)。因此,研究陆川猪Nrf2并克隆Nrf2序列信息,利用生物信息学方法分析Nrf2基因结构,探明其在肌肉组织中的表达规律,对揭示陆川猪优良肌肉抗氧化能力的分子机制具有重要意义。【前人研究进展】Keap1-Nrf2/ARE信号通路的活化机制分为两种:第一种是减弱对Nrf2的泛素化降解作用,当氧化物和亲电基团与Keap1蛋白的IVR链接结构域反应时,273Cys和288Cys 2个半胱氨酸残基发生突变,导致Nrf2泛素化和抑制作用降低,从而促使Nrf2基因活化(齐晓龙,2013;李慧和杨林,2018);第二种是Nrf2的磷酸化作用,Nrf2在蛋白激酶途径中发生磷酸化作用,Neh2的Ser-40磷酸化导致Keap1-Nrf2连接破坏,从而致使Nrf2活化(Jain and Jaiswal,2007)。Nrf2广泛存在于机体细胞和组织内(Manna et al.,2019),可调节畜禽抗氧化应激和代谢功能,在肾损伤和糖尿病保护中起关键作用(Wu et al.,2015);还可阻止和预防肿瘤的形成(Wang et al.,2017),缺乏Nrf2的小鼠更易患化学致癌物引发的癌症(Xu,2006),Nrf2能阻止小鼠肺癌基因的表达(Shibata et al.,2008);但也有研究表明癌细胞会利用Keap1-Nrf2/ARE信号通路促进细胞增生和增长,从而帮助癌症基因的激活导致细胞增殖,在癌症发生过程中具有两面性(DeNicola et al.,2011;Kim and Keum,2016);Nrf2还可调控畜禽抗炎症能力,调节免疫系统和大量的细胞内蛋白质降解系统(Wu et al.,2012),抑制机体炎症反应(Subedi et al.,2019)。【本研究切入点】Nrf2基因由于在抗氧化应激保护动物健康中发挥重要作用而日益受到国内外学者的广泛关注,但目前针对陆川猪与商用猪种抗氧化性能差异的研究较少,也未见关于陆川猪Nrf2基因克隆及其在肌肉组织内表达规律的研究报道。【拟解决的关键问题】分别克隆陆川猪和杜长大猪Nrf2基因编码区(CDS)序列,利用实时荧光定量PCR及Western blotting检测Nrf2基因或蛋白在陆川猪和杜长大猪背最长肌中的相对表达差异,为深入研究陆川猪优良肌肉抗氧化能力的分子機制打下基础。
1 材料与方法
1. 1 试验材料
选取150日龄的陆川猪和杜长大猪各6头,取其背最长肌组织,屠宰取样后液氮速冻,后置于冰箱 -80 ℃存储,备用。SYBR® Premix Ex TaqTM II、Taq酶、总RNA抽提试剂、RT-PCR试剂盒、pMD19-T载体等购自日本TaKaRa公司;聚丙烯酰胺凝胶、无RNA酶水、裂解液、PVDF膜、5×预配电泳液、20×预配TBST等购自北京索莱宝科技有限公司;DL2000 DNA Marker购自广州东盛生物科技有限公司;Protein Ladder购自赛默飞世尔科技公司;通用型DNA回收试剂盒购自上海捷瑞生物工程有限公司;感受态细胞购自北京全式金生物技术有限公司;琼脂糖购自上海博晗生物科技有限公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;ECl显色液购自北京康为世纪生物科技有限公司;GAPDH Monoclonal、HRP Goat Anti-Mouse IgG(H+L),Nrf2 Rabbit pAb,HRP Goat Anti-Rabbit IgG(H+L)购自武汉爱博泰克生物科技有限公司;2×Taq Master Mix购自江苏康为世纪生物科技有限公司。主要仪器设备:电子分析天平购自上海舜宇恒平科学仪器有限公司;ChemiDoc MP全能型成像系统、普通PCR仪、CFX96荧光定量PCR仪、垂直电泳系统、96孔板等购自美国Bio-Rad公司;超微量分光光度计购自Quawell公司;超低温冰箱购自青岛海尔集团有限公司;低温组织研磨仪购自宁波新芝生物科技股份有限公司;数显型恒温水浴锅购自江苏省金坛市医疗仪器厂;高速低温离心机、移液枪购自德国艾本德股份公司;超净工作台购自苏州净化设备有限公司;恒温鼓风干燥箱、恒温培养箱购自上海跃进医疗器械有限公司;凝胶电泳自动成像系统购自美国UVP公司;温控摇床、细胞培养箱购自赛默飞世尔科技公司;高压灭菌锅购自日本HIRAYAMA公司;电泳仪EC250-90、转印电泳仪、双稳定型电泳仪电源购自北京六一生物科技有限公司。
1. 2 引物设计与合成
依照GenBank中野猪Nrf2基因序列(登录号:XM_021075133.1),利用 Oligo 7设计2对克隆特异性引物和荧光定量PCR引物,参考黄艳娜(2011)的方法设计18S rRNA序列(登录号AY_265350.1)扩增引物(表1)。所有引物均委托生工生物工程(上海)股份有限公司合成。
1. 3 总RNA提取及cDNA合成
采用TRIzol法分别提取陆川猪和杜长大猪背最长肌总RNA,并进行RNA浓度测定分析和1%琼脂糖凝胶电泳检测,选择浓度和纯度合适的RNA样品进行RT-PCR。定量反转录体系(分为2个程序)总体积20.0 μL:第一步反应体系(去除基因组DNA):无RNA酶水5.0 μL,5×gRNA Eraser Buffer 2.0 μL,总RNA 2.0 μL,gDNA Eraser 1.0 μL,共10.0 μL;42 ℃ 120 s,4 ℃保存。第二步反应体系(反转录):上一步反应液10.0 μL,5×Primescript Buffer II 4.0 μL,无RNA酶水4.0 μL,Primescript RT Enzyme Mix 1.0 μL,RT Primer Mix 1.0 μL,共20.0 μL;37 ℃ 15 min,85 ℃ 5 s。cDNA置于4 ℃保存。
1. 4 陆川猪和杜长大猪Nrf2基因PCR扩增
对陆川猪和杜长大猪背最长肌Nrf2基因分2段进行PCR扩增。反应体系10.0 μL:2×Taq Master Mix 5.0 μL,无RNA酶水3.0 μL,cDNA模板 1.0 μL,上、下游引物各0.5 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,56.1 ℃ 40 s,72 ℃ 60 s,进行35个循环;72 ℃延伸5 min。扩增产物采用1.5%琼脂糖凝胶电泳进行检验,在成像仪上使用紫外线灯标识目标条带,切取目的片段,使用胶回收试剂盒进行凝胶回收纯化。
1. 5 陆川猪和杜长大猪Nrf2基因测序
将纯化产物与克隆载体连接,连接体系10.0 μL:Solution I 5.0 μL,扩增纯化产物4.0 μL,pMD19-T载体1.0 μL。取过夜的10.0 μL连接产物,加入30.0~50.0 μL已融化的大肠杆菌DH5α感受态细胞,冰上静置转化后热休克,再将带有克隆片段的细胞进行复苏和增殖,LA培养基上涂板培养,12 h后挑选形态规则的单个菌落扩大培养,再以挑取菌液为模板进行PCR验证。反应体系:2×Taq MasterMix 5.0 μL,无RNA酶水 3.5 μL,菌液0.5 μL,上、下游引物各0.5 μL,共10.0 μL,扩增程序与1.3相同。PCR扩增产物采用1.5%琼脂糖凝胶电泳进行鉴定,将鉴定呈阳性的克隆菌液送至生工生物工程(上海)股份有限公司测序。
1. 6 陆川猪和杜长大猪Nrf2基因生物信息学分析
1. 6. 1 基因序列比对分析 克隆菌液经测序后,利用Lasergene 10拼接杜长大猪和陆川猪Nrf2基因核苷酸序列,再将陆川猪Nrf2基因CDS序列与杜长大猪和GenBank中登录的野猪Nrf2基因(XM_003133500.6)CDS序列进行比对和翻译。
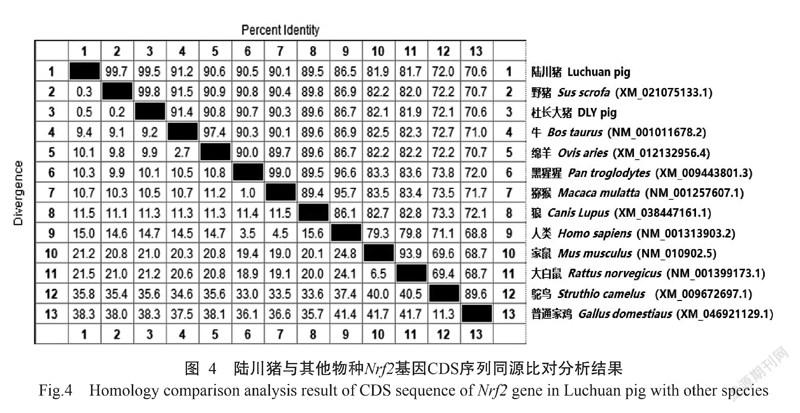
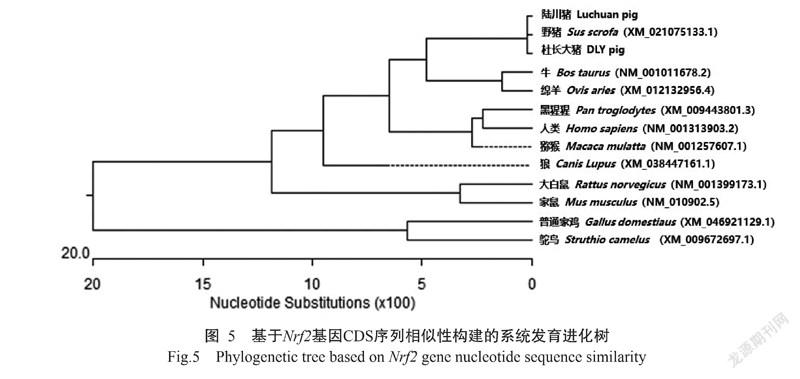
1. 6. 2 同源比对分析及系统发育进化树构建 使用MegAlign检测陆川猪和杜长大猪Nrf2基因的CDS序列,与GenBank上已公布的野猪(XM_003133500.6)、白鱀豚(XM_007451098.1)、独角鲸(XM_00292255 16.1)、维基尼亚鹿(XM_020871000.1)、印度瘤牛(XM_019970314.1)、黄牛(XM_005202312.4)、人类(NM_006164.5)、黑猩猩(XM_009443801.3)、东非狒狒(XM_031651381.1)和狼(XM_038447161.1)的Nrf2基因CDS序列进行同源比对分析,根據相似性构建Nrf2基因系统发育进化树。
1. 6. 3 Nrf2蛋白基本理化性质及亲/疏水性分析
采用ExPASy ProtScale(https://web.expasy.org/prots-cale/)和ExPASy ProtParam(https://web.expasy.org/protparam/)分别预测分析陆川猪和杜长大猪Nrf2蛋白的亲/疏水性和氨基酸组成、一级结构、理论等电点(pI)和蛋白分子亲水性的总平均值等基本信息。
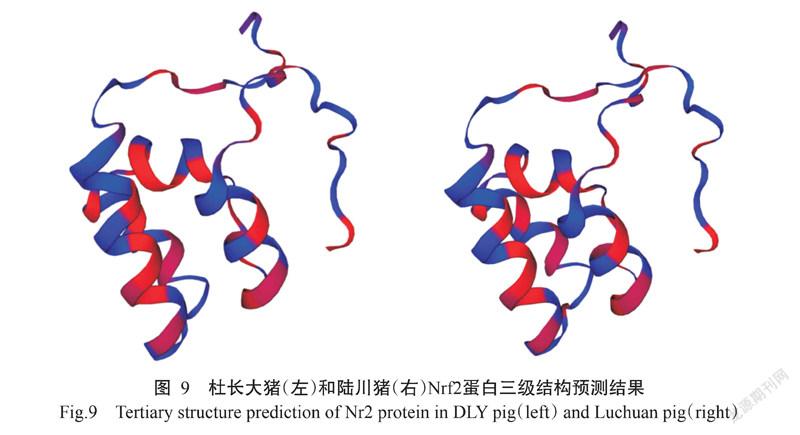
1. 6. 4 Nrf2蛋白高级结构预测 通过NPS@的SOPMA SECONDARY STRUCTURE PREDICTION METHOD在线程序(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL在线程序(https://swissmodel.expasy.org/)分别预测分析陆川猪和杜长大猪Nrf2蛋白的二级和三级结构。
1. 7 陆川猪和杜长大背最长肌组织中Nrf2基因表达量检测
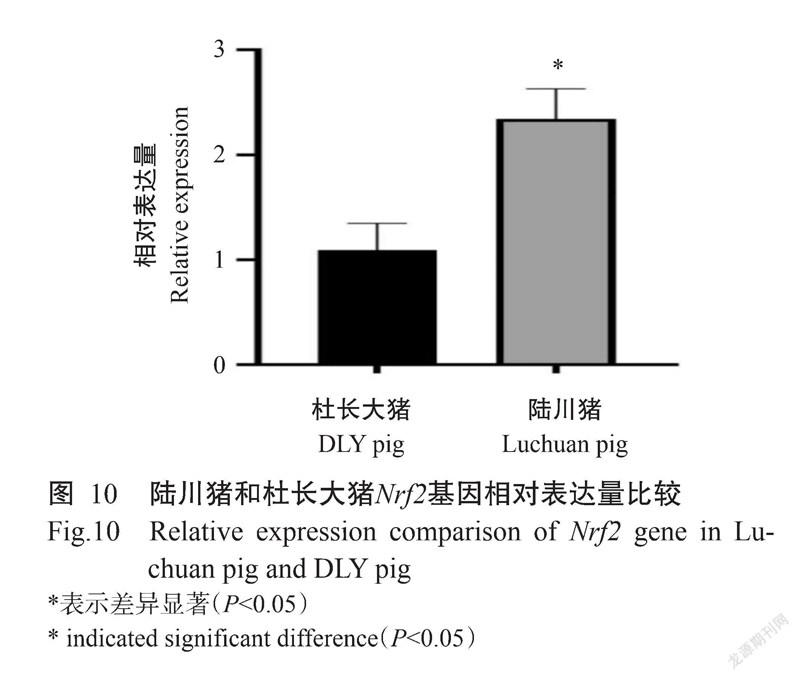
使用转录合成的cDNA为模板,选用18S rRNA为内参基因,采用实时荧光定量PCR检测Nrf2基因在150日龄陆川猪和杜长大猪背最长肌中的表达情况。反应体系10.0 μL:SYBR® Premix Ex Taq TM II 5.0 μL,cDNA模板2.5 μL,无RNA酶水 2.0 μL,上、下游引物各0.25 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 60 s,进行40个循环;72 ℃延伸10 min。采用2-ΔΔCt 法计算目的基因相对表达量,利用IBM SPSS Statistics 23进行单因素分析(ANOVA),以GraphPad Prism 8作图。
1. 8 Western blotting检测
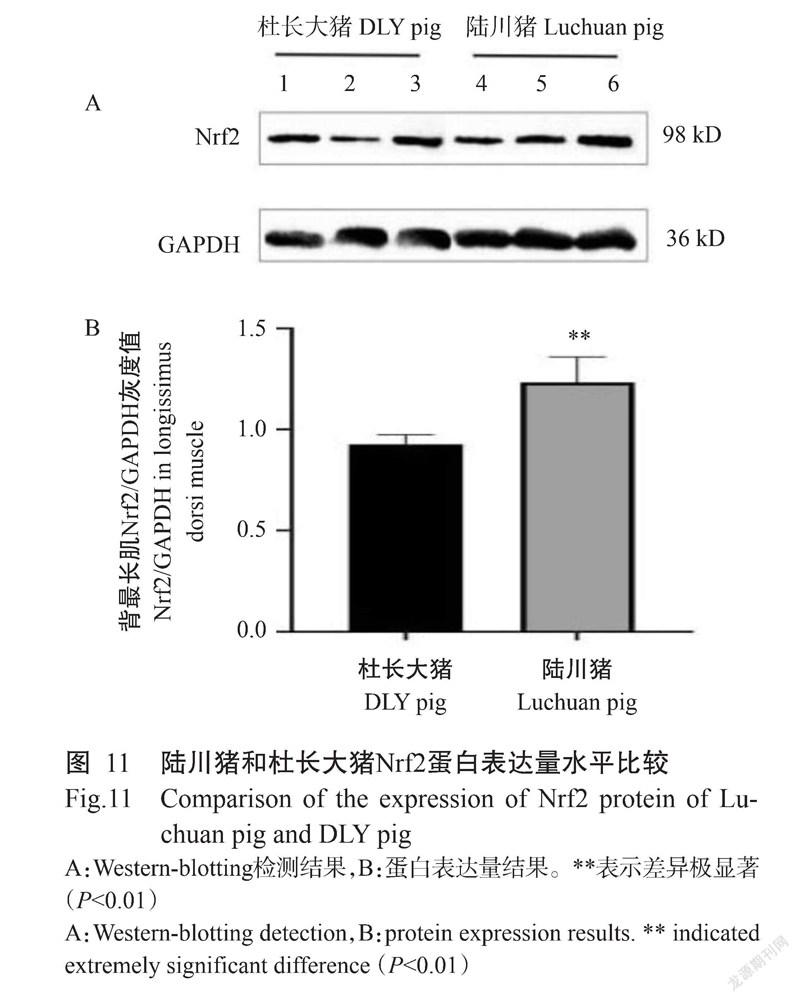
提取陆川猪和杜长大猪背最长肌组织蛋白,采用BCA法进行总蛋白浓度测定,取统一浓度为1~2 μg/μL的蛋白样品加入4×Loading Buffer(含二硫苏糖醇)95~100 ℃水浴锅煮沸5~10 min,然后上样,通过10%聚丙烯酰胺凝胶(SDS-PAGE)电行进行分离,电泳后湿转到PVDF膜上,加入5%脱脂奶粉,置于37 ℃、200 r/min恒温摇床封闭1.5 h,1×TBST摇床振荡洗涤3次,每次10 min;加入一抗4 ℃冰箱孵育10~12 h(Nrf2一抗稀释比为1∶1000,磷酸甘油醛脱氢酶(GAPDH)一抗稀释比为1∶10000),1×TBST摇床振荡洗涤3次,每次10 min;加入二抗恒温摇床孵育1 h(Nrf2二抗稀释比例为1∶4000,GAPDH二抗稀释比例为1∶2000),1×TBST摇床振荡洗涤3次,每次10 min。ECl试剂显色,GAPDH蛋白为内参,在成像系统曝光成像,最后通过Image J和Graphpad Prism 8对Western blotting条带进行灰度分析和蛋白相对半定量分析。
2 结果与分析
2. 1 陆川猪和杜长大猪Nrf2基因PCR扩增结果
通过1.5%琼脂糖凝胶电泳检测扩增产物,结果在1500和1000 bp附近出现清晰的目的条带,与预测的2条克隆条带的1473和1146 bp相符合(图1)。
2. 2 陆川猪和杜长大猪Nrf2基因CDS序列克隆及测序结果
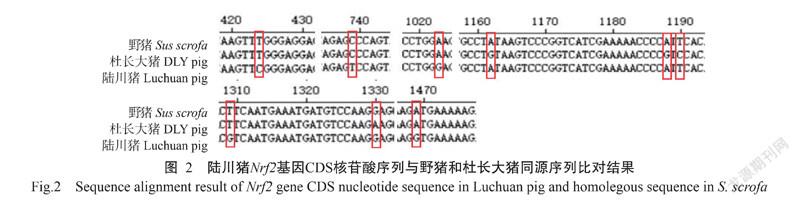
测序结果通过DNAMAN 9.0拼接,拼接结果通过Lasergene 10生物软件进行分析,结果显示测序所得的陆川猪和杜长大猪Nrf2基因CDS序列长度完全一致,CDS序列全长1686 bp,与GenBank中登录的野猪Nrf2基因(XM_003133500.6)相似性为99.7%和99.8%,表明克隆成功。CDS序列比对结果(图2)和氨基酸突变位点(图3)显示,陆川猪Nrf2基因CDS与杜长大猪和野猪Nrf2基因CDS序列相比,存在第424位点T→C,导致色氨酸(W)突变为精氨酸(R);第739位点C→T,导致脯氨酸(P)突变为丝氨酸(S);第1023位点A→G,为同义突变;第1309位点T→G,导致苯丙氨酸(F)突变为缬氨酸(V);第1469位点A→G,导致天冬氨酸(D)突变为甘氨酸(G),上述5个位点的碱基C、T、G、G、G均是陆川猪所特有。与杜长大猪相比,陆川猪还存在第1162位点G→A,导致缬氨酸(V)突变为异亮氨酸(I);第1190位点C→T,导致丝氨酸(S)突变为苯丙氨酸(F);第1188位点G→A、第1330位点A→G均为同义突变。
2. 3 陆川猪和杜长大猪Nrf2基因同源比对分析及系统发育进化树构建
由图4可知,陆川猪Nrf2基因CDS序列与GenBank公布野猪(XM_003133500.6)、杜长大猪、牛(NM_001011678.2)、绵羊(XM_012132956.4)、黑猩猩(XM_009443801.3)、獼猴(NM_001257607.1)、狼(XM_038447161.1)、人类(NM_001313903.2)、家鼠(NM_010902.5)、大白鼠(NM_001399173.1)、鸵鸟(XM_009672697.1)和普通家鸡(XM_046921129.1)的Nrf2基因CDS序列相似性分别为99.7%、99.5%、91.2%、90.6%、90.5%、90.1%、89.5%、86.5%、81.9%、81.7%、72.0%和70.6%。图5显示,陆川猪、杜长大猪和野猪聚为同一支,陆川猪与杜长大猪的遗传距离最近,与狼的遗传距离最远。
2. 4 陆川猪和杜长大猪Nrf2蛋白基本理化性质
经在线软件系统分析可知,杜长大猪Nrf2蛋白分子式为C2741H4319N747O920S14,分子量为62906.74 kD,理论等电点(pI)为4.75。其氨基酸组成比例(表2)显示,丝氨酸含量最高,占比12.5%;色氨酸含量最低,仅占0.4%。预测所得的蛋白分子亲水性总平均值(GRAVY)为-0.757。陆川猪Nrf2蛋白分子式为C2739H4316N746O920S14,分子量为62865.69 kD,(pI)为4.73。其氨基酸组成比例(表2)显示,丝氨酸含量最高,占比12.5%;色氨酸含量最低,仅占0.4%。预测所得的GRAVY为-0.740。
2. 5 陆川猪和杜长大猪Nrf2蛋白亲/疏水性分析预测
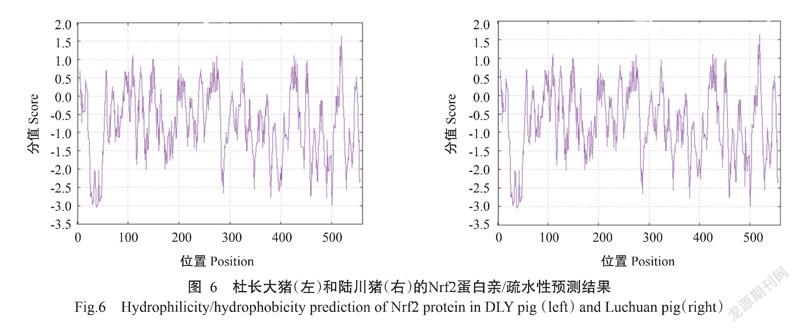
使用ExPASy ProtScale在线分析系统进行杜长大猪和陆川猪Nrf2蛋白亲/疏水性预测,由图6可知,杜长大猪和陆川猪Nrf2蛋白在0以下的氨基酸区域面积明显多于在0以上的区域面积,存在大片亲水性高的区域,即Nrf2蛋白中亲水性氨基酸的总分值高于疏水性氨基酸,因此陆川猪和杜长大猪Nrf2蛋白呈较强的亲水性,与预测的GRAVY值为-0.740和 -0.757相符合。
2. 6 陆川猪和杜长大猪Nrf2蛋白高级结构预测结果
经在线蛋白分析系统分析,发现杜长大猪Nrf2蛋白二级结构中,无规则卷曲占57.75%,α-螺旋占34.05%,延伸链占5.35%,β-转角占2.85%(图7);陆川猪Nrf2蛋白二级结构中,无规则卷曲占57.93%,α-螺旋占33.51%,延伸链占6.06%,β-转角占2.50%(图8)。
利用蛋白三级结构分析平台SWISS-MODEL在线分析,通过分析和构建模型预测得到陆川猪和杜长大猪Nrf2蛋白可能存在的三级结构,预测结果如图9所示。
2. 7 陆川猪与杜长大猪背最长肌中Nrf2基因表达差异
实时荧光定量PCR检测结果(图10)显示,150日龄陆川猪背最长肌中Nrf2基因的相对表达量高于同日龄的杜长大猪,且差异达显著水平(P<0.05)。
2. 8 陸川猪与杜长大猪背最长肌中Nrf2蛋白表达差异
由图11可知,150日龄陆川猪背最长肌中Nrf2蛋白表达量高于同日龄的杜长大猪,且差异达极显著水平(P<0.01)。
3 讨论
Nrf2又名NFE2L2,属于CNC(Cap‘n’collar)家族转录因子中的一种,在机体发生氧化应激反应时Nrf2主要通过Keap1-Nrf2/ARE信号通路诱导调控细胞内II型解毒酶和抗氧化酶等抗氧化性基因的表达,使机体从氧化应激状态恢复到正常的生理状态(樊卓,2018)。因此,Keap1-Nrf2/ARE信号通路被认为是预防和治疗因氧化应激和炎症引起疾病的关键。目前,由于Nrf2基因在抗氧化应激保护动物健康中发挥重要作用而日益受到国内外学者的广泛关注,经过试验已分别获得人类、鼠、鸡、果蝇和草鱼的Nrf2基因cDNA全长(Moi et al.,1994;Chui et al.,1995;Itoh et al.,1995;于雪,2015;冯燕等,2018)。迄今为止有关猪Nrf2基因的研究还较少,仅有刘宗立(2018)、刘宗立等(2019)、徐秋良等(2020)的研究分别得到大蒲莲猪和杜长大猪Nrf2基因完整的cDNA序列和杜长大猪在肝脏上Nrf2基因全编码序列。本研究成功克隆陆川猪和杜长大猪Nrf2基因CDS序列,同时进行生物信息学分析,发现CDS序列与野猪等哺乳动物的Nrf2基因CDS序列相似性高于99%,表明本研究所克隆的陆川猪Nrf2基因cDNA序列正确,为陆川猪Nrf2基因的研究打下了基础。
关于不同物种Nrf2基因表达的规律也有相关研究报道。闫文相(2015)研究表明,与正常人类脑组织为标本的对照组相比,胶质瘤组织中Nrf2基因mRNA和蛋白的表达量明显增高,且随着胶质瘤级别的增加,表达量增高越明显;张素响(2013)利用H2O2处理SH-SY5Y细胞,损伤前使用不同浓度的人促红细胞生成素(rH-Epo)预处理24 h,结果表明200 µmol/L H2O2处理使Nrf2相对表达量下降,但rH-Epo预处理24 h后,Nrf2基因相对表达量增加;盘文静等(2016)研究表明口服高糖(3 g/kg)可使团头鲂幼鱼Nrf2基因相对表达量极显著上调。以上研究结果间接证明了Nrf2的抗氧化机制。但关于Nrf2基因在猪组织内表达量的研究较少,徐秋良等(2020)研究表明,在35日龄仔猪中,背最长肌组织Nrf2基因的相对表达量最高,显著高于其他各组,表明Nrf2在背最长肌中发挥重要作用;刘宗立等(2019)研究发现,相同体重下大蒲莲猪肾脏、肌肉、肺脏和心脏组织中Nrf2基因的mRNA表达量显著高于长白猪,相同日龄下大蒲莲猪肌肉和脾脏组织中Nrf2基因的mRNA表达量显著高于长白猪。本研究发现,陆川猪背最长肌中Nrf2基因表达量显著高于同日龄杜长大猪,与上述研究中Nrf2基因在地方猪肌肉组织中的表达规律一致,证实了陆川猪肌肉潜在的抗氧化性能和抗氧化机制,有助于下一步深入探究陆川猪优质肌肉抗氧化性能的分子机制。但本研究仅对陆川猪Nrf2基因进行克隆和基础的生物信息学预测分析,同时揭示其在肌肉组织中的表达规律,而针对Nrf2基因在陆川猪背最长肌中的抗氧化作用机制尚有待进一步探究。
4 结论
本研究分别成功克隆陆川猪和杜长大猪Nrf2基因CDS序列,且陆川猪背最长肌中Nrf2基因mRNA表达量和蛋白表达量均高于同日龄杜长大猪背最长肌中的表达量,推测陆川猪肌肉具有比杜长大猪更加优良的抗氧化性能。
参考文献:
窦彩霞,王倩,安建勇,乔家运. 2019. Keap1-Nrf2/ARE信号通路及其在畜禽抗氧化中的研究进展[J]. 中国畜牧兽医,46(9):2567-2574. [Dou C X,Wang Q,An J Y,Qiao J Y. 2019. The research progress of Keap1-Nrf2/ARE signaling pathway and its role in the antioxidation of livestock and poultry[J]. China Animal Husbandry & Veterinary Medicine,46(9):2567-2574.] doi:10.16431/j.cnki. 1671-7236.2019.09.009.
樊卓. 2018. 转录因子Nrf1与Nrf2差异性调控抗氧化解毒基因表达[D]. 重庆:重庆大学. [Fan Z. 2018. Differential regulation of antioxidant and detoxification genes by Nrf1 and Nrf2[D]. Chongqing:Chongqing University.]
冯燕,秦真东,代云佳,张玉蕾,刘小玲,周洋,兰江风,赵丽娟,林蠡. 2018. 草鱼核因子E2相关因子2基因克隆分析及其对呼吸爆发的调控作用[J]. 水产学报,42(2):161-177. [Feng Y,Qin Z D,Dai Y J,Zhang Y L,Liu X L,Zhou Y,Lan J F,Zhao L J,Lin L. 2018. Cloning and analysis of nuclear factor E2-related factor 2(Nrf2)and its function in the regulation of respiratory burst in grass carp(Ctenopharyngodon idella)[J]. Journal of Fisheries of China,42(2):161-177.] doi:10.11964/jfc.20161210 650.
黄艳娜. 2011. 超表达瘦素和脂联素对肌纤维类型和肌肉中脂肪分解关键功能基因影响的研究[D]. 杭州:浙江大学. [Huang Y N. 2011. Effects of overexpression of leptin and adiponectin on muscle fiber types and key functional genes of lipolysis in muscle[D]. Hangzhou:Zhejiang University.]
李慧,杨林. 2018. Nrf2抗氧化的分子调控机制[J]. 生物信息学,16(1):1-6. [Li H,Yang L. 2018. Molecular regulatory mechanism of Nrf2 antioxidant[J]. Chinese Journal of Bioinformatics,16(1):1-6.] doi:10.3969/j.issn.1672-5565. 201708001.
刘宗立,陈涛,杨丹丹,崔景香,李川皓,曾勇庆,陈伟. 2019. 猪Nrf2基因克隆、生物信息学分析及启动子区转录活性分析[J]. 畜牧兽医学报,50(7):1328-1339. [Liu Z L,Chen T,Yang D D,Cui J X,Li C H,Zeng Y Q,Chen W. 2019. Molecular cloning,bioinformatics analysis and transcriptional activity of promoter of nuclear factor erythroid 2-related factor(Nrf2)gene in pig[J]. Acta Veterinaria et Zootechnica Sinica,50(7):1328-1339.] doi:10.11843/j.issn.0366-6964.2019.07.002.
刘宗立. 2018. 大蒲莲猪Nrf2基因克隆、表达分析及其启动子区活性研究[D]. 泰安:山东农业大学. [Liu Z L. 2018. Molecular cloning,expression analysis and transcriptional activity of promoter of gene Nrf2 in Dapulian pig[D]. Tai’an:Shandong Agricultural University.]
盘文静,缪凌鸿,林艳,戈贤平,刘波,任鸣春,周群兰,梁化亮,张武肖,赵振新. 2016. 口服葡萄糖对团头鲂幼鱼血液呼吸爆发、肝脏抗氧化酶活性及PI3K/Akt/Nrf2通路关键调控因子相对表达量的影响[C]//中国水产学会. 2016年中国水产学会学术年会论文摘要集:182. [Pan W J,Miu L H,Lin Y,Ge X P,Liu B,Ren M C,Zhou Q L,Liang H L,Zhang W X,Zhao Z X. 2016. Oral glucose affects respiratory burst,hepatic enzyme activities and gene expressions of the oxidative stress related pathway PI3K/Akt/Nrf2 in juvenile blunt snout bream(Megalobrama amblycephala)[C]//Chinese Society of Fisheries. Proceedings of the 2016 Annual Meeting of the Chinese Society of Fisheries:182.]
齐晓龙. 2013. 共轭亚油酸对产蛋鸡抗氧化机能的影响[D]. 北京:中国农业科学院. [Qi X L. 2013. Study on the antioxidant mechanism of conjugated linoleic acids in la-ying hens[D]. Beijing:Chinese Academy of Agricultural Sciences.]
徐秋良,周康康,李君,刘永祥,朱宽佑,肖锦红. 2020. 猪Nrf2基因克隆、表达及序列特征分析[J]. 基因组学与应用生物学,39(10):4409-4416. [Xu Q L,Zhou K K,Li J,Liu Y X,Zhu K Y,Xiao J H. 2020. Cloning,expression and sequence analysis of porcine Nrf2 gene[J]. Genomics and Applied Biology,39(10):4409-4416.] doi:10.13417/j.gob.039.004409.
闫文相. 2015. Nrf2、Caspase3在人脑胶质瘤中的表达及相关性[D]. 石家庄:河北医科大学. [Yan W X. 2015. Expression and significance of Nrf2,Caspase3 in human brain glioma[D]. Shijiazhuang:Hebei Medical University.] doi:10.7666/d.Y2785990.
于雪. 2015. 家蠅Keap1和Nrf2基因的克隆、表达及功能分析[D]. 保定:河北大学. [Yu X. 2015. Clone,expression and characterization of Keap1 and Nrf2 from Musca domestica[D]. Baoding:Hebei University.] doi:10.7666/d.D724635.
張素响. 2013. Nrf2介导促红细胞生成素对神经元抗氧化应激损伤机制研究[D]. 武汉:华中科技大学. [Zhang S X. 2013. Nrf2-mediated neuroprotection against oxidative stress by erythropoietin[D]. Wuhan:Huazhong University of Science and Technology.] doi:10.7666/d.D413358.
Chui D H,Tang W,Orkin S H. 1995. cDNA cloning of murine Nrf 2 gene,coding for a p45 NF-E2 related transcription factor[J]. Biochemical and Biophysical Research Communications,209(1):40-46. doi:10.1006/bbrc.1995.1467.
DeNicola G M,Karreth F A,Humpton T J,Gopinathan A,Wei C,Frese K,Mangal D,Yu K H,Yeo C J,Calhoun E S,Scrimieri F,Winter J M,Hruban R H,Iacobuzio-Donahue C,Kern S E,Blair I A,Tuveson D A. 2011. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J]. Nature,475(7354):106-109. doi:10.1038/nature10189.
Goldstein L D,Lee J,Gnad F,Klijn C,Schaub A,Reeder J,Daemen A,Bakalarski C E,Holcomb T,Shames D S,Hartmaier R J,Chmielecki J,Seshagiri S,Gentleman R,Stokoe D. 2016. Recurrent loss of NFE2L2 exon 2 is a mechanism for Nrf2 pathway activation in human cancers[J]. Cell Reports,16(10):2605-2617. doi:10.1016/j.celrep.2016.08.010.
Harrison R. 2002. Structure and function of xanthine oxidoreductase:Where are we now?[J]. Free Radical Biology and Medicine,33(6):774-797. doi:10.1016/S0891-5849(02)00956-5.
Hernández P,Zomeño L,Ariño B,Blasco A. 2004. Antioxidant,lipolytic and proteolytic enzyme activities in pork meat from different genotypes[J]. Meat Science,66(3):525-529. doi:10.1016/S0309-1740(03)00155-4.
Itoh K,Igarashi K,Hayashi N,Nishizawa M,Yamamoto M. 1995. Cloning and characterization of a novel erythroid cell-derived CNC family transcription factor heterodime-rizing with the small Maf family proteins[J]. Molecular and cellular biology,15(8):4184-4193. doi:10.1016/j.freeradbiomed.2015.08.009.
Jain A K,Jaiswal A K. 2007. GSK-3beta acts upstream of Fyn kinase in regulation of nuclear export and degradation of NF-E2 related factor 2[J]. The Journal of Biolo-gical Chemistry,282(22):16502-16510. doi:10.1074/jbc.M611336200.
Kim J,Keum Y S. 2016. NRF2,a key regulator of antioxidants with two faces towards cancer[J]. Oxidative Medicine and Cellular Longevity,2016:2746457. doi:10.1155/2016/2746457.
Manna K,Mishra S,Saha M,Mahapatra S,Saha C,Yenge G,Gaikwad N,Pal R,Oulkar D,Banerjee K,Saha K D. 2019. Amelioration of diabetic nephropathy using pomegranate peel extract-stabilized gold nanoparticles:Assessment of NF-κB and Nrf2 signaling system[J]. International Journal of Nanomedicine,14:1753-1777. doi:10.2147/IJN. S176013.
Moi P,Chan K,Asunis I,Cao A,Kan Y W. 1994. Isolation of NF-E2-related factor 2(Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J]. Proceedings of the National Academy of Sciences of the United States of America,91(21):9926-9930. doi:10. 1073/pnas.91.21.9926.
Rowe L J,Maddock K R,Lonergan S M,Huff-Lonergan E. 2004. Oxidative environments decrease tenderization of beef steaks through inactivation of mu-calpain[J]. Journal of Animal Science,82(11):3254-3266. doi:10.2527/2004.82113254x.
Sajadimajd S,Khazaei Mozafar. 2017. Oxidative stress and cancer:The role of Nrf2[J]. Current Cancer Drug Targets,18(6):538-557. doi:10.2174/1568009617666171002144 228.
Shibata T,Ohta T,Tong K I,Kokubu A,Odogawa R,Tsuta K,Asamura H,Yamamoto M,Hirohashi S. 2008. Cancer related mutations in NRF2 impair its recognition by Keap1-Cul3 E3 ligase and promote malignancy[J]. Proceedings of the National Academy of Sciences of the United States of America,105(36):13568-13573. doi:10.1073/pnas.0806268105.
Subedi L,Lee J H,Yumnam S,Ji E,Kim S Y. 2019. Anti-Inflammatory effect of sulforaphane on LPS-activated microglia potentially through JNK/AP-1/NF-κB inhibition and Nrf2/HO-1 activation[J]. Cells,8(2):194. doi:10.3390/ cells8020194.
Wang W Y,Sun Z J,Yang B,Wang Q. 2017. Nrf2-Knockout protects from intestinal injuries in C57BL/6J mice follo-wing abdominal irradiation with γ rays[J]. International Journal of Molecular Sciences,18(8):1656. doi:10.3390/ijms18081656.
Wu H,Kong L L,Cheng Y L,Zhang Z G,Wang Y W,Luo M Y,Tan Y,Chen X M,Miao L N,Cai L. 2015. Metallothionein plays a prominent role in the prevention of diabetic nephropathy by sulforaphane via up-regulation of Nrf2[J]. Free Radical Biology and Medicine,89:431-442. doi:10.1016/j.freeradbiomed.2015.08.009.
Wu Y H,Wu M,He G W,Zhang X,Li W G,Li Z H,Wang Z Y,Zhang C G. 2012. Glyceraldehyde-3-phosphate dehydrogenase:A universal internal control for Western blots in prokaryotic and eukaryotic cells[J]. Analytical Bioche-mistry,423(1):15-22. doi:10.1016/j.ab.2012.01.012.
Xu C J,Huang M T,Shen G X,Yuan X L,Lin W,Khor T O,Conney A H,Kong A T. 2006. Inhibition of 7,12-dimethylbenz(a)anthracene-induced skin tumorigenesis in C57BL/6 mice by sulforaphane is mediated by nuclear factor E2-related factor 2[J]. Cancer Research,66(16):8293-8296. doi:10.1158/0008-5472.CAN-06-0300.
收稿日期:2022-01-09
基金項目:国家自然科学基金项目(31760672);广西自然科学基金项目(2022GXNSFAA035525)
通讯作者:黄艳娜(1980-),https://orcid.org/0000-0001-9376-3311,博士,副教授,主要从事动物营养与肉质调控研究工作,E-mail:huangyn@gxu.edu.cn
第一作者:涂羽昂(1999-),https://orcid.org/0000-0003-4984-7141,研究方向为动物营养与肉质调控,E-mail:2650004006@qq.com
