神经内分泌肿瘤骨转移生长抑素受体PET/CT显像特征分析
2022-07-13徐俊彦许晓平宋少莉
徐俊彦 ,许晓平 ,宋少莉
1. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学生物医学影像研究中心,上海 200032;
3. 上海分子影像探针工程技术研究中心,上海 200032
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是起源于神经内分泌细胞的罕见肿瘤,可发生于任何器官与组织[1],且有逐年增高趋势[2]。NEN根据分化程度分为分化好的神经内分泌瘤(neuroendocrine tumor,NET)及分化差的神经内分泌癌(neuroendocrine carcinomas,N E C)。世界卫生组织(World Health Organization,WHO)根据肿瘤核分裂象及Ki-67增殖指数分别对胸腺、肺及胃肠胰NET进行分级[3],胸腺及肺NET分为类癌(typical carcinoid,TC)与不典型类癌(atypical carcinoid,A C),胃肠胰N E T分为G 1(Ki-67≤2%)、G2(3%<Ki-67≤20%)、G3(Ki-67>20%)。
NEN生长缓慢,病程长,容易出现肝、肺、骨等远处转移,但即使出现远处转移依然有较长的生存期。根据既往研究[4-7]报道,骨转移的发生率为4%~12%,但由于症状隐匿,影像学表现缺乏特异性,因而检出困难,骨转移的实际发生率可能更高。虽然NEN具有较大异质性且常伴有多脏器的转移,单一骨转移对患者预后的影响较难评价,但是依然有多项研究[4-6]显示,骨转移是NEN的预后不良因素,相比于其他脏器转移总生存期(overall survival,OS)更短,5年生存率仅为20%[8]。所以早期准确诊断NEN的骨转移不仅可以缓解骨痛、减少骨相关事件的发生,而且远期可能有生存获益。
大部分NEN细胞表面会表达生长抑素受体(somatostatin receptor,SSTR),临床上用于SSTR正电子发射体层成像(positron emission tomography,PET)/计算机体层成像(computed tomography,CT)的示踪剂主要是68Ga标记的生长抑素类似物(68Ga-somatostatin analogue,68Ga-SSA),包括68Ga-DOTATOC、68Ga-DOTATATE、68Ga-DOTANOC等。68Ga-SSA PET/CT在NEN尤其是分化好的NET中,探测转移灶的效能佳,能够准确地判断SSTR的表达,并指导长效生长抑素及放射性核素肽受体介导治疗(peptide receptor radionuclide therapy,PRRT)[9-10]。因此,SSTR PET/CT作为NEN的特异性显像,被纳入国内外的临床诊疗指南中。本研究回顾并分析NEN68Ga-SSA PET/CT的结果,探讨NEN骨转移的形态特征、分布及SSTR PET/CT的诊断价值和影像学特征。
1 资料和方法
1.1 临床资料
收集2019年8月—2021年12月在复旦大学附属肿瘤医院行68Ga-SSA PET/CT检查的NEN患者1 041例,所有患者均通过手术后病理学检查证实为NEN。其中105例NEN骨转移,分析骨转移患者的临床资料及PET/CT影像,所有患者接受6个月以上的临床及影像随访[包括CT、磁共振成像(magnetic resonance imaging,MRI)和核素骨显像],其中8例经手术后病理学检查证实为NEN骨转移。骨转移的诊断依据如下:① 病理学检查证实为NEN骨转移;② 影像学上表现典型骨转移征象;③ 随访中骨病灶数目改变或形态学变化。
1.2 检查方法
示踪剂的制备:采用德国E&Z公司的“68Ge/68Ga”发生器,用5 mL 0.1mol/L HCl溶液将68Ga由洗脱至含100 μL DOTATATE/DOTANOC(50 μg)与900 μL 0.5 mol/L醋酸钠缓冲液的反应管中,加热至95~100 ℃反应10 min,冷却后过无菌滤膜洗脱产品至无菌西林瓶。采用高效液相色谱法和放射薄层色谱法对纯度进行评估并验证最终产品的性质。最终产品的放射化学纯度为>90%。
显像方法:静脉注射148~185 MBq68Ga-DOTATATE/68Ga-DOTANOC 1 h后进行PET/CT,检查前大量饮水充盈胃,上机前排空膀胱。采用德国Siemens公司的Biograph mCT Flow PET/CT系统,先行低剂量CT扫描,管电压120 kV,电流140 mA,扫描层厚和层间距均为3 mm;随后行PET扫描,采集时间为每个床位3 min,使用CT图像对PET迭代重建来进行衰减校正,采集结束后采用有序子集最大期望值法(ordered subset expectation maximization,OSEM)进行图像重建。
1.3 图像分析
所有图像由2名有经验的核医学科医师采用盲法阅片。PET/CT阳性病灶定义为骨病灶摄取高于正常骨本底的局灶性摄取,对于阳性患者,选取摄取最高的骨转移病灶,沿病灶边缘勾画感兴趣区(region of interest,ROI),由计算机自动计算出病灶的最大标准摄取值(maximum standard uptake value,SUVmax)。另外,将骨转移灶根据CT影像上骨密度的改变分为成骨性、溶骨性、混合性及无骨质改变。
1.4 统计学处理
采用SPSS 16.0软件进行数据分析,Fisher精确概率检验用于比较不同示踪剂显像间的探测阳性率。根据不同示踪剂显像、肿瘤起源、病理学分级及骨密度改变分组,分别用非独立样本t检验及方差分析比较不同组间的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床特征
1 041例接受68Ga-SSA PET/CT的NEN患者中,105例(10.1%)最终诊断为NEN骨转移,其中男性68例,女性37例,年龄为14~79岁,平均年龄(54.0±12.2)岁,从年龄分布来看50岁以上患者发生骨转移占多数。原发肿瘤中,胰腺NEN(26.7%,28/105)最多,其次为直肠NEN(20.0%,21/105);此外,嗜铬细胞瘤/副神经节瘤10例(9.5%),胸腺NEN 16例(15.2%),肺NEN 9例(8.6%),不明原发NEN 8例(7.6%),肾NEN 4例(3.8%),胃NEN 3例(2.9%),小肠NEN 2例(1.9%),宫颈NEC及胆囊NEC各1例(1.0%);另有2例Ⅰ型多发性内分泌肿瘤综合征(multiple endocrine neoplasia-1,MEN-1),同时合并胰腺及胸腺NEN,根据骨密度改变及68Ga-SSA的摄取情况判断,其中1例骨转移来源于胰腺,另1例来源于胸腺。根据病理学分级特征将不典型类癌归为NET G2。本组患者中,发生骨转移的NEN患者有57.1%(60/105)为NET G2(表1)。26.7%(28/105)为治疗前发现的同时性骨转移,其余73.3%(77/105)均为治疗过程中发现的异时性骨转移。

表1 患者的临床资料特征
2.2 患者显像结果
本组患者中,行68Ga-DOTATATE PET/CT检查者共计36例,行68Ga-DOTANOC PET/CT检查者共计69例,显像阳性探测率分别为88.9%和76.8%,两组间差异无统计学意义(P=0.191)。骨转移部位包括脊柱(87例,82.9%)、骨盆(82例,78.1%)、肋骨(62例,59.0%)、四肢骨(29例,27.6%)、肩胛骨(26例,24.8%)、颅骨(19例,18.1%)、胸骨(15例,14.3%)、锁骨(7例,6.7%)。51.4%(54/105)的骨转移灶在CT上表现为成骨性转移,溶骨性、混合性(同一病灶或同一患者既有溶骨性改变又有成骨性改变)及未见骨质改变的骨转移分别为36例(34.3%)、10例(9.5%)及6例(5.7%)。由于部分骨转移患者骨质改变不明显,容易在常规影像学检查中漏诊(图1)。胰腺及直肠NEN骨转移多表现为成骨性转移,胸腺及肺NEN骨转移则以溶骨性改变为主,嗜铬细胞瘤及副神经节瘤骨转移成骨较少,可表现为溶骨性改变及混合性改变(表2)。根据骨转移灶累及范围,骨转移灶3枚以内的寡转移者15例(14.3%),3枚以上的多发转移者65例(61.9%),弥漫转移者25例(23.8%)(图2)。在骨外转移灶方面,仅8例单发骨转移而不合并骨外转移,合并淋巴结转移者77例,合并肝转移者66例,合并肺转移者17例。

图1 小肠NET弥漫性骨转移68Ga-DOTANOC PET/CT图像
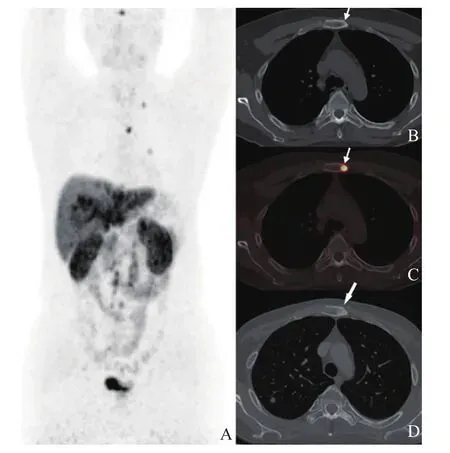
图2 胰腺NET骨转移68Ga-DOTATATE PET/CT图像

表2 骨转移灶的骨密度改变情况 n
比较68Ga-DOTATATE与68Ga-DOTANOC所探测到的骨阳性病灶,两者SUVmax差异无统计学意义(17.0±19.6 vs 24.6±31.4,P=0.216)。根据肿瘤原发部位分组,因肾、宫颈及胆囊NEN更为罕见,本研究仅纳入胃肠胰NEN、纵隔/肺NEN和嗜铬细胞瘤/副神经节瘤进行分组分析,3组骨转移灶SUVmax差异有统计学意义(F=3.867,P=0.025),胃肠胰和纵隔/肺NEN的骨转移灶SUVmax差异无统计学意义(18.72±17.44 vs 15.81±21.17,P=0.734),但嗜铬细胞瘤/副神经节瘤的骨转移灶SUVmax(45.87±66.88)明显高于前两者(P分别为0.010和0.015)。在骨转移最多见的胃肠胰NET中,G1、G2和G3肿瘤骨转移的SUVmax差异无统计学意义(21.18±20.36 vs 17.91±10.93,P=0.549)。根据骨转移灶范围,分为转移灶<3个、转移灶>3个及弥漫转移3组,各组间SUVmax差异无统计学意义(15.6±13.7、18.3±23.5、32.8±39.5;F=2.382,P=0.099),其中弥漫转移组病灶SUVmax最高(P=0.043)。不同骨质改变的骨转移灶间,SUVmax亦差异无统计学意义(F=1.054,P=0.373)。
3 讨 论
骨骼是实体肿瘤较为常见的转移部位。NEN是一类起源于神经内分泌细胞的罕见肿瘤,分化良好的NET虽然生长较为缓慢,但部分在初诊时已伴有远处转移,其中肝转移最常见,在本组患者中合并肝转移者高达62.99%(66/105)。既往文献[4-7]报道NEN骨转移发生率为4%~12%,在本中心接受68Ga-SSA PET/CT检查的患者中,骨转移的发生率为10.1%,与近期北京协和医院[11]报道的骨转移灶发生率(10.35%)一致。而且本研究中有26.7%的患者为初诊未治疗时即发现骨转移,Scharf等[6]观察到35.3%的患者为同时性骨转移,该比例略高于本研究,这可能是因为本组患者均为接受显像的患者,存在一定的选择偏倚。Lim等[7]的回顾性研究显示,1 212例NEN患者中,7%存在骨转移,其中49%为胃肠胰来源,25%为肺来源,20%不明原发;2/3为G1、G2。这一结果亦与本研究相仿,骨转移最常起源于胃肠胰NEN(51.4%),其次为胸腺及肺NEN(23.8%),约57.1%的患者为NET G2。类似的结果也见于德国的一项研究[6],其最常见的肿瘤原发部位为小肠(37.6%),这可能与欧美NEN的原发肿瘤好发部位不同有关。骨转移的症状较为隐匿,有研究[6]指出,仅28.2%的骨转移患者在初诊时即伴有骨痛症状。骨转移相对较高的发生率、同时性骨转移所占比例及预后不良因素使得骨转移的早期、准确诊断及提前干预显得尤为重要。
骨转移的检出率近年来随着诊断仪器及方法的改进有所提高。2010年欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society,ENETS)指南推荐NEN骨转移的影像学诊断主要包括MRI、核素骨显像及SSTR扫描[12],但当年SSTR PET/CT尚未普及,故未列入临床共识。NEN骨转移病灶大多表现为成骨性改变,本研究中所占比例为51.4%,在既往文献[13]中更是高达83%,可能由于PET/CT所用低剂量CT降低了对骨质改变的辨析能力。因为核素骨显像的原理是放射性药物吸附于骨骼中的羟基磷灰石晶体从而显像,主要反映成骨性病灶,所以既往研究[14]报道核素骨显像对NEN骨转移的诊断灵敏度也高达90%,然而核素骨显像的缺陷在于特异性差,难以区分骨退行性改变及骨转移。本组5.7%的患者的CT表现并不伴有明显骨质改变,给CT诊断NEN骨转移带来很大困难。近10年来,随着68Ga-SSA PET/CT在临床上的广泛应用,特异性地结合于NEN细胞表面SSTR,对于NEN,其诊断、分期的灵敏度及特异度均较高,且影响大部分NEN患者的治疗决策。
68Ga-SSA PET/CT对NEN骨转移的诊断灵敏度和特异度明显高于常规CT,国内外多项研究[15-17]显示,灵敏度为75%~100%,特异度为89%~100%。其中,68Ga-DOTATATE仅结合于SSTR2,68Ga-DOTANOC可结合SSTR2、3、5[18]。一项68Ga-DOTATATE和68Ga-DOTANOC PET/CT头对头的比较研究[19]证实,68Ga-DOTANOC PET/CT对肝转移灶的检出率更高,而68Ga-DOTATATE PET/CT对骨转移灶的检出数目更多。本研究比较68Ga-DOTATATE与68Ga-DOTANOC的阳性探测率相仿,且两者的骨阳性病灶SUVmax差异无统计学意义(17.0±19.6 vs 24.6±31.4,P=0.216)。故在临床应用中,SSA探针的选择并不影响最终NEN骨转移的诊断以及病灶的放射性摄取。根据肿瘤原发部位分组,因肾、宫颈及胆囊NEN更为罕见,且入组患者数较少,本研究仅纳入胃肠胰NEN、纵隔/肺NEN和嗜铬细胞瘤/副神经节瘤进行分组分析,3组骨转移灶SUVmax差异有统计学意义(F=3.867,P=0.025),嗜铬细胞瘤/副神经节瘤的骨转移灶摄取最高。通过CT特征分析,可见胃肠胰NEN以成骨性转移为主,而纵隔/肺NEN和嗜铬细胞瘤/副神经节瘤则以溶骨性转移为主,故对于原发不明NEN的68Ga-SSA PET/CT根据骨转移灶的骨质改变及放射性核素摄取综合判断,可能为原发灶的检出提供有用的信息。
综上所述,NEN骨转移最常见于胃肠胰NEN,以成骨性改变多见,好发于NET G2。SSTR PET/CT是诊断NEN骨转移较为灵敏的方法,68Ga-DOTATATE和68Ga-DOTANOC PET/CT对骨转移的诊断效能无差异,且病灶摄取也相仿。嗜铬细胞瘤/副神经节瘤及弥漫性骨转移通常具有更高的病灶摄取。
