肉芽肿性小叶性乳腺炎与乳腺浸润性小叶癌超声声像图特征对比研究
2022-07-13刘艳超孝梦甦吴倩岚刘郭坤
刘艳超 ,孝梦甦,吕 珂,吴倩岚,刘郭坤
1. 中国医学科学院北京协和医学院,北京协和医院超声科,北京 100730;
2. 邯郸市中心医院超声医学科,河北 邯郸 056000;
3. 邯郸市第一人民医院病理科,河北 邯郸 056000;
4. 邯郸市中心医院 CT/MRI室,河北 邯郸 056000
肉芽肿性小叶性乳腺炎(granulomatous lobular mastitis,GLM)是非哺乳期乳腺的一种慢性炎性疾病,临床少见,占乳腺良性病变的1.8%[1]。GLM病灶的超声声像图表现与乳腺浸润性小叶癌(infiltrating lobular carcinoma of the breast,ILC)病灶极为相似,鉴别诊断存在一定困难,易误诊,常需穿刺活检或手术后病理学检查区分[2]。本研究通过回顾性研究比较两者的超声图像特征,以提高对这两类疾病的认识及鉴别诊断准确度,为临床诊断及进一步制订治疗计划提供更可靠的影像学依据。
1 资料和方法
1.1 一般资料
将2015年1月—2021年6月于北京协和医院行乳腺检查并经病理学检查证实为GLM的28例女性患者纳入GLM组,共28个病灶。另收集2019年1月—2021年6月于北京协和医院行超声检查并经病理学检查证实为ILC的58例女性患者作为对照组(ILC组),共58个病灶。每例患者的临床症状等均依据病历记录进行收集。
1.2 超声图像采集
采用荷兰Philips公司的iU 22彩色多普勒超声仪,探头频率为5~12 MHz。检查患者乳腺,发现病灶后对其进行多角度、多方位扫查,留取二维及彩色多普勒超声图像并存储于超声工作站。从工作站中调取GLM和ILC组的超声图像,每个病灶图像均具有最大横切面及最大纵切面。由1名具有10年以上乳腺超声工作经验且不知晓病理学检查结果的医师回顾病灶的超声图像,观察并记录乳腺病灶的位置、大小,形态、边界、纵横比、内部回声等二维声像图特征及彩色多普勒血流成像(color Doppler flow imaging,CDFI)特征,并依据临床资料及超声影像学表现对病灶进行诊断。同一例患者具有多个病灶时选取最大病灶纳入研究。
1.3 超声图像分析
根据既往文献[2]报道,将病灶超声表现分为3种类别:弥漫型,片状型,结节或肿块型。弥漫型:范围广泛,病灶不局限,可累及1个或数个象限;片状型:病灶范围较大,与正常腺体可见分界欠清晰,一般局限于1个象限;结节或肿块型:病灶局限,可见明确结节或肿块。
CDFI分级采用Adler半定量血流分级[3],根据病灶内部血流形态、分布等分级:0级病灶内未发现血流信号;Ⅰ级为少量血流信号,可见1、2个点状或细棒状血管,棒状血流不超过病灶直径的1/2;Ⅱ级为中量血流,可见3、4个点状血管或1个较长的血管穿入病灶,其长度可接近或超过病灶半径;Ⅲ级为多量血流,可见≥5个点状血管或2个较长血管。
1.4 统计学处理
2 结 果
2.1 GLM组与ILC组临床资料比较
G L M组2 8例,年龄1 9~6 8岁,平均(36.5±11.2)岁。ILC组58例,年龄34~73岁,平均(51.7±8.8)岁。
GLM组中53.6%出现红肿疼痛等炎症样临床表现,而ILC组中84.5%无症状,两组间有差异有统计学意义(P<0.001)。
2.2 GLM组与ILC组病灶超声影像学特征的比较
GLM组病灶最大径1.0~7.2 cm,平均(4.25±2.23)cm,ILC组病灶最大径0.6~7.8 cm,平均(2.59±1.56)cm(病灶大小仅结节或肿块型及片状型纳入统计,两组差异无统计学意义)。其余两组超声声像图特征及比较结果见表1。
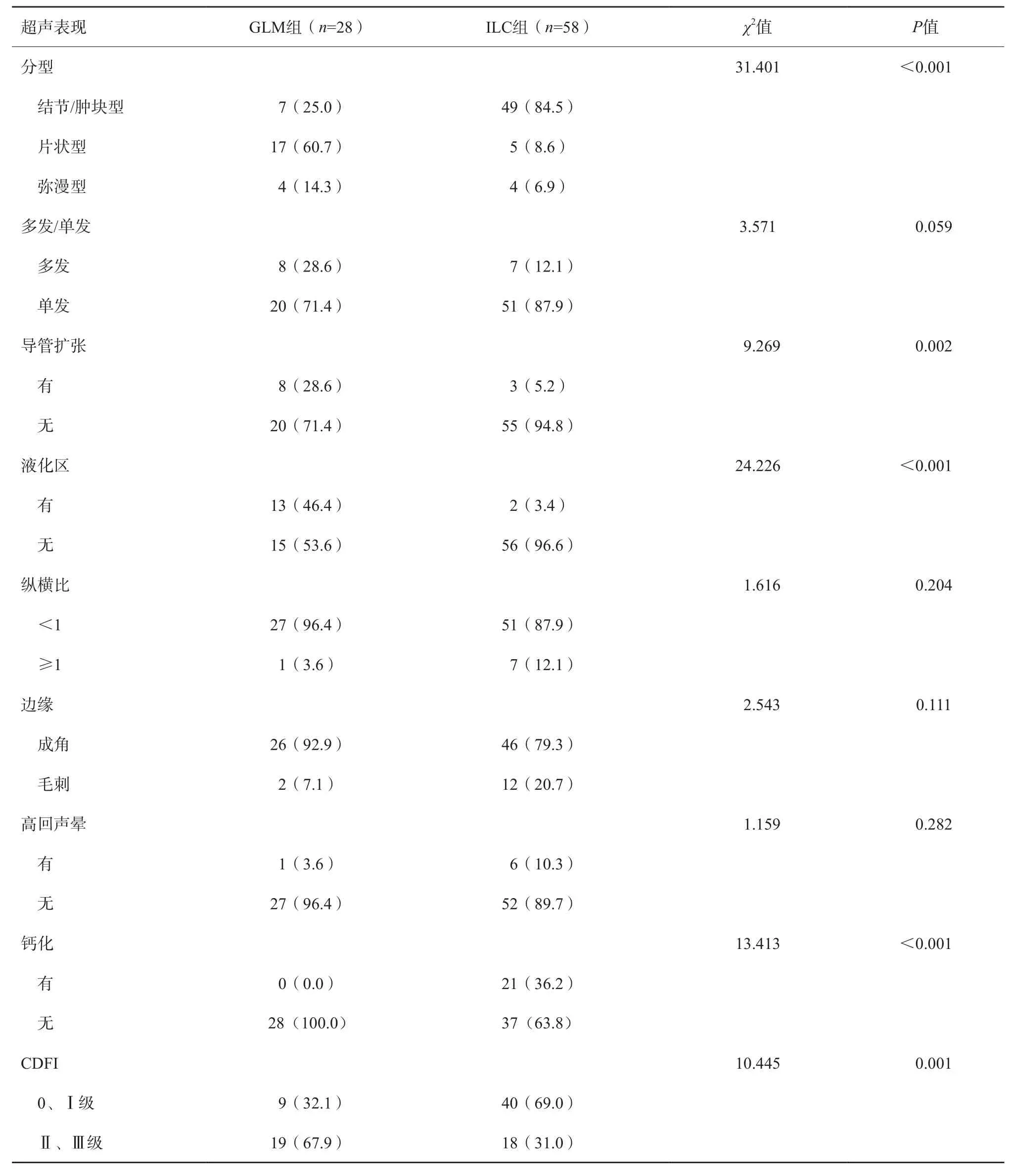
表1 GLM与ILC组超声图像特征比较 n(%)
GLM组中片状型病灶更多见(60.7%,17/28),ILC组中结节/肿块型多见(84.5%,49/58);GLM病灶更多见扩张导管、液化区及丰富血流信号等征象,钙化少见(P<0.05)。在病灶数目、大小、纵横比、边界、高回声晕等方面两者差异无统计学意义(P>0.05),两组均多见单发病灶、纵横比<1、边缘成角,少见高回声晕。GLM与ILC典型超声表现见图1~4。
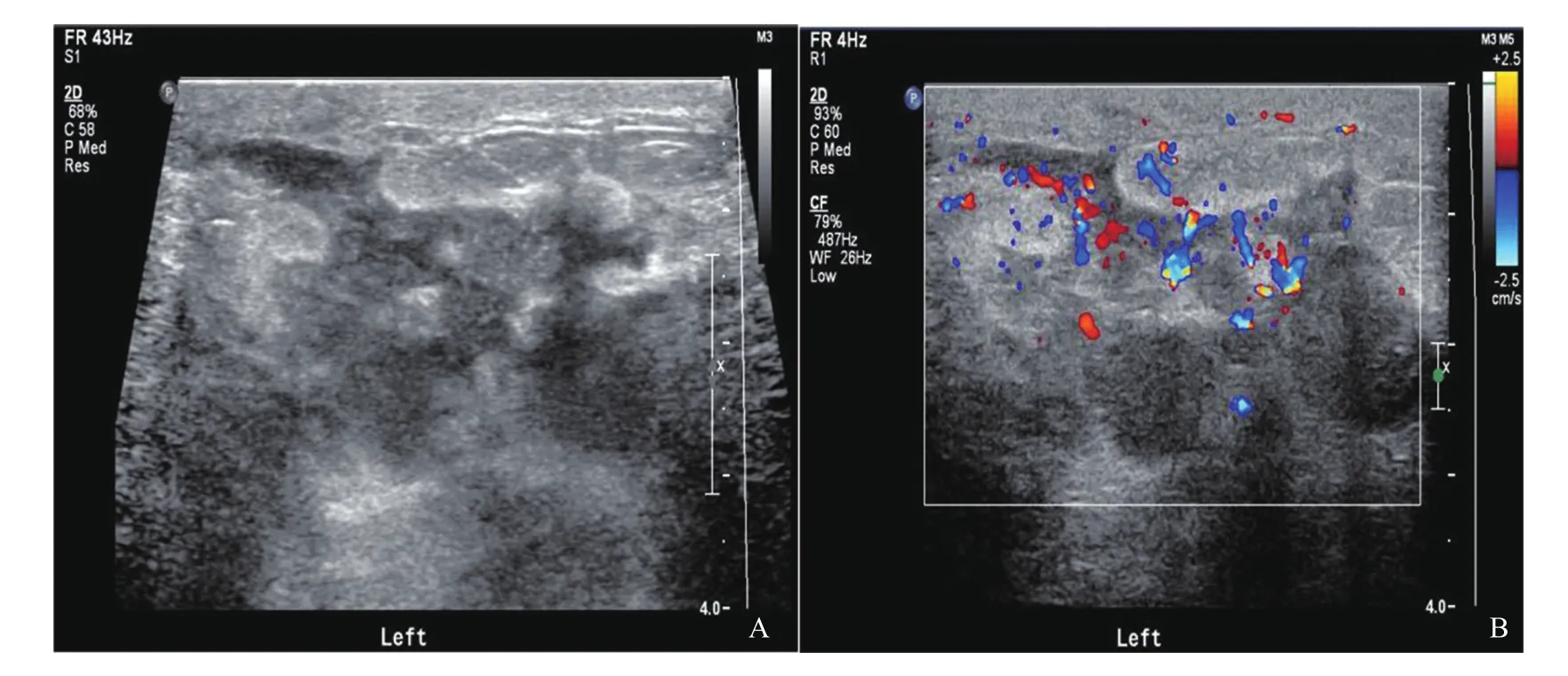
图1 乳腺GLM病灶(片状型)超声表现

图2 乳腺GLM病灶(弥漫型)超声表现
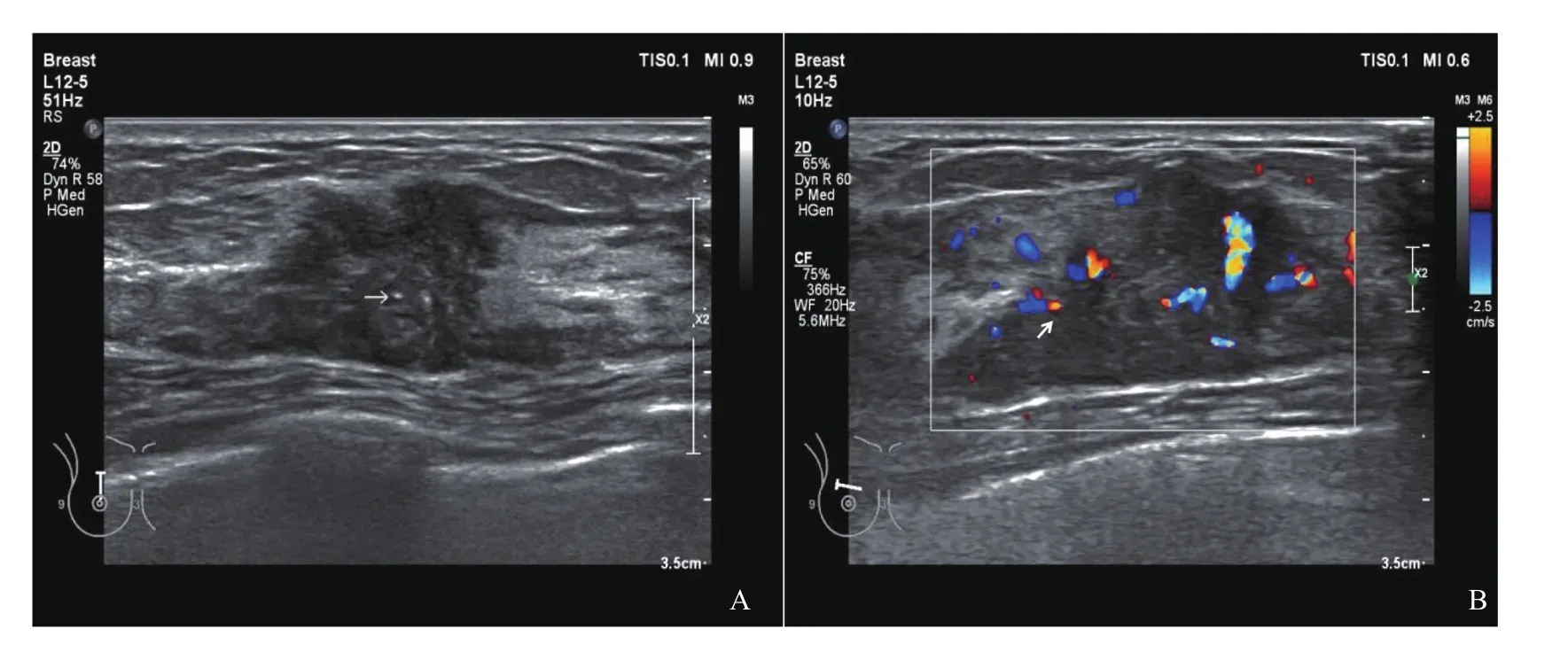
图3 乳腺ILC病灶(结节型)超声表现

图4 乳腺ILC病灶(片状型)超声表现
2.3 GLM组与ILC组临床资料及超声影像学特征诊断效能比较
依据临床资料及超声影像学表现,两组的诊断符合率见表2。
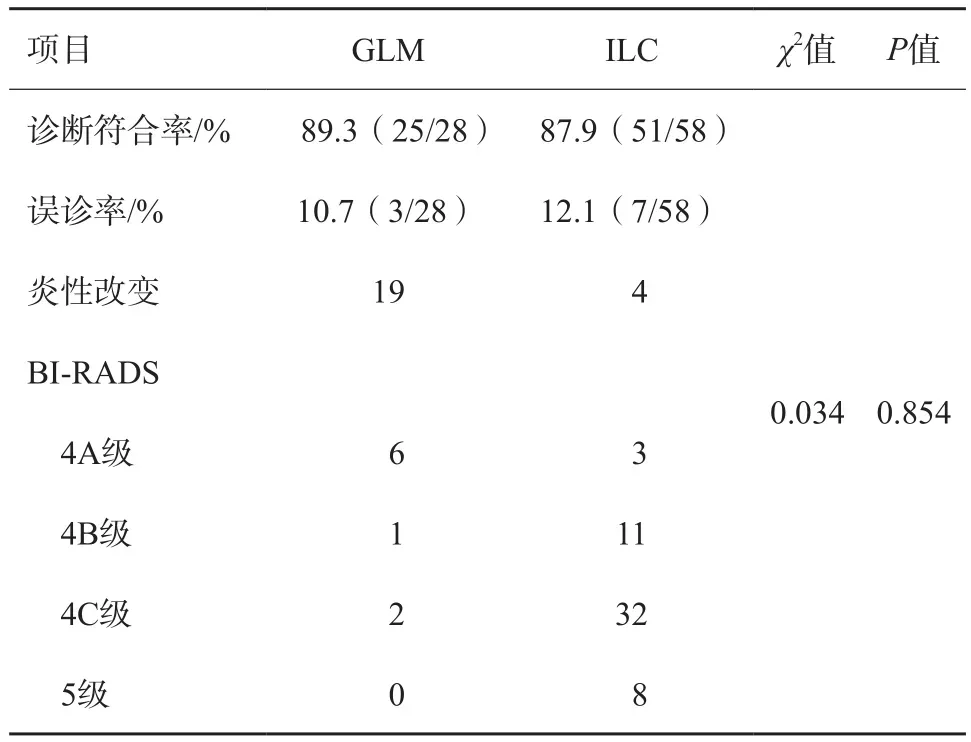
表2 GLM与ILC超声诊断符合率比较(n/N)
3 讨 论
Kessler等[4]于1972年首次报道GLM。GLM好发于育龄期妇女,多为经产妇,少数可见于妊娠期或哺乳期[5]。本研究GLM组中82.1%(23/28)发生在哺乳后5年内,与文献[6]报道相一致。目前GLM发病机制尚不明确,病理学特征显示为病因不明的非细菌感染的局限于乳腺小叶的非干酪性肉芽肿性炎性病变[7-9],是非哺乳期乳腺炎中的一种慢性炎性疾病。有学者[10]认为,GLM属于自身免疫性疾病,临床上普遍认为该疾病可能与哺乳障碍、乳房外伤、炎症、内分泌失调及乳腺损伤,以及哺乳习惯、卫生条件不良等有关。GLM的临床表现缺乏特异性,在本研究GLM组中46.4%无明显不适症状,53.6%出现红肿疼痛等炎症症状(差异无统计学意义)。
ILC发病年龄偏大,尤其好发于绝经后女性[11-12],是继乳腺浸润性导管癌之后常见的乳腺恶性肿瘤,占乳腺癌的5%~15%,且发病率呈逐年上升趋势。ILC起源于终末导管小叶单位,以癌细胞突破乳腺小叶内末梢乳管或腺泡基底膜而向小叶间质浸润性生长为主要病理学特征[13],由于其独特的细胞生长方式以及较少的成纤维反应,常常难以形成可扪及的肿块[14-16],因此常无明显临床表现,多在影像学检查中发现病灶。在本研究中,ILC组中84.5%无症状,多于体检时发现而就诊,由此看来影像学辅助诊断尤为重要。
GLM很少累及乳晕区,病灶多位于乳腺周边区域,部分病灶累及腺体前脂肪及真皮[17]。本研究中GLM病灶超声声像图多数表现为片状(17/28),累及范围较大,边界不清,形态不规则,边缘成角,与刘华平等[18]观察结果基本一致。GLM病灶内部以液化区(13/28)及导管扩张(8/28)等征象多见,其内脓肿及窦道形成易累及腺体前方组织。ILC主要表现为结节/肿块型(49/58),以低回声为主,相对GLM累及范围较小(差异无统计学意义),形态不规则,边缘成角或毛刺状等,具备一些典型恶性征象;部分ILC病灶内部可见点状钙化灶(21/58),高回声晕少见(6/58)。GLM与ILC超声征象特点存在交叉,因此,两类病变需结合临床表现进行综合判断。
本研究GLM组中3例误诊患者无明显临床症状,超声图均表现结节状、形态不规则、血流信号显示不丰富,因此未能与恶性病变鉴别。ILC组中7例误诊患者临床表现偶有刺痛,声像图表现为片状、边界欠清晰、血流信号显示略丰富,因此,诊断为炎性病变或4A类。本研究显示,两组病灶在超声声像表现上,形态、内部液化区、导管扩张、内部钙化及CDFI方面差异有统计学意义,在纵横比、边缘形态、高回声晕等方面差异无统计学意义,诊断效能较差,故在临床工作中应提高对两组疾病临床表现及病理学等方面的整体认识,结合超声声像图特征分析以提高诊断效能。超声弹性成像、超声造影等技术能否提供更多的鉴别诊断信息,仍需在后续的工作中进一步积累证据。
综上所述,GLM临床常伴有红肿疼痛等炎性表现,病灶多呈片状,内部更易出现液化区、导管扩张及血流丰富表现;ILC无明显临床症状,病灶多呈结节/肿块状,边缘成角,可见钙化,血流信号紊乱,但两者仍存在一定的重叠,综合分析超声声像图及临床表现能为两者鉴别提供较为可靠的依据,从而提高诊断符合率。
