干扰LncRNA OIP5-AS1对人乳腺癌细胞迁移、上皮间充质转化及Notch1表达的影响
2022-07-13刘金丽秦福霞王红艳郭素芬
刘金丽,秦福霞,杜 鹃,杨 月,刘 野,王红艳,郭素芬
(牡丹江医学院病理教研室,黑龙江 牡丹江 157011)
随着现代社会的快速发展,环境问题、基因突变、遗传因素等导致肿瘤发病日趋严重,而对于女性来讲,乳腺癌已经成为高发癌症之一,且有逐年增长之趋势,目前针对乳腺癌的发病机制研究渐渐成熟,但乳腺癌的转移与复发仍然是乳腺癌治疗中一个难题[1],LncRNA OIP5-AS1是从编码OIP5的同一基因的反义方向转录的,OIP5-AS1是一种与肿瘤密切相关的LncRNA[2],大量研究发现其不仅在中枢神经系统的早期发育中起关键作用,而且在恶性肿瘤的进展过程中起到复杂的细胞调控作用[3]。它不仅抑制细胞周期蛋白G相关激酶的表达从而影响有丝分裂,而且在许多肿瘤中也调节细胞增殖和凋亡[4],包括肺腺癌[5]、胶质瘤[6]和肝母细胞瘤[7]等。但是LncRNA OIP5-AS1在人类乳腺癌中的功能还需进一步的探索[8]。我们课题组前期实验发现:乳腺癌细胞中的Linc-OIP5被干扰后能够调节与其共培养的内皮细胞管腔形成,并抑制其增殖与迁移,这表明该因子与肿瘤血管形成密切相关[9],然而LncRNA OIP5-AS1能否成为防治乳腺癌转移的潜在靶基因?这些问题的解决对临床治疗乳腺癌具有重要参考价值。
1 材料与方法
1.1 材料与试剂胎牛血清(上海生工生物工程有限公司);人乳腺癌细胞株MDA-MB-231细胞(中国科学院北京细胞库);LncRNA OIP5-AS1及内参引物(上海生工生物工程有限公司);转染试剂(武汉金拓思生物科技有限公司),LncRNA OIP5-AS1 siRNA、NC siRNA(武汉金拓思生物科技有限公司);BCA蛋白浓度试剂盒(碧云天生物技术有限公司);E-Cadherin兔多克隆抗体及Vimentin兔多克隆抗体和山羊抗兔二抗(碧云天生物技术有限公司)。
1.2 方法
1.2.1 体外细胞转染 取MDA-MB-231乳腺癌细胞6×105个均匀铺于6孔板中,置于恒温无菌箱中培养,待细胞汇合度达到70%左右时进行siRNA转染。LncRNA OIP5-AS1 siRNA、NC siRNA质粒具体转染操作按转染试剂说明书进行。转染12 h后,收集细胞用于后续实验。转染LncRNA OIP5-AS1 siRNA的MDA-MB-231细胞,记为LncRNA OIP5-AS1 siRNA组,转染NC siRNA后的MDA-MB-231细胞记为NC siRNA组,未作任何处理的MDA-MB-231细胞记为Control组。
1.2.2 RT-qPCR检测 LncRNA OIP5-AS1的基因表达水平 依据试剂盒说明书提取各组细胞RNA后,选取 20 μL 体系,进行 cDNA 的合成。之后,以 cDNA 为模板进行扩增qRT-PCR,设置的反应条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s, 72 ℃ 10 min) 连续40次循环,4 ℃冰上保存。引物序列见表1。

表1 RT-qPCR引物扩增序列
1.2.3 细胞划痕实验检测细胞迁移能力 细胞计数后均匀铺于6孔板内,待细胞处于单层融合贴壁状态后,各组细胞进行转染后继续培养,使用相同大小的枪头分别进行细胞划痕;缓冲液冲洗2次,目的是洗掉细胞碎片。并且分别在培养0 h、24 h后,记录镜下划痕的变化情况,而后对不同组别划痕面积进行统计学分析。
1.2.4 Western blots检测E-cadherin及Vimentin蛋白表达水平 提取总蛋白后进行蛋白定量测定,配制8% SDS-PAGE 凝胶,凝胶电泳条件为80 V直至蛋白到达底部;100 mA进行转膜,5%脱脂奶粉37 ℃环境封闭2 h,加入相应一抗稀释液(E-cadherin稀释浓度为1∶5000,Vimentin稀释浓度为1∶2000),4 ℃摇床过夜。于第2日,TBST洗掉多余未结合的一抗,每次 10 min。加入辣根过氧化物酶标记的山羊抗兔二抗(稀释浓度为1∶5000),室温摇床1 h,TBST洗去多余未结合的二抗,每次10 min。ECL显色液A液(鲁米诺)与B液(过氧化物)按等比例混合,配置显影剂1 mL。采用ImageJ 153软件进行灰度值分析[10]。
1.2.5 LncRNA OIP5-AS1干扰后Notch1 mRNA的表达水平 按上述方法转染并提取各组细胞的RNA,以RT-qPCR方法检测。引物序列见表1。
1.3 统计学处理采用GraphpadPrism 8软件对此次实验所得数据进行统计学分析与比较,计量数据采用“均数±标准差”表示,两组间数据的比较采用单因素方差分析t检验,当P值小于0.05时,我们认为此种差异具有统计学意义。
2 结果
2.1 乳腺癌细胞MDA-MB-231转染LncRNAOIP5-AS1 siRNA后的干扰效果各组数据显示,在与阴性对照组比较时,干扰36 h后,LncRNA OIP5-AS1的表达水平显著降低,差异有统计学意义(P<0.01)见表2。

表2 LncRNA OIP5-AS1干扰后LncRNA OIP5-AS1的mRNA表达水平的变化
2.2 各组细胞迁移能力通过观察24 h细胞划痕实验结果,与对照组相比,LncRNA OIP5-AS1干扰组迁移能力受到抑制(P<0.01),见图1、图2。

图1 划痕光镜图(×100)
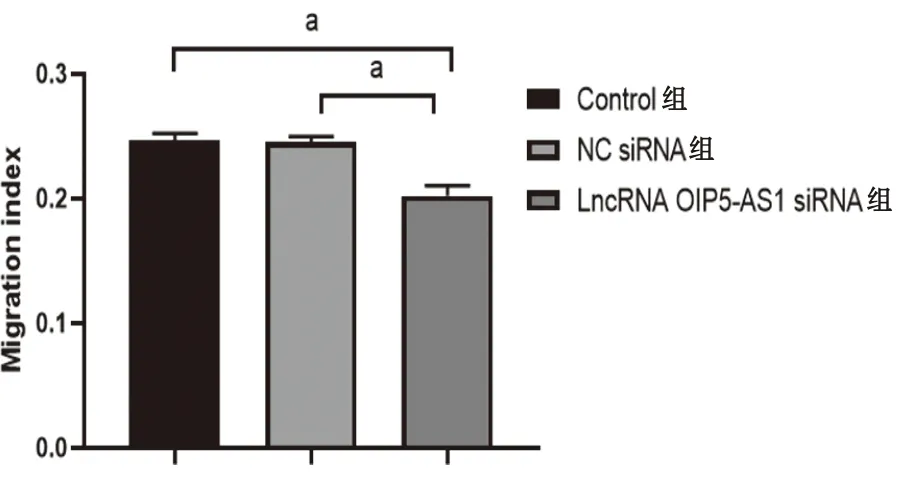
图2 LncRNA OIP5-AS1干扰后细胞迁移率的变化
2.3 E-cadherin、Vimentin蛋白表达水平与NC siRNA对照组比较,干扰LncRNA OIP5-AS1后乳腺癌细胞中E-cadherin蛋白表达水平升高、Vimentin蛋白表达水平降低,其差异有统计学意义(P<0.05),这说明EMT的发展得到抑制,见图3、图4。

图3 LncRNA OIP5-AS1干扰后E-cadherin和Vimentin蛋白表达
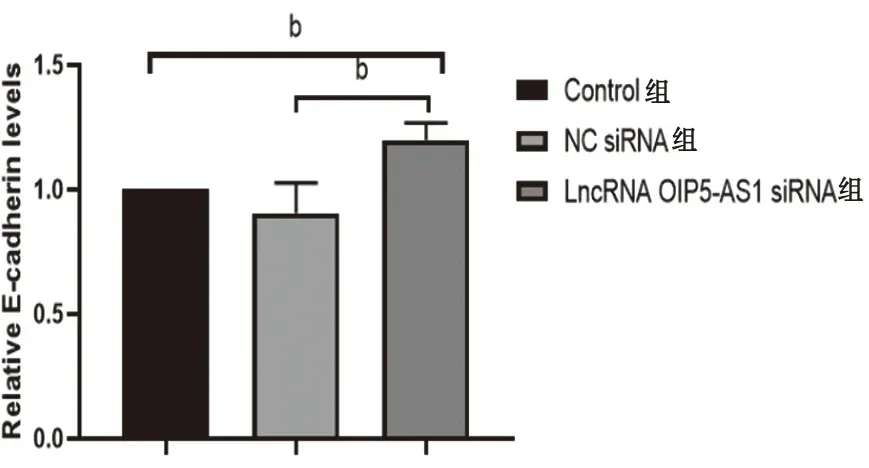
图4 LncRNA OIP5-AS1干扰后检测E-cadherin和Vimentin蛋白表达水平
2.4 Notch1的mRNA表达水平Notch1的RT-qPCR法检测结果显示:与空白组及NC siRNA组比较,LncRNA OIP5-AS1 siRNA组乳腺癌细胞中Notch1 mRNA的表达明显降低,而空白组与NC siRNA组中Notch1 mRNA的表达水平并无明显差异,这些说明靶向调控乳腺癌细胞中LncRNA OIP5-AS1的表达与Notch1表达水平有密切的关系,其实验结果见表A。

表4 LncRNA OIP5-AS1干扰后Notch1表达水平的变化 化
3 讨论
乳腺癌治疗过程中发生侵袭转移的问题依旧是乳腺癌治疗所面临的巨大挑战,本研究利用具有高侵袭特性的人乳腺癌MDA-MB-231 细胞为研究对象,研究了lncRNA OIP5-AS1在乳腺癌发生发展中的可能作用,我们通过siRNA技术干扰lncRNA OIP5-AS1在乳腺癌MDA-MB-231细胞中的表达,从而观察其对乳腺癌细胞迁移、上皮间充质转化及Notch1表达的影响,旨在发现调控乳腺癌不断发展的重要因素。实验结果显示干扰该基因可以成功抑制乳腺癌细胞部分生物学行为,这一结果对于寻找新的抑制乳腺癌潜在靶点是一种重要的提示。
细胞迁移是肿瘤浸润转移的前提条件,本实验在lncRNA OIP5-AS1被干扰后,乳腺癌MDA-MB-231 细胞迁移能力受到抑制,这说明lncRNA OIP5-AS1可以促进乳腺癌细胞的迁移。
EMT过程是肿瘤获得迁移能力促进肿瘤进展的重要环节,在发生EMT的过程中,上皮细胞失去极性,细胞骨架结构发生改变,最终导致细胞运动性增强,这是肿瘤细胞迁移能力增强的根源[11],EMT过程的显著特征在于E-cadherin表达下降、Vimentin表达上升,使细胞极性降低[12]。在本次实验中我们采用Westen blots技术研究了沉默lncRNAOIP5-AS1后,E-cadherin与Vimentin的表达情况,实验结果显示,在沉默lncRNA OIP5-AS1的同时,E-cadherin表达上升,而Vimentin表达下降,这种变化恰与EMT过程相反,这一结论也提示我们沉默lncRNA OIP5-AS1后抑制乳腺癌MDA-MB-231细胞的迁移能力受到抑制,可能与抑制EMT过程密切相关。
大量研究表明Notch1在很多种癌症中表达上调。当降低了Notch1的表达时,可同时抑制癌细胞的Notch配体,Notch信号通路被激活的阈值有所提高,从而使Notch的大部分受体被活化的过程受到抑制,进而导致进入细胞核募集与迁移相关的转录因子启动相关蛋白的表达受到抑制。因此,为了研究LncRNA OIP5-AS1与 Notch1表达的关系,在本实验中我们通过qRT-PCR技术检测了干扰lncRNA OIP5-AS1后Notch1 mRNA的表达情况,实验结果显示在干扰lncRNA OIP5-AS1基因的同时,Notch1 mRNA的表达下调,这说明lncRNA OIP5-AS1的上述作用可能与Notch1表达相关。
综上所述,本实验通过小干扰RNA手段干扰lncRNA OIP5-AS1可以抑制人乳腺癌细胞的迁移、上皮间充质转化及Notch1表达,这一结论可能使lncRNA OIP5-AS1成为乳腺癌治疗的又一个新的潜在靶点,这一结论也可以为乳腺癌治疗中面临的转移难题提供一条新的治疗思路
