瑞舒伐他汀对动脉粥样硬化APOE-/-小鼠VCAM-1、VEGF和TNF-α表达的影响
2022-07-13张俊华马永宾苏建华陈玉芳孙亚云
张俊华,马永宾,苏建华,陈玉芳,孙亚云,曹 明
(1.江苏大学附属金坛医院神经内科;2.常州市第四人民医院病理科,江苏 常州 213000)
心脑血管疾病具有发病率高和致死率高的特点,对人类健康产生严重的影响。作为心脑血管疾病的主要病理基础,动脉粥样硬化(atherosclerosis,AS)发病机制复杂多样。在炎症反应、细胞凋亡等多种因素作用下,脂质斑块在血管内皮生成和黏附,导致血管硬化及管腔狭窄,影响远端组织的血液供应[1]。他汀类药物除了降脂作用外,研究发现其有抗炎和抗AS的作用,但是其抗AS的作用机制尚缺乏系统的报道[2]。本研究旨在通过观察瑞舒伐他汀对载脂蛋白E敲除基因(APOE-/-)小鼠动脉粥样硬化的治疗作用及其对VCAM-1、VEGF和TNF-α表达的影响,探讨瑞舒伐他汀的抗动脉粥样硬化作用的机制。
1 材料与方法
1.1 实验动物18只8周龄SPF级健康雄性APOE-/-小鼠(品系为C57BL/6),6只8周龄SPF级健康雄性C57BL/6小鼠,体质量为18~24 g,均购自常州卡文斯实验动物有限公司,实验动物合格证号为202013565。
1.2 主要药品、试剂与仪器本研究所用药品为鲁南贝特制药有限公司生产的瑞舒伐他汀钙片(5 mg/片,药品批号44211101),主要试剂为Affinity VCAM-1抗体(江苏亲科生物研究中心有限公司)、Proteintech VEGF抗体(武汉三鹰生物技术有限公司)、Affinity TNF-α抗体(江苏亲科生物研究中心有限公司)、BCA蛋白浓度测定试剂盒(北京拜尔迪生物技术有限公司)、ECL试剂盒(上海沪震实业有限公司)。主要仪器:倒置相差显微镜(Nikon公司)、离心机(Eppendorf公司)、组织匀浆仪(Servicebio公司)、电泳仪(Bio-Rad公司)、化学发光成像系统(Tanon公司)。
1.3 实验方法
1.3.1 动物分组、喂养及给药 在实验室适应1周后,按随机化原则将18只APOE-/-小鼠分为模型组、低剂量治疗组和高剂量治疗组,每组6只。6只C57BL/6小鼠作为对照组。均在屏障环境下喂养,APOE-/-小鼠采用高脂饲料(Rodent Diet,含1.25%胆固醇)喂养,C57BL/6小鼠采用普通颗粒饲料和自来水喂养。实验室室温维持在(21±2)℃,湿度控制在50%~70%,每天更换垫料。实验室喂养8周后,按不同剂量的瑞舒伐他汀依次对低、高剂量组小鼠进行灌胃给药,低剂量治疗组按1.5 mg/kg给药、高剂量治疗组按5 mg/kg给药,对照组和模型组用相同量的蒸馏水灌胃,1次/d,共给药8周。
1.3.2 取材 4组小鼠最后一次灌胃后均禁食不禁水12 h,腹腔注射10%水合氯醛(4.5 mL/kg)进行麻醉,分离出主动脉弓,用4%甲醛予以固定,取胸主动脉置于-80 ℃冰箱中保存待用。
1.4 指标检测
1.4.1 主动脉病理学观察及管腔相关指标和AS斑块面积比较 常规脱水固定胸主动脉标本后浸蜡包埋,切片后用蒸馏水浸泡,然后经苏木精水溶液染色,酸水及氨水分色,流水冲洗,酒精水化和分化,伊红染色液染色及纯酒精脱水等步骤后,加入二甲苯和树胶,中性树脂封固。200倍光学显微镜观察主动脉的病理形态学变化,用Image Tool 图像分析仪和IPP软件分析计算主动脉内弹力板周长、外弹力板周长、残腔周长和动脉粥样硬化斑块的面积。
1.4.2 蛋白质免疫印迹(Western Blot,WB)法检测主动脉VCAM-1、VEGF和TNF-α的蛋白表达 称取25 mg的胸主动脉,加入0.5 mL RIPA裂解液,匀浆3次,每次间隔30 s。匀浆液4 ℃ 3000×g,离心15 min,将上清转移至新的微量离心管中,裂解完成后4 ℃ 1200×g,离心15 min。采用BCA蛋白浓度测定试剂盒进行蛋白定量,严格按照其说明书要求测量各样本蛋白的浓度。根据各样本蛋白浓度,计算各样品相同蛋白量所需体积。蛋白样品于变性仪95 ℃下变性5 min,室温下冷却后上样进行SDS-PAGE电泳,电压为80 V 30 min,120 V 1 h。转膜后将其置于5%脱脂奶粉的TBST封闭液室温摇床上封闭1 h,震荡洗涤3次,每次5 min。加入特异性一抗4 ℃冰箱中过夜孵育,摇床上摇30 min,震荡洗涤3次,每次5 min,再加入相应的二抗室温孵育1 h,震荡洗涤3次,每次5 min。最后用ECL试剂盒显色,凝胶成像仪拍照,经计算机图像分析仪扫描,用Image J软件进行灰度值测定及分析,将VCAM-1、VEGF和TNF-α条带灰度值与GAPDH之比作为目的蛋白表达的相对数值。
1.4.3 免疫组化检测VCAM-1、VEGF及TNF-α在主动脉组织中的表达 取主动脉,冰生理盐水冲洗后用4%甲醛固定,石蜡包埋后切成5 μm厚度的切片,然后用二甲苯和乙醇脱蜡,蒸馏水水化2 min后,进行抗原修复;随后加入3%的过氧化氢室温避光25 min,3% BSA室温封闭30 min,吸去封闭液,滴加相应一抗,置于4 ℃湿盒孵育过夜;滴加与一抗相应种属HRP 标记的二抗覆盖组织,室温孵育50 min;弃去二抗,DAB染色10 min,自来水冲洗后分化10 s,最后脱水封片;显微镜镜检,采集记录图像进行分析。用Image J软件计算各组免疫组化检测VCAM-1、VEGF和TNF-α的光密度值。
1.5 统计学方法用SPSS 18.0统计软件包进行统计,计量资料用“均数±标准差”表示,采用单因素方差分析进行组间比较,采用LSD-t检验进行组间两两比较,P<0.05示差异有统计学意义。
2 结果
2.1 小鼠胸主动脉病理形态学观察模型组、低剂量治疗组和高剂量治疗组主动脉根部均有明显的AS斑块。与对照组相比,模型组主动脉内膜明显增厚;与模型组相比,低剂量治疗组和高剂量治疗组的内膜厚度均明显降低,且药物剂量依赖性降低内膜厚度,见图1。
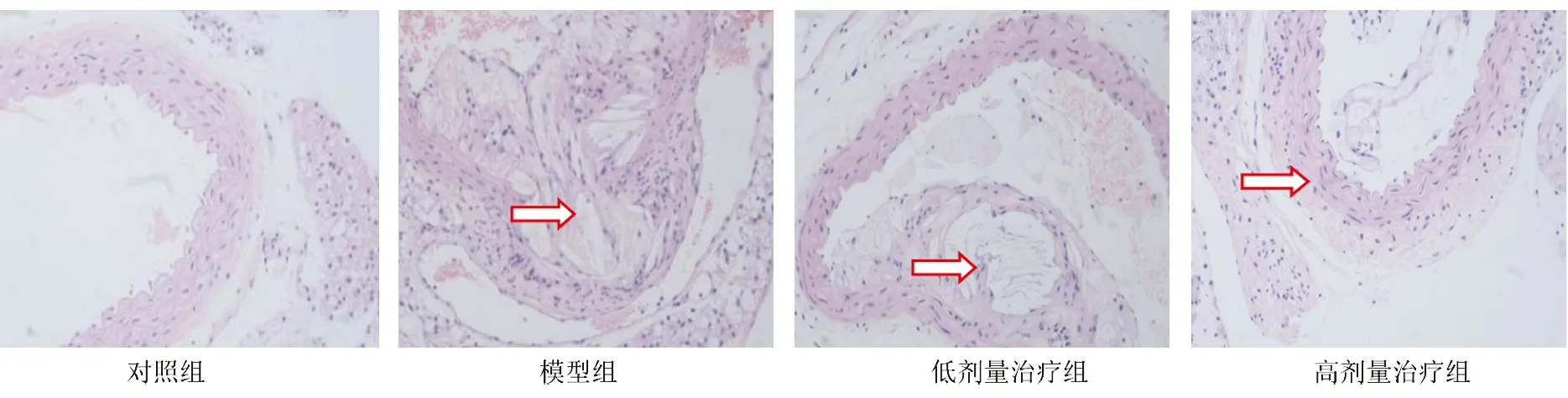
图1 各组小鼠主动脉病理形态学改变(HE染色,200×)
2.2 主动脉管腔相关指标和AS斑块面积比较与对照组相比,模型组的内弹力板周长明显增加;与模型组比较,低剂量治疗组内弹力板周长仍有增加,但高剂量治疗组较模型组和低剂量治疗组明显降低(P<0.01)。与对照组相比,模型组的外弹力板周长明显增加,高剂量治疗组外弹力板周长较模型组和低剂量治疗组明显降低(P<0.01)。与对照组相比,模型组的残腔周长明显降低,低剂量治疗组和高剂量治疗组残腔周长均明显增加(P<0.01)。与模型组相比,低剂量治疗组和高剂量治疗组斑块面积缩小;与低剂量治疗组相比,高剂量治疗组斑块面积缩小更明显(P<0.01)。见表1。
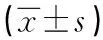
表1 各组小鼠主动脉内弹力板周长、外弹力板周长、残腔周长及斑块面积比较
2.3 各组小鼠WB法检测主动脉VCAM-1、VEGF和TNF-α蛋白条带的相对灰度值比较与对照组相比,模型组VCAM-1、VEGF和TNF-α相对灰度值均升高(P<0.01);与模型组相比,低剂量治疗组VCAM-1和TNF-α的相对灰度值无明显变化,VEGF的相对灰度值降低(P<0.01);与模型组相比,高剂量治疗组VCAM-1、VEGF和TNF-α的相对灰度值降低(P<0.01)。见图2和表2。
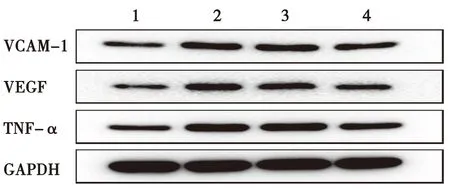
图2 各组小鼠主动脉VCAM-1、VEGF和TNF-α蛋白条带
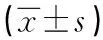
表2 各组小鼠主动脉VCAM-1、VEGF和TNF-α蛋白条带灰度值比较
2.4 各组小鼠免疫组化检测VCAM-1、VEGF及TNF-α在主动脉组织中的表达如图3所示,其中黄褐色部分为阳性表达。APOE-/-小鼠阳性表达数高于对照组小鼠,低剂量治疗组和高剂量治疗组的阳性表达数明显降低,且药物剂量依赖性降低阳性表达数。光密度值反映对应蛋白表达的阳性率,各组光密度值(IOD)统计分析结果如表3所示。与对照组相比,模型组VCAM-1、VEGF、TNF-α光密度值均升高(P<0.01);与模型组相比,低剂量治疗组VCAM-1和VEGF蛋白表达阳性率略有降低,其光密度值无显著性差异(P>0.05)。TNF-α光密度值明显降低(P<0.01);与模型组相比,高剂量治疗组VCAM-1、VEGF和TNF-α光密度值均降低(P<0.01)。
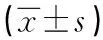
表3 各组小鼠免疫组化VCAM-1、VEGF和TNF-α光度值比较

图3 各组小鼠免疫组化检测VCAM-1、VEGF及TNF-α在主动脉组织的表达
3 讨论
AS是一种多因素导致的慢性炎症性疾病,常累及全身大、中动脉内膜,AS的主要危险因素是炎症反应和脂质代谢异常[3]。在多种因素作用下,单核细胞大量聚集,激活巨噬细胞,吞噬氧化型低密度脂蛋白,分泌的炎症介质损伤血管壁,促进AS的发生和发展,出现血管狭窄、血栓形成、甚至出现粥样斑块破裂,严重影响人类健康。因此,如何有效控制AS成为众多学者的研究方向[4]。作为临床常用的降脂药物,瑞舒伐他汀能通过抑制 HMG-CoA 还原酶降低低密度脂蛋白和极低密度脂蛋白的合成[5]。研究发现,瑞舒伐他汀除了能降脂外,还有抗炎、改善血管内皮细胞功能、抗氧化、抑制细胞凋亡等作用,但其对AS作用的具体机制仍不明确[6]。
VCAM-1是一种在内皮细胞、平滑肌细胞、白细胞及血小板表面表达的膜表面糖蛋白,介导细胞与细胞外基质、细胞与细胞间黏附及相互作用[7]。有研究表明,在炎症因素作用下,VCAM-1、细胞间黏附分子-1(ICAM-1)等黏附分子明显增加,单核细胞黏附于血管内皮细胞,平滑肌细胞迁移和增殖,巨噬细胞聚集在血管内膜。巨噬细胞表面的清道夫受体结合氧化型低密度脂蛋白后,转变为泡沫细胞,在动脉管壁上形成脂肪条纹,促进AS 的发生发展[8]。本研究用高脂饮食喂养APOE-/-小鼠,制造动脉粥样硬化的模型,然后使用不同剂量的瑞舒伐他汀进行干预治疗。WB法和免疫组化法检测结果表明,高剂量治疗组VCAM-1的相对灰度值和光密度值较模型组均降低。
TNF-α是一种由组织固有免疫细胞产生的促炎细胞因子,具有广泛的生物学活性[9]。内皮细胞在TNF-α诱导作用下,通过激活NF-κB 通路,促进各种趋化因子和粘附分子的表达[10]。研究表明,TNF-α能调节脂质代谢,并刺激IL-l、IL-6等炎症因子的表达,对单核巨噬细胞和血管平滑肌细胞均有激活、趋化、促生长等作用,促进炎症反应,在AS病理变化中起着重要作用[11]。本研究显示高剂量治疗组TNF-α的相对灰度值明显降低。免疫组化检测也显示使用高剂量的瑞舒伐他汀干预后其TNF-α光密度值明显降低。
VEGF是目前所知的最关键的血管生成促进因子,目前发现有3种VEGF受体:VEGFR-1、VEGFR-2 和VEGFR-3[12]。VEGF 的水平与缺血缺氧程度有关,在血管硬化和狭窄导致的心肌的缺血、缺氧环境中,缺氧诱导因子-1α(HIF-1α)是对VEGF 起主要调控作用的转录因子,上调下游促血管形成物质VEGF 的表达,刺激VEGF 保护性的分泌[13]。研究表明,VEGF是一种能够特异性地作用于血管内皮的多功能细胞因子,能够促进AS斑块中血管新生,同时通过改变血管渗透性而引起血管壁水肿,从而加重AS[14]。本研究结果显示WB检测模型组VEGF相对灰度值高于对照组,经过瑞舒伐他汀干预后,低剂量组和高剂量组VEGF的相对灰度值均明显降低。免疫组化检测结果显示模型组VEGF光密度值较对照组升高,经瑞舒伐他汀治疗后VEGF光密度值降低。
本研究结果表明,模型组的内弹力板周长和外弹力板周长较对照组明显增加,残腔周长降低。低剂量治疗组和高剂量治疗组残腔周长较模型组均明显增加。低剂量治疗组和高剂量治疗组斑块面积较模型组缩小,高剂量治疗组斑块面积缩小更明显。说明瑞舒伐他汀能增加AS残腔周长,缩小斑块面积,且高剂量优于低剂量。
综上所述,瑞舒伐他汀能通过对主动脉VCAM-1、TNF-α和VEGF表达的影响,降低其蛋白表达阳性率,从而增加AS残腔周长,缩小斑块面积,起抗AS的作用,且高剂量优于低剂量。这为临床上运用瑞舒伐他汀治疗以动脉粥样硬化为病理基础的心脑血管疾病提供理论依据。
