KCC2在BDNF抑制酒精依赖大鼠酒精偏好中的作用及机制
2022-07-13张洪艳王琦玉徐璐璐熊君伟关艳中
张洪艳,王琦玉,徐璐璐,熊君伟,王 雪,关艳中
(牡丹江医学院,黑龙江 牡丹江 157011)
酒精使用障碍(Alcohol use disorder,AUD)是一种能引起多种健康后果的慢性复发性疾病,酒精作用于中枢神经系统,导致神经退行性变以及随后的认知和行为缺陷[1]。VTA与其他大脑区域如伏隔核(Nucleus accumbens,NAc)和前额叶皮质(Prefrontal cortex,PFC)之间的多巴胺(Dopamine,DA)投射系统表明VTA参与了酒精依赖的过程[2]。BDNF是中枢神经系统中最普遍的生长因子,在大脑发育和可塑性中起着至关重要的作用。BDNF功能失调会导致多种精神障碍性疾病,包括焦虑和药物滥用[3]。KCC2通过调节胞内氯离子稳态,影响γ-氨基丁酸受体(GABAAR)和甘氨酸受体(GlyR)介导的突触传递的有效价和极性,在中枢神经元突触成熟和功能中发挥重要作用[4]。研究发现,BDNF通过下调KCC2影响尼古丁戒断后的行为变化[5],VTA注入KCC2激活剂CLP290可以减弱应激后大鼠的酒精摄入量[6]。可见,KCC2与成瘾物质有关。而KCC2是否参与慢性酒精暴露模型中BDNF抑制大鼠酒精偏好作用的研究还未见报道。本研究通过向VTA注射KCC2激活剂和抑制剂观察对大鼠酒精偏好的影响,并探究BDNF对酒精依赖大鼠酒精偏好的作用机制。
1 材料和方法
1.1 实验动物SPF级SD雄性大鼠,体重(200±20) g,由牡丹江医学院比较医学中心提供,实验动物生产许可证号:SYXK(黑)2019-006。在有机通风玻璃中单笼饲养,双瓶饮水一周以适应环境,动物环境温度为(22±2) ℃,湿度50%~60%,保持昼夜节律12 h/12 h(即早8∶00到晚20∶00)。实验过程中SD大鼠保证充足的水和食物,通风良好,每周更换垫料,所有动物饲养与使用均按照《实验动物饲养和使用指南》要求执行,实验方案获得牡丹江医学院动物福利和伦理委员会批准。
1.2 主要试剂食用酒精(浓度≥95%),BDNF(美国Sigma公司),CLP290(美国Tocris Bioscience公司),VU0240551(美国Tocris Bioscience公司),DMSO(美国Sigma公司)。
1.3 实验方法大鼠主动饮酒模型的建立:SPF级SD大鼠饲养一周后,给予双瓶饮酒,一瓶20%酒精,一瓶饮用水,24 h后将20%酒精瓶更换为饮水瓶,并记录24 h的饮酒量(mL)和饮水量(mL)以及体重的变化。再过24 h,将饮水瓶换成20%酒精瓶,并交换两瓶位置,以排除位置偏好对实验的影响。28 d后大鼠饮酒精摄入量达到[3.2 g/(kg·24 h)]即为建模成功[7]。对照组大鼠无限制自由饮水。大鼠酒精偏好%=乙醇消耗量(mL)/总液体量(mL)×100%[7]。
1.4 实验动物分组及处理SD大鼠根据随机数字表分组,对照组(n=4)和饮酒组(n=42),对照组每天记录24 h饮水量和体重,饮酒组每天记录24 h总液体摄入量(饮水量+饮酒量)和体重。饮酒第21 d时,饮酒组给予脑立体定位手术进行埋置套管,术后恢复一周,恢复期间正常饮酒。待饮酒稳定后给予酒精戒断72 h,根据随机数字表分为假手术组(n=6),DMSO组(n=6),ACSF组(n=6),CLP290组(n=6),VU0240551组(n=6),BDNF组(n=6)和BDNF+VU0240551组(n=6)。CLP290用DMSO溶解到50 mM,再用ACSF稀释到50 μM/μL;VU0240551用DMSO溶解到100 mM,再用ACSF稀释到10 μM/μL;BDNF用ACSF溶解到0.5 μg/μL。每组注射剂量均为1 μL,对照组注射同等剂量的溶剂。微量注射速度0.5 μL/min,注射完留针2 min,以便药物扩散,药物注射完30 min后给予饮酒,测6 h饮酒量和饮水量,计算酒精偏好。
1.5 统计学处理实验结果采用SPSS 25.0软件统计分析,数据作图采用GraphPad Prism 8.0,实验数据以“均数±标准差”表示。两组均数间比较采用t检验,多组间比较采用One way ANOVA方差分析,有统计学差异后采用事后两两比较进行分析,P<0.05被认为差异具有统计学意义。
2 结果
2.1 大鼠间歇性饮酒模型的建立
2.1.1 建模期间大鼠体重和24 h总液体摄入量变化 建模阶段,饮酒组大鼠体重与对照组比较没有统计学差异(见图1A,t=0.19,P=0.86)。与对照组相比,饮酒组大鼠24 h总液体摄入量没有明显变化(见图1B,t=0.06,P=0.95)。
2.1.2 建模期间大鼠饮酒量和酒精偏好变化 随着饮酒天数的增加,大鼠酒精摄入量(图1C)和酒精偏好(图1D)逐渐增加,到末次饮酒28 d时已达到稳定水平,代表酒精依赖模型建立成功。
2.2 BDNF对酒精偏好的影响酒精依赖模型建立成功后给予戒断72 h,戒断后给予VTA区注射BDNF(0.5 μg),与假手术组和ACSF组比较,BDNF组酒精偏好显著降低(见表1,F2,15=7.429,P=0.006),差异有统计学意义。
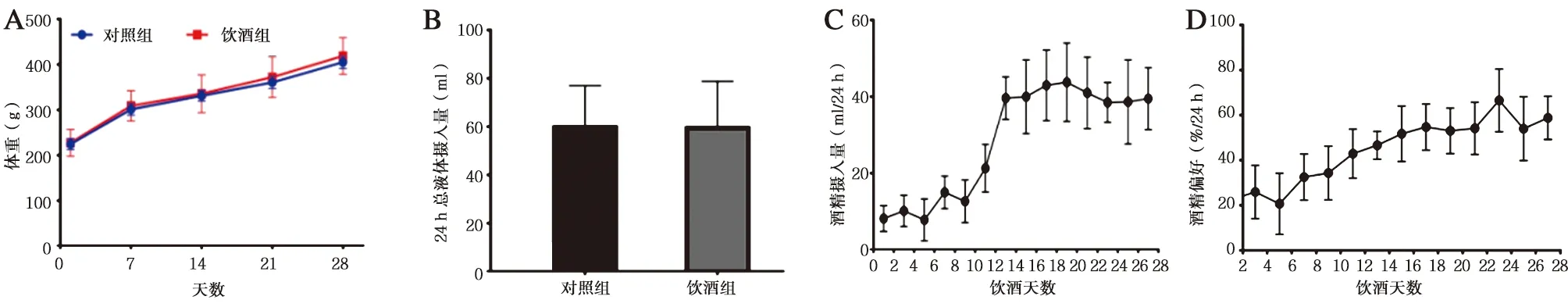
图1 SD大鼠建模过程中的变化
2.3 KCC2在酒精偏好中的作用酒精依赖模型建立成功后给予戒断72 h,戒断后给予VTA注射KCC2激活剂CLP290(50 μM)或抑制剂VU0240551(10 μM),与假手术组和DMSO组比较,CLP290组酒精偏好降低(见表1,F2,15=6.141,P=0.0113),而VU0240551组酒精偏好升高(表1,F2,15=4.885,P=0.0232),差异有统计学意义。
表1 VTA注射药物对酒精偏好的影响
2.4 KCC2在BDNF抑制酒精偏好中的作用机制为了进一步探究KCC2的作用,我们联合注药BDNF和VU0240551,发现VU0240551逆转了BDNF对酒精偏好的抑制作用(见表1,F2,15=6.256,P=0.0106),差异有统计学意义。
3 讨论
AUD是一种非常常见和复杂的疾病,因为酒精是世界上使用最广泛的成瘾性物质。酒精依赖对公共卫生、社会和私人生活产生了严重影响,并造成了巨大的社会负担[8]。酒精暴露主要是作用于各种离子型受体和信号分子,随着以AUD为特征的慢性酒精暴露,会引起神经适应性改变,导致成瘾和复饮等酒精依赖的特征。
中脑边缘DA系统起源于VTA,并向伏隔核、背纹状体、前额叶皮质、杏仁核投射,被认为与奖赏有关[9],所以本课题组以VTA作为研究对象。间歇性双瓶自由获取20%酒精模式目前被认为是操作简单、有效、结果可靠的酒精滥用和依赖的临床前研究范例,课题组以往研究发现该模型会达到逐步升级和稳定的饮酒基线,并发现在酒精戒断72 h时会引起再饮酒量升高[7]。所以我们选择在酒精戒断72 h给予VTA区注药。
BDNF在体内主要对神经元的发育分化起到促进和维持作用,增加突触的可塑性进而影响长时程增强(Long-term potentiation,LTP),在中枢神经系统和外周组织中与酪氨酸激酶B(Tyrosine receptor kinase B,TrkB)结合,对谷氨酸能和GABA能突触传递发挥作用[10]。临床前和临床研究表明BDNF与饮酒、依赖和复发有关[11],啮齿动物模型研究也表明,酒精暴露增加纹状体BDNF水平,而BDNF反过来通过激活一种依赖于丝裂原活化蛋白激酶的基因组机制来抑制酒精摄入[12]。而我们之前的研究也发现,慢性酒精暴露会改变VTA区BDNF表达,微量注射BDNF可以减弱大鼠酒精戒断后的饮酒量和戒断症状[7]。KCC2作为成熟神经元主要的氯离子排出体,在中枢神经元的生理功能上发挥着重要作用。中枢神经系统的多种病理是由于KCC2功能的降低,从发育畸形、脑肿瘤到神经退行性疾病。已有研究发现,在VTA区注入KCC2激活剂CLP290可以减弱大鼠应激后的酒精摄入量[6],也能减弱青春期尼古丁暴露大鼠在成年后的酒精消耗[13]。SD幼鼠联合麻醉及产后应激,导致成年后杏仁核KCC2发生显著变化并增加了酒精摄入量[14]。可见KCC2与酒精密切相关。研究发现,在神经损伤实验中,KCC2功能的变化与BDNF-TrkB有关[15]。为了研究慢性间歇性酒精暴露后KCC2是否参与BDNF对大鼠戒断后酒精偏好的影响,我们以SD大鼠为研究对象,在经过28 d的间歇性双瓶自由获取20%酒精后,给予戒断72 h,在VTA区微量注射CLP290,发现CLP290可以减弱大鼠戒断后的饮酒偏好,而微量注入VU0240551却增加了大鼠戒断后的饮酒偏好。由此可见KCC2可以调节大鼠酒精戒断后的饮酒行为。与之前的研究一致,VTA微量注射BDNF可以抑制大鼠戒断后的酒精偏好,通过给予KCC2抑制剂VU0240551,发现VU0240551阻断了BDNF对大鼠戒断后饮酒偏好行为的抑制作用。表明KCC2可能参与BDNF调控大鼠慢性酒精暴露戒断后的饮酒行为。
综上所述,KCC2可以调控SD大鼠慢性间歇性酒精暴露戒断后再饮酒时的饮酒行为,并能影响BDNF对酒精戒断的偏好作用,提示KCC2可能参与BDNF在VTA对酒精的神经回路调节,为酒精滥用和依赖的临床研究提供理论依据。
