任务导向的高中化学课堂教学实践
2022-07-13王海富
王海富


摘要:立足于高二学生的认知水平,对比分析不同版本教材相关内容,探究任务导向的盐类水解课堂教学实践。关键词:任务导向;盐类的水解;教学实践
文章编号:1008-0546(2022)07-0051-03中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.07.013
一、主题内容及相关研究
盐类的水解是高中化学知识的重要内容之一。要求学生通过这部分知识的学习,认识盐类水解的原理和影响盐类水解的主要因素;了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。《普通高中化学课程标准(2017年版2020年修订)》还增加了离子反应与平衡的应用的要求,包括“能调控溶液的酸碱性”“能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题”等基于真实情境的学业要求[1]。关于必做实验,使用“盐类水解的应用”这一具有鲜明应用取向的表达方式,而非“探究盐类水解的规律”,突出了重视真实任务情境、强调知识应用的特点[2]。
不同版本的教材对该内容的呈现也各有特色。人教版教材以“水溶液中的离子反应与平衡”为小标题,设计了“探究”和“思考与讨论”等多种活动形式,重点介绍盐类水解的知识,涉及水与盐之间的作用,应用化学平衡理论建立盐类水解平衡,得出盐溶液呈酸性、碱性的原因及其应用。
苏教版教材以“溶液中的离子反应”为小标题。首先是通过实验探究盐溶液的酸碱性,认识盐溶液并不都是中性;其次是归纳不同类型盐溶液显酸碱性的微观原因,认识盐类水解的本质;最后是“盐类的水解”概念定义、概念表达及概念应用。
鲁科版教材以“物质在水溶液中的行为”为小标题。首先通过实验探究不同盐溶液的酸碱性及其微观原因,认识盐类水解的本质、规律;其次通过实验和讨论,推测影响盐类水解平衡的因素;最后通过泡沫灭火器实验演示,引导学生利用“盐类的水解”原理解决实际问题。
笔者认为,教学时应充分挖掘不同版本素材,从宏观现象(不同盐溶液的pH)入手,围绕溶液中存在的粒子、粒子之间的反应、水解平衡的建立及其移动等微观本质,借助实验手段让学生从宏观辨识走进微观探析,理解盐类水解的规律;注意引导学生紧密联系生活,综合运用水解知识,强化学生理论联系实际的能力。
二、学生认知及教学目标研究
从学生素养提升角度看,需要关注以下方面。( 1)宏观辨识与微观探析:从盐的组成和结构上预测、探究验证盐类溶液的酸碱性,理解组成盐的离子在水中的反应规律;(2)模型认知与证据推理:以任务导向为前提,项目驱动盐类水解教学,发展学生建模能力;(3)变化观念与平衡思想:通过实验探究,理解盐类水解的本质和内在规律;(4)科学探究与创新意识:初步具备利用盐类水解知识去解决问题的能力,进一步提升科学探究能力,增强创新意识和社会责任感。
从学生可能存在的模糊概念和教学难点角度看,需要增加探究实验中加水、盐酸对氯化铁水解平衡的影响。学生在理解弱电解质概念与盐、水电离形成的离子之间反应的内在联系;盐的水解常数与水的离子积、弱电解质的电离常数之间的定量关系方面可能会存在困难。
三、教学设计思想及创新点
从探究氯化钠、碳酸钠等盐溶液的酸碱性入手,通过对实验现象的分析和讨论,引导学生预测盐溶液的酸碱性与组成该盐的酸和碱相对强弱之间的关系,以符号表征盐溶液中粒子间发生的反应及建立的平衡,引导学生从微观层面理解盐溶液呈酸碱性的本质。通过实验探究,揭示盐水解的内在规律,形成思维模型。引导学生利用盐类水解的原理净水、灭火等,将理论知识与实际应用相结合。
通过新颖的呈现方式激发学生主动参与学习过程,启发思维,培养其证据推理意识,突出了微粒观、变化观、平衡观等学科观念;将盐类水解的过程示意图化,将抽象的内容图示化,有利于学生从微观层面理解盐类水解平衡建立及移动的过程,从而降低学习难度,减少理论学习的枯燥感。
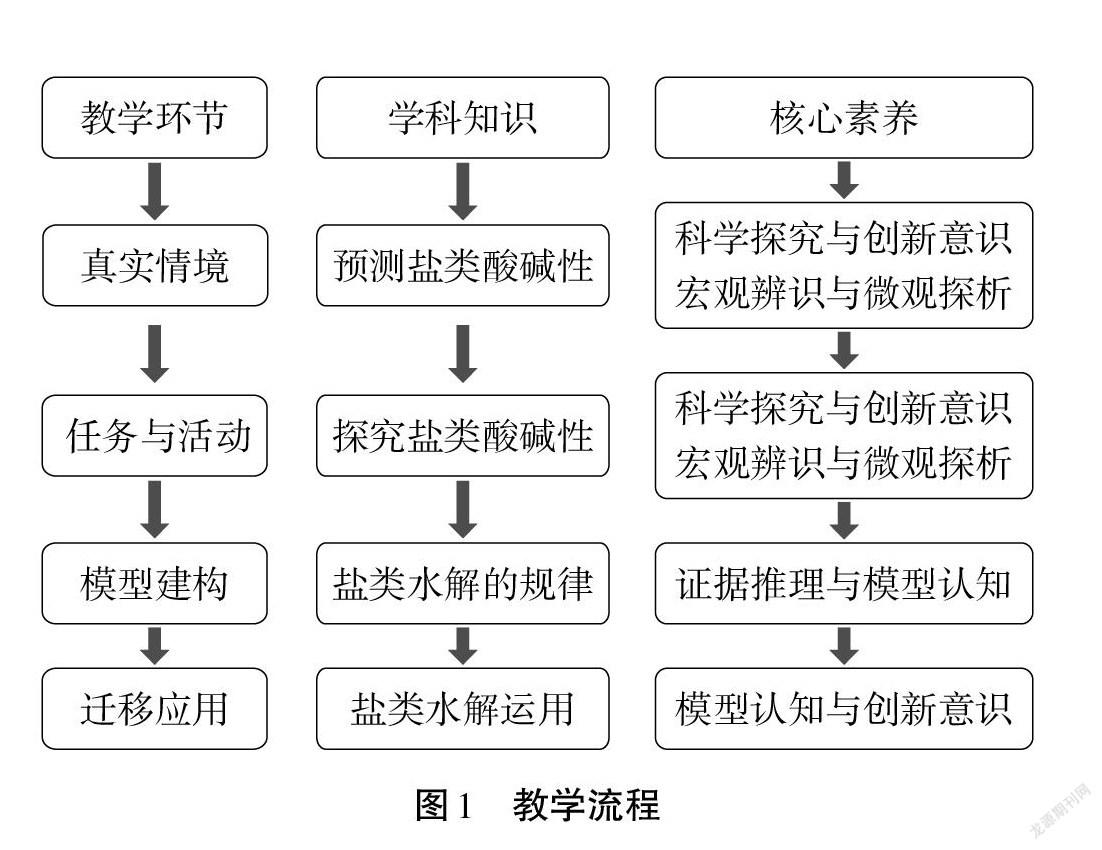
四、教学流程
教学流程如图1所示。
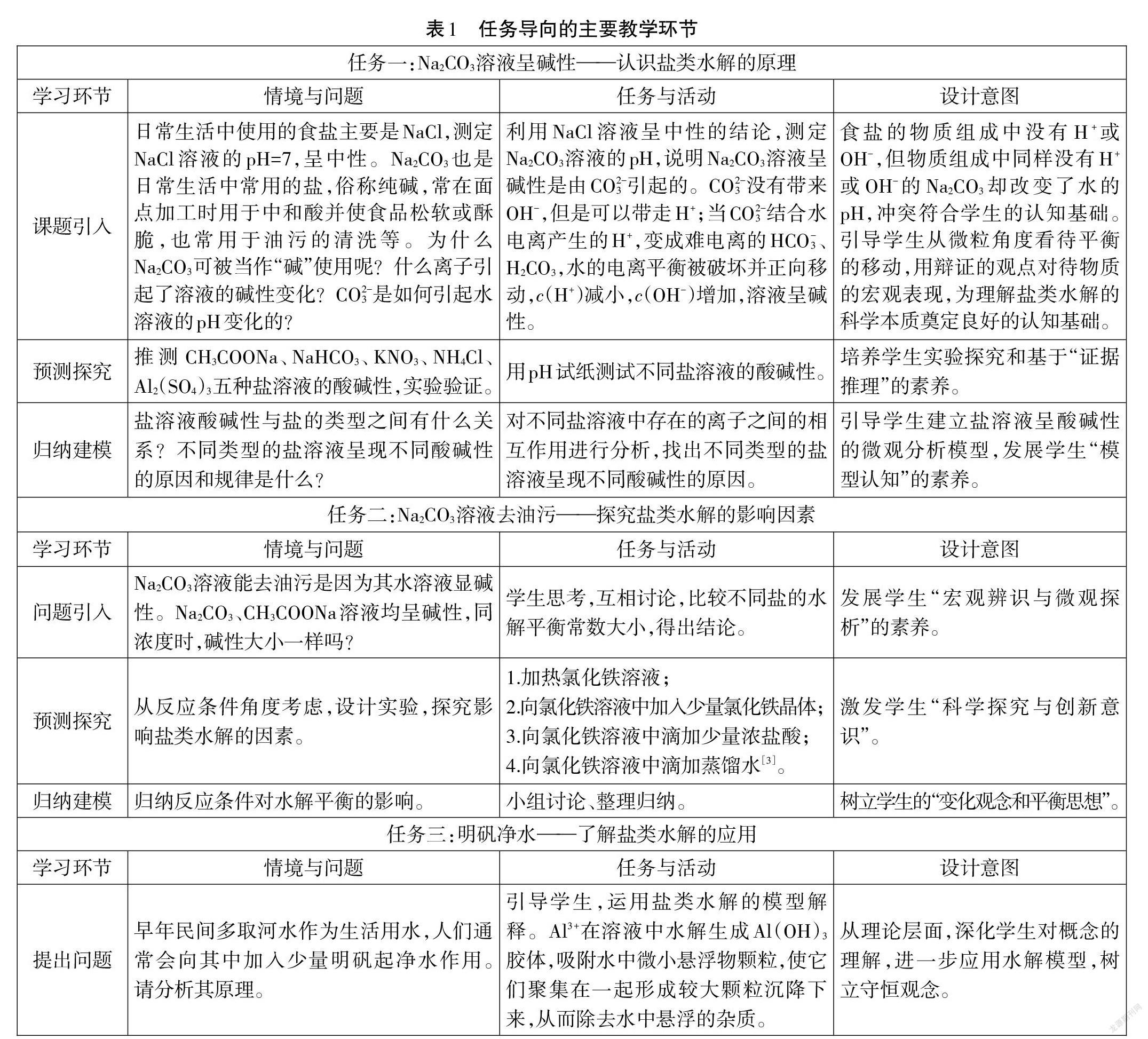
五、任务导向的主要教学环节
六、教学反思
本节课主要通过实验探究,从微观视角去探析离子之间的行为,构建盐类水解的概念和模型,形成对盐类水解本质认识;通过宏观辨识和证据推理,建立变化观念与平衡思想,进一步发展和应用盐类水解模型,增强学生的科学探究精神和对社会、生活的关注及责任意识。在介绍盐类水解的原理、影响因素和应用时,以“探究”“思考与讨论”“方法引导”“资料卡片”等形式,引导和培养学生举一反三、辩证思考的思维习惯和能力。
在教学设计时,将教学内容依据知识要点、学生认识发展点来分板块设计,以任务导向、项目驱动展开教学。以知识为线索的设计分为:水解概念→影响因素→应用;以学生的认识发展点为线索的设计分为:酸碱性如何→酸碱性强弱→酸碱性的启示。以碳酸盐溶液呈碱性引入课题,碳酸盐浓度不同碱性不同引入影响水解平衡的因素,最后是明矾水解在净水中的实际应用。这样一条线把三项任务进行串联,每项任务里面以“问题提出→预想推测→验证建模”为组织构建展开教学。
在教学环节注重对学生的方法引领、自主探究以及思维建模,没有追求面面俱到,力求方法介绍;没有追求知识呈现上的按部就班,力求问题整合。盐类水解概念引入打破常规设计的先实验后分析,改为先预测再探究分析;水解平衡移动影响中增加蒸馏水实验探究;水解应用在介绍了铝离子水解和双水解基础上模仿、迁移和拓展,增加了鲁科版灭火器双水解、古书修复的实际应用等,让教学环节更接地气。整个教学环节将核心概念和核心知识融合,在解决问题的过程中提升学生的思维能力,发展学生的化学核心素养。
当然在教学实践中,教师也要力求能把教材实验处理得当、分析到位。例如,在水解平衡移动影响的探究中,教师引导学生对蒸馏水影响平衡移动的原因分析时,要注意 Fe(OH)3只是最终形式[4],其实还有中间产物[Fe(H2O)5OH]2+、[Fe(H2O)4(OH)2] +、[Fe2(H2O)4 (OH)2 ]4 +等 [5-6],辩证理解浓度商 Q =c3(H+) 把Fe(OH)3当做 Fe3+水解的唯一形式,学生将会对类似的盐类水解无所适从,如 Ag++H2OAgOH+H+,当不考虑 Ag+水解存在的中间各种络合形式,就衡不移动,这与加入蒸馏水促进水解平衡是矛盾的。另外,实验中向棕黄色 FeCl3溶液中滴入2-3滴浓盐酸,溶液颜色变浅;当继续滴入浓盐酸时,溶液颜色变成亮黄色。教师在演示中需要控制好浓盐酸的量,因为随着浓盐酸加入量的增多,Cl-浓度增大,下述络合平衡:
[FeCl(H2O)5]2++Cl- [FeCl2(H2O)4]++H2O
[FeCl2(H2O)4 ]++2Cl-[FeCl4(H2O)2 ]-+2H2O 与 FeCl3水解平衡之间可能形成竞争,从而导致溶液颜色的变化。为减少 Cl-的竞争反应对实验的干扰,建议选择中等浓度的硫酸。苏教版教材在该实验探究时选择向硝酸铁溶液中滴加硝酸溶液,回避氯化铁,避免Cl-的影响,值得借鉴。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S]. 北京:人民教育出版社,2020:33-67.
[2] 王湛,等.普通高中化学课程标准(2017年版)解读[M].北京:人民教育出版社,2018:122-174.
[3] 人民教育出版社,课程教材研究所,化学课程教材研究中心. 普通高中教科书·化学反应原理(选择性必修1)[M].北京:人民教育出版社,2020:73.
[4]人民教育出版社,课程教材研究所,化学课程教材研究中心. 普通高中教科书·化学(必修1)[M]. 北京:人民教育出版社,2020:8.
[5]北京师范大学,华中师范大学,南京师范大學无机化学教研室. 无机化学(下册第四版)[M]. 北京:高等教育出版社,2007:770.
[6]宋天佑,等. 无机化学(下册第一版)[M]. 北京:高等教育出版社,2012:641.
