中学化学中“硅及其化合物”的疑点解析
2022-07-13丁淑媛王雨欣徐林唐亚文
丁淑媛 王雨欣 徐林 唐亚文






摘要:以中学化学“硅及其化合物”教学内容为例,指出教学实践中的疑点问题,并从基本理论、实验探究及图像分析出发,对粗硅的制备、玻璃瓶存放氢氧化钠、硅胶作干燥剂等疑点问题进行了探讨与甄辨,为“硅及其化合物”适应新课程标准下的课堂教学提供更加丰富的学习素材,促进学习者对化学学科的理解。
关键词:硅及其化合物;疑点解析;粗硅;玻璃;硅胶
文章编号:1008-0546(2022)07-0093-03中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.07.023
硅(Si),位于元素周期表第三周期,ⅣA族,是地壳中含量第二的元素,也是无机非金属材料的重要组成元素之一。从陶瓷、玻璃、水泥等传统硅酸盐制品到半导体硅晶体、介孔氧化硅、有机硅等新型材料[1,2],硅元素的发展对人类社会的进步起着巨大的推动作用。人教版高中化学必修(第二册)第五章第三节以“硅及其化合物”为主题,初步介绍了其性质和用途[3],旨在展现化学科学对研发新型材料的重要作用,帮助学生理解化学学科对社会进步的价值。从邵传强[4]、陶杰[5]、徐小健[6]等人的教学实践中可以看出,“单质硅的制备”“二氧化硅与氢氧化钠和氢氟酸的反应”“硅酸的制备与应用”等知识点共同构成了本节内容的教学要点,但对于“为什么碳还原制备单质硅生成的是一氧化碳”“为什么二氧化硅与氢氧化钠反应,却可以用玻璃瓶存放氢氧化钠”“为什么硅胶可以作为干燥剂”等问题未加以科学說明,或以工业生产经验和实验事实加以解释,缺乏对学生认识、学习化学学科的科学引导。本文即以上述问题为重点进行深入探究。
一、粗硅的制备
人教版高中化学必修(第二册)介绍了“工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅”[3],反应过程如下:
SiO2+ 2C = Si +2CO
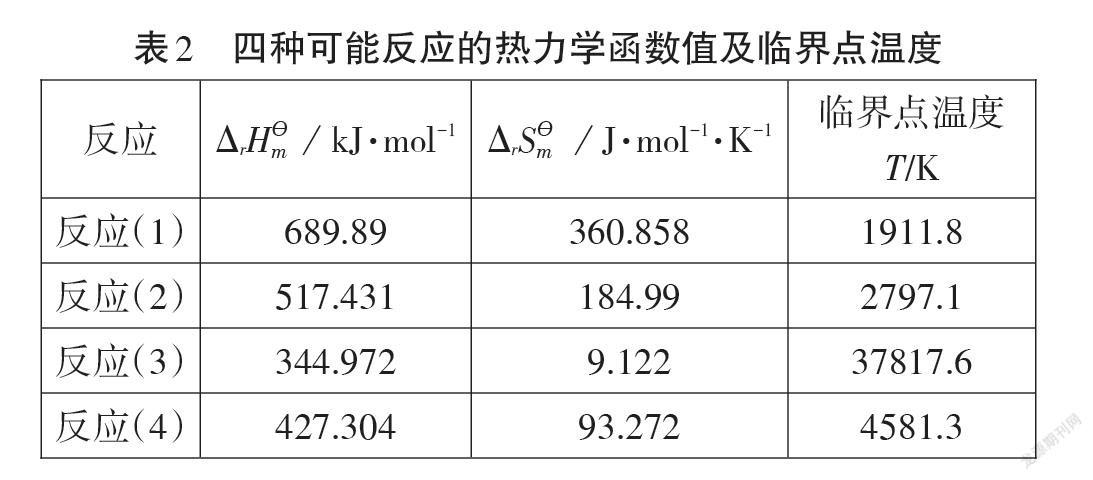
该反应与铁的冶炼过程形成较强的认知冲突,同样是以焦炭在高温环境下还原氧化物,为什么该反应的氧化产物是一氧化碳而不是二氧化碳?为什么使用碳作还原剂,而不使用一氧化碳或绿色还原剂——氢气?本文从化学热力学的角度出发,对氧化产物的可能情况和还原剂的选择反应(1)~(4)作出合理的解释。
SiO2(s)+2C(s)=Si(s)+2CO(g)
SiO2(s)+C(s)= Si(s)+CO2(g)
SiO2(s)+2CO(g)=Si(s)+2CO2(g)
SiO2(s)+2H2(g)=Si(s)+2H2O(g)
由于化学反应的焓变和熵变对298K 时数值的偏离程度较小[7],在忽略温度对焓变和熵变的影响基础上,我们选择热力学数据表(表1)中298 K 的反应焓变和熵变代替实际反应温度下的值,反应中各相关物质在298K 时的焓变和熵变值如表1所示。Δr Gm(Ө)( T)≈ΔrHm(Ө)(298K)-TΔrSm(Ө)(298K),令Δr Gm(Ө)( T)=0,便可计算出反应发生需要的临界点温度。
从表2可以看出:四种可能发生的反应均属于吸热熵增型反应,升高温度有利于反应向正反应方向发生,当反应温度大于临界点温度时,Δr Gm(Ө) <0,反应自发进行;焦炭被二氧化硅氧化为二氧化碳的临界点温度为2797.1 K,被氧化为一氧化碳的临界点温度为1911.8 K,而工业生产制粗硅的反应温度一般为 2073.15K~2273.15 K,超过了反应(1)的临界点温度,但没有达到反应(2)的临界点温度。因此,在实际工业生产中,C与SiO2反应更倾向于生成CO;一氧化碳、氢气还原二氧化硅的临界点温度分别为37817.6 K、4581.3 K,耗能巨大,这与工业生产的原则不符,粗硅的制备更倾向于选择使用焦炭作还原剂。
二、玻璃瓶为什么能存放氢氧化钠?
理论上,SiO2溶于 NaOH,方程式为:SiO2+2NaOH =Na2SiO3+H2O。但玻璃的主要成分是 SiO2,为何玻璃瓶能存放 NaOH?中学中往往从玻璃表面的光滑度与反应难易之间的关系进行解释,但根本原因并非如此。在水相体系中,通过调节溶液的 pH,利用硅酸盐水解生成的 SiO2沉淀往往是小分子的硅酸聚合物,聚合主要通过硅酸分子和硅酸负离子间的氧联反应实现[8]:
失水越多,聚合度越高,在水或NaOH 中的溶解度也就越小[9]。由于普通玻璃经过高温煅烧制得,其结构中硅原子与氧原子以 sp3杂化形式相互连接,形成稳定互联结构的无机高分子,因此很难与 NaOH 反应。为证明上述观点,本文设计如下实验进行证明:
各取2 mL 1 mol·L-1新鲜配制的 Na2SiO3溶液于4 只玻璃瓶(分别标号为 A、B、C、D 号)中,分别滴加2 mL 1 mol·L-1的盐酸溶液,可以观察到有白色胶状沉淀生成。将上述4个小玻璃瓶分别在电炉上加热0、5、15、25 min,冷却一段时间后,再向其中加入4 mL 1 mol·L-1 NaOH溶液,搅拌,充分反应15 min后,实验结果见图1。
观察图1发现,未经加热的 SiO2沉淀在氢氧化钠中完全溶解;随加热时间增长,xSiO2·yH2O 体系有部分结块现象,且在氢氧化钠中溶解度逐渐减小;而工业化高温制得的 SiO2(图1 中的 E)在 NaOH溶液中几乎不溶。上述结果能合理地解释氢氧化钠溶液可以储存在玻璃试剂瓶中的缘由。
三、硅胶吸水变色的化学原理
硅胶是常用的干燥剂,主要成分是SiO2。通常硅胶中含有微量的 CoCl2作为显色剂,在无水状态下呈蓝色,吸水后变成粉红色。由于硅胶中含有丰富的孔道结构以及稳定的表面含氧基团,这些含氧基团能够通过氢键作用,吸附空气的水分子,从而起到吸水作用[10]。但是中学生很难理解硅胶吸水变色的基本原理。因此,本文设计了一个简单实验,利用现代仪器分析方法,向中学生直观地证明硅胶的孔道结构和表面含氧基团的存在。具体实验如下:
取2 mL 1 mol·L-1 新配 Na2SiO3溶液于小玻璃瓶中,向其中逐滴加入约2 mL 1 mol·L-1新配制的盐酸溶液,有白色胶状沉淀生成;冷冻干燥后,取少量固体粉末样品进行表征。
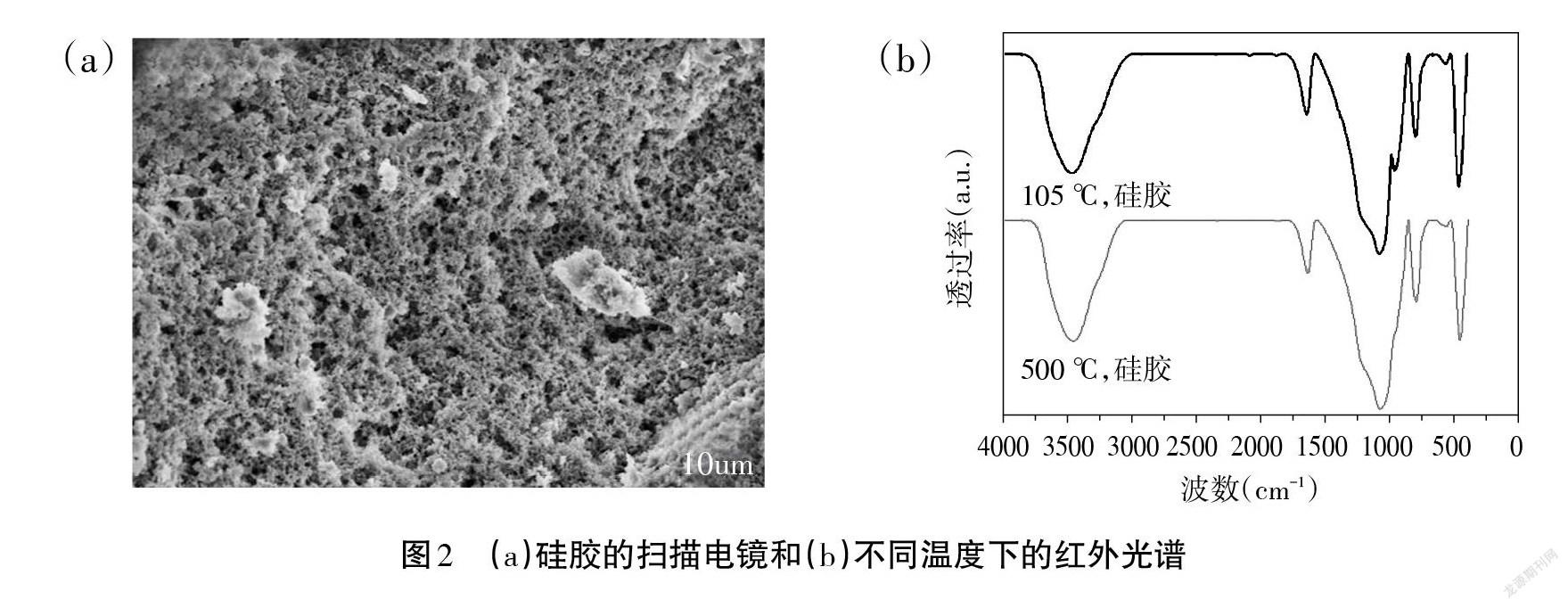
扫描电子显微镜(SEM)清晰地显示硅胶表面存在大量的孔隙结构,如图2a所示。将所得硅胶分别在105℃与500℃下热处理后,做红外测试。由图2b 可知,硅胶表面含有丰富的含氧基团,经500℃处理后,硅胶表面羟基峰强度有所减弱,其吸水能力从25.74%降低到23.47%,这说明硅胶表面的含氧基团具有较强的稳定性,且与其吸水能力有关联性。
四、结语
《普通高中化学课程标准(2017年版)》降低了“硅及其化合物”作为认识结果的要求,加强了其作为认识对象和认识素材的要求[11]。但这并不意味着“硅及其化合物”的知识要从中学化学中淡出,而是需要对相关知识的课堂教学作出适当的调整。本文通过化学基本理论、化学实验和化学分析测试方法,对中学化学中硅及其化合物的几个疑点问题给出了科学合理的解释,在丰富课堂学习资料的同时,也从事实上回答了“化学学什么”“化学怎么学”,有助于“宏观辨识与微观探析、科学态度与社会责任”等化学学科核心素养的生成。
参考文献
[1] 徐文豪,唐云,赵东元.“聚沙成塔”——硅元素及其化合物[J]. 化学教育(中英文),2020,41(2):1-8.
[2] 梅蕊,杨水金.硅元素的发展及其在生产科技与生活中的应用[J]. 化学教育(中英文),2019,40(15):1-5.
[3] 人民教育出版社,课程教材研究所,化学课程教材研究中心.普通高中教科书化学必修(第二册)[M]. 北京:人民教育出版社,2019:19-24.
[4] 邵传强.基于人文背景融合学科核心素养的化学教学设计与实践——以“含硅礦物与信息材料”教学为例[J]. 化学教学,2020(12):41-45,51.
[5] 陶杰,李远蓉,朱曙,肖富林.促进分类思想形成的“硅”教学设计[J]. 化学教育(中英文),2018,39(13):10-15.
[6] 徐小健.基于证据推理的化学生态课堂教学——以“无机非金属材料的主角——硅”为例[J]. 化学教育(中英文),2019,40(1):7-9.
[7] 潘书恒,程萍. C 与SiO2反应的热力学分析[J]. 化学教学,2021,4(2):91-97.
[8] 杨修造.谈谈硅酸钠与酸的反应[J]. 化学通报,1989(11):58-60.
[9] 傅鹰.大学普通化学(下册)[M]. 北京:人民教育出版社,1981(7):455-456.
[10]陈灵智,徐建中,焦运红.高吸附性活性炭制备及应用进展[J]. 炭素技术,2014,33(6):37-41.
[11]叶跃娟,林海斌.高中化学新教材中铝和硅元素的知识编排及教学逻辑[J]. 化学教学,2021(4):87-92.
