以乳极性脂/蛋白为界面脂滴的体外消化特性研究
2022-07-12梁少华
冯 坤,孙 聪,梁少华
河南工业大学 粮油食品学院,河南 郑州 450001
人乳脂肪是新生儿发育的主要能量来源,对婴幼儿的生长起促进作用。在母乳中,脂肪以乳脂肪球(MFG)的形式稳定存在,其核心为甘油三酯(TAG,约占总脂质的98%)[1],外部由具有三层结构的薄膜包被,是一种主要由极性物质(如磷脂和蛋白质)组成的具有特殊功能的天然膜,被称为乳脂肪球膜(MFGM)[2]。MFGM作为一种油水界面物质,能够参与脂肪的消化、吸收和代谢过程[3],有助于婴儿认知和免疫功能的提高[4],对生长发育至关重要。
婴儿配方奶粉作为母乳的替代品,其发展趋势是全面模拟人乳脂的组成、结构和营养特性,与人乳脂相似至关重要[5]。目前,市售婴儿配方奶粉多采用植物油复合调配,依靠酪蛋白、乳清蛋白或卵磷脂等乳化剂,经过热处理、均质等一系列加工过程,形成粒径较小(0.3~0.8 μm)的脂滴,表面主要由酪蛋白和乳清蛋白覆盖。研究表明,尽管婴儿配方奶粉中的脂滴具有更小的脂肪颗粒,但母乳中的脂肪更容易被水解[6]。这种与母乳MFGM组成的差异影响了脂肪在婴儿胃肠道的消化代谢[7]。研究表明,MFGM中的极性脂组分可通过静电相互作用促进脂肪酶的定向和吸附,从而促进婴儿对人乳脂的高效消化[8]。
近些年来,人们致力于研究影响婴儿消化的因素,大多集中于甘油三酯(TAG)结构及脂肪球粒径等。Fave等[9]发现不同TAG结构影响脂质消化后产物的释放和吸收,TAG结构对脂质消化的影响主要取决于其作用机制;Garcia等[10]发现小粒径(1.7 μm)天然脂肪球在消化时的水解率约为大脂肪球(6.6 μm)的2倍,原因是小脂肪球的表面积更大,增大了酶的接触面积。现有的研究极少关注脂滴界面组分在消化过程中发挥的积极作用。
为了探究脂滴的界面组成对婴儿消化的影响,作者以牛乳来源的酪乳粉为原料,提取并浓缩得到乳极性脂(MPL),分别以MPL和酪蛋白酸钠(CN)为乳化剂构建不同界面组成的脂滴,采用婴儿胃肠道体外消化模型,分析消化过程中乳脂消化速率和消化产物的变化,为开发具有极性脂界面的脂滴提供理论依据。
1 材料与方法
1.1 原料与试剂
酪乳粉:新西兰恒天然有限公司;INFAT®婴儿专用油脂(OPO:21.21%;C16∶ 0:20.45%;C18∶ 1:36.67%;C18∶ 2:23.28%):浙江杭州贝因美有限公司。
酪蛋白酸钠(CN)、氘代氯仿(CDCl3)、磷酸三苯酯(TPP):上海麦克林生化试剂有限公司;米根酶脂肪酶(500 U/mg)、胃蛋白酶(695 U/mg)、胰液素:上海西格玛奥德里齐贸易有限公司;牛胆盐(胆酸≥70%):北京索莱宝科技有限公司;氯仿、甲醇、丙酮、乙醚、磷酸二氢钠、磷酸氢二钠、氯化钠、乙二胺四乙酸二钠(EDTA-Na+)等试剂均为分析纯。
1.2 仪器与设备
Agilent 7890A气相色谱仪:美国安捷伦科技有限公司;AVANCE Ⅲ HD 500 M 超导核磁共振波谱仪(NMR):瑞士Bruker公司;Marvern Z90激光粒度电位测定仪、Mastersizer 3000 激光粒度仪:英国马尔文仪器有限公司;ULTRA-TURRAX T10高速剪切乳化机、恒温磁力加热搅拌器:德国IKA公司;LD5-10台式低速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 酪乳粉中脂肪的提取
取4.5 g酪乳粉于烧杯中,加入30 mL 45 ℃水(煮沸后冷却),完全溶解,采用氯仿-甲醇法提取酪乳粉中的脂肪[11]。
1.3.2 乳极性脂的浓缩
采用丙酮萃取法进一步浓缩所提取脂肪中的乳极性脂:向脂肪中加入10倍体积的丙酮,充分搅拌后,放入4 ℃冰箱中过夜,静置分层。取下层固体,经旋转蒸发、氮吹后得乳极性脂浓缩物,放入-20 ℃冰箱中储存。
1.3.3 乳极性脂中磷脂的组成及含量测定
参考文献[12]的方法制备所需溶剂。精确称取约5 mg的TPP,溶于50 mL CDCl3中作为内标溶液;制备0.2 mol/L pH 7.0的EDTA-Na+溶液,用1 mol/L NaOH溶液调节pH值至7.0。
样品处理:称取浓缩后的乳极性脂样品200 mg于15 mL离心管中,依次加入0.5 mL 甲醇、0.5 mL 0.2 mol/L EDTA-Na+溶液和0.5 mL 含有TPP的CDCl3溶液,充分混合至所有样品溶解后离心(4 000 r/min,5 min),吸取500 μL下层清液至核磁管中进行分析。核磁共振的参数设置参照文献[13]的方法。
1.3.4 乳液的制备
乳液由水相和油相(INFAT®婴儿专用油脂)组成。将乳化剂(CN、MPL)均匀分散在磷酸盐缓冲液中,充分搅拌溶解后,放入4 ℃冰箱中过夜。将油相以8%(质量比)与水相混合后,使用高速剪切乳化机在9 000 r/min下预混3 min,然后以26 000 r/min剪切3 min,分别制备以蛋白、MPL包被的脂滴(CN组、MPL组)。
1.3.5 粒径和电位的测定
样品稀释100倍后采用激光粒度仪在25 ℃测定粒径;样品稀释10倍后采用激光粒度电位仪进行电位的测定。
1.3.6 体外消化模型的建立
基于文献[14]的方法,稍做修改,建立婴儿胃肠道体外消化模型。
模拟胃液的配制:在100 mL去离子水中加入NaCl(2 g/L)和盐酸(7 g/L),调节pH值为5.5。加入胃蛋白酶和米根酶脂肪酶,使其在体系中的终质量浓度为0.4 mg/mL和0.886 7 mg/mL。
模拟肠液的配制:在100 mL磷酸缓冲液中加入NaCl(26.32 g/L),调节pH值为6.5。加入胰液素和胆盐,使其在体系中的终质量浓度为1.6 mg/mL和1.25 mg/mL。
1.3.7 模拟体外消化
胃消化阶段:取配制的胃液30 mL与60 mL乳液混合,置于250 mL三颈烧瓶中,迅速调节体系pH值 为5.5,于37 ℃反应1 h。采用 0.1 mol/L NaOH溶液使混合体系的pH值保持恒定,记录不同时间消耗NaOH的量,定期取出一部分样品,并立即加入0.1 mol/L的HCl溶液灭酶,以备后续分析。
肠消化阶段:取经胃消化后的样品40 mL与40 mL肠液混合,置于250 mL三颈烧瓶中,迅速调节体系pH值为6.5,于37 ℃反应2 h。添加0.1 mol/L NaOH 使混合体系的pH值保持恒定,记录不同时间消耗NaOH的量,定期取样后立即加入0.1 mol/L的HCl溶液灭酶,以备后续分析。
1.3.8 体外消化过程的表征
1.3.8.1 游离脂肪酸释放量的测定
根据消化过程中NaOH的消耗量测定样品中脂肪酸的释放量。
FFA=V×c×1 000,
式中:FFA为消化过程中游离脂肪酸释放量,μmol;V为消耗NaOH 的体积,mL;c为NaOH 溶液的浓度,mol/L。
1.3.8.2 粒径和电位的测定
消化过程中粒径和电位的测定同1.3.5。
1.3.8.3 脂质组成的分析
乳液消化产物中的脂肪采用氯仿-甲醇法进行提取:取消化后的10 mL样品,加入30 mL氯仿/甲醇溶液(1∶ 2,V/V),超声提取5 min后,加入10 mL氯仿搅拌约1 min,最后再加入10 mL蒸馏水搅拌后静置20 min。收集静置后的有机相,用旋转蒸发仪去除溶剂,旋蒸后的样品经氮吹后保存于-20 ℃备用。
甘油酯组成分析:正己烷溶解提取出的脂质,进气相色谱分析。采用Agilent DB-1HT 色谱柱(30.0 m×250 μm×0.1 μm ),进样口温度350 ℃,氢火焰离子化检测器温度400 ℃,载气为氮气,流速15.0 mL/min,分流比5.0。初始温度100 ℃,保留1 min;50 ℃/min 升温至220 ℃,保留2 min;15 ℃/min升温至290 ℃,保留2 min;40 ℃/min升温至320 ℃,保留6 min;20 ℃/min升温至360 ℃,保留16 min。
脂肪酸组成分析:分离后的游离脂肪酸(FFA)采用三氟化硼-甲醇法进行甲酯化处理,分离后的单甘酯(MAG)采用简易甲酯化方法进行处理。采用气相色谱仪分析脂肪酸组成:SGC BXP-70毛细管柱(30.0 m×250 μm×0.25 μm),进样口温度250 ℃,氢火焰离子化检测器温度260 ℃,载气为氮气,流速1.0 mL/min,分流比1∶50。初始温度170 ℃,以2 ℃/min升温至210 ℃。
1.4 数据处理
采用Origin 2018软件制图。
2 结果与讨论
2.1 乳极性脂中磷脂的组成与含量
表1为酪乳粉总脂和浓缩乳极性脂中3种主要磷脂组分的含量,酪乳粉中鞘磷脂(SM)含量较高,与文献[15]结果相一致。经丙酮浓缩后,磷脂酰乙醇胺(PE)、磷脂酰胆碱(PC)、SM含量均有增加,总含量达30.5%,结合文献[10,16-17]可知,此样品可作为具有乳极性脂界面脂滴的原料。
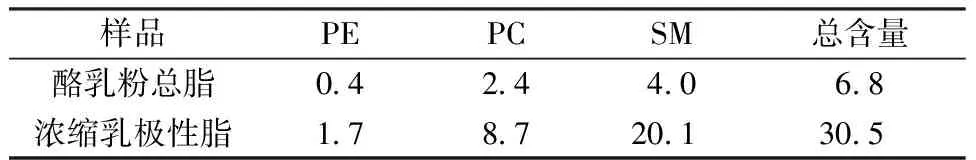
表1 酪乳粉总脂及浓缩乳极性脂中主要 磷脂组分含量Table 1 Main phospholipid components in total fat of buttermilk powder and concentrated milk polar fat %
2.2 乳液的初始粒径
表2是以CN和MPL为乳化剂制备脂滴的平均粒径D[4,3]、D[3,2]和比表面积。脂滴的粒径是影响婴儿消化的关键因素之一[18],因此,本研究所制备的脂滴的粒径较为相近,以CN和MPL为界面的脂滴平均粒径D[4,3]分别为10.1 μm和10.4 μm,D[3,2]分别为3.72 μm和3.57 μm。

表2 脂滴的初始粒径及比表面积Table 2 Initial particle size and specific surface area of the lipid droplets
2.3 消化过程表征
2.3.1 消化过程中粒径的变化
通过模拟婴儿肠胃道消化环境,对两种具有不同界面组成的脂滴进行体外消化,消化过程中D[3,2]的变化如图1所示。
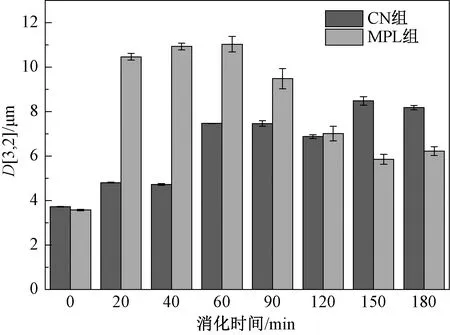
图1 消化过程中脂滴D[3,2]的变化Fig.1 Changes in D[3,2] of lipid droplets during digestion
由图1可知,在胃消化初期(20 min),两种脂滴的平均粒径均有所增大,这是由于在胃蛋白酶和胃脂酶的共同作用下,脂肪球发生聚集,粒径变大,同时脂解反应释放出的游离脂肪酸附着在脂滴表面使聚集加剧。在模拟胃液消化过程中,随着反应的进行,两组脂滴的平均粒径均呈增大趋势,其中MPL组脂滴的平均粒径均大于CN组脂滴。在模拟肠液消化过程中,随着pH值的回升及胆盐的加入,聚集的脂滴重新分散。脂滴平均粒径先减小后逐渐趋于平稳,表明随着反应的进行脂肪酶被消耗,脂滴表面的物质不再发生变化,平均粒径趋于稳定。图2为两种脂滴在胃、肠消化过程中的粒径分布,与CN组相比,MPL组脂滴在胃消化过程中出现了较大的粒径峰,这可能是因为由小分子磷脂形成的界面比其他乳化剂形成的界面涂层抗聚集能力差[19]。MPL组中的粒径峰在肠消化过程中不断减小,表明MPL组中的脂滴能够更加持续、平稳地进行消化。
2.3.2 消化过程中Zeta-电位的变化
图3为CN组和MPL组脂滴在消化过程中Zeta-电位的变化,CN组和MPL组脂滴的初始电位(0 min)分别为-35.47、-57.08 mV,这种高强度的负电荷在液滴之间产生了较强的排斥力,从而阻止它们聚集。在整个消化过程中,MPL组脂滴的Zeta-电位绝对值始终大于CN组,其可能与MPL自身的化学基团有关,如磷酸基团、羧基基团和氨基基团[20]。胃消化初期,两组乳液脂滴的Zeta-电位绝对值显著降低,其脂滴表面的静电斥力不足以稳定分散,这也部分解释了在胃消化时期由于脂滴聚集造成粒径增大的现象。
在肠消化初期,两组脂滴的Zeta-电位均呈现显著增加的现象,这与文献报道相一致[21-22]。当脂滴与模拟肠液混合后,胆盐会置换脂滴原有的界面,造成电位的增加。此外,脂肪酶不断吸附在脂滴表面并水解TAG,形成的水解产物(如FFA和MAG)在界面的积累,也会造成表面电荷的增加[23]。MPL组脂滴的Zeta-电位绝对值始终高于CN组,表明以MPL为界面的脂滴在肠消化过程中脂滴之间的静电斥力较强,有利于消化反应的进行。

图2 脂滴在消化过程中的粒径分布Fig.2 Particle size distribution of lipid droplets during gastric and intestinal digestion

图3 脂滴在消化过程中的Zeta-电位Fig.3 Zeta-potential of lipid droplets during digestion
2.3.3 游离脂肪酸的释放动力学
图4为两种脂滴婴儿体外胃肠道消化过程中的脂肪酸释放量。在胃消化过程中,相较于CN组,MPL组脂滴释放更多的脂肪酸。在消化初期(0~10 min),脂肪酸释放速率较快,因为消化初期的底物浓度较大,与脂肪酶充分接触。随着反应的进行,脂肪酸释放率降低,表明随着反应的进行,脂肪酶逐渐被消耗,降低了脂解速率[11]。消化30 min后,MPL组脂滴表现出较高的脂肪酸释放速率及释放量,表明以MPL为界面组分的脂滴具有更好的消化特性。
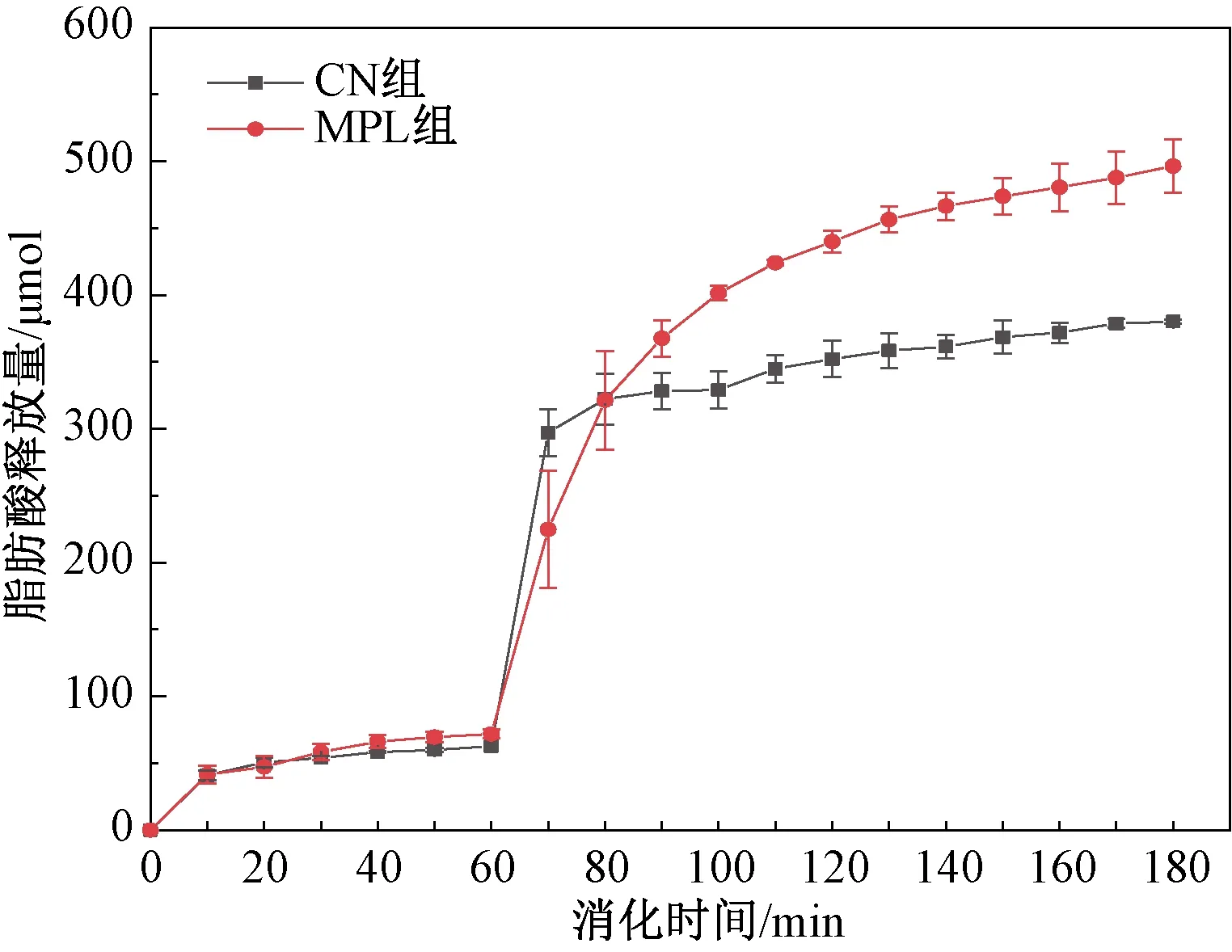
图4 脂滴在消化过程中的脂肪酸释放量Fig.4 Fatty acid release amount of lipid droplets during digestion
由图4可知,在肠消化初期,CN组与MPL组脂滴均表现出较高的脂肪酸释放速率,这是由于反应初期底物浓度较高,并且胆盐具有较高的表面活性,脂肪酶被迅速吸附到界面进行水解。此外,胆盐的存在可以有效清除胃消化结束时附着在脂滴表面的脂解产物,从而增加脂肪酶与脂滴接触的表面积。当进入肠消化初期(60~70 min)时,CN组脂滴的消化速率高于MPL组。在消化80 min后,MPL组具有较高的脂肪酸释放率,这可能是由于胰液素是一种混合消化酶,其含有的磷脂酶和胆盐对磷脂的水解具有协同作用[24],从而使TAG核心更快地暴露在界面,增加酶与底物的接触面积。随着反应的进行,两种脂滴的释放趋势逐渐平缓,这是由于反应不断消耗脂肪酶和不断释放FFA、MAG和甘油二酯(DAG)等活性物质,其吸附在脂滴表面会抑制反应的进行。MPL组脂滴的脂肪酸释放量高于CN组,这一结果与Zeta-电位结果相一致。
2.3.4 消化过程中脂解产物的变化
图5为消化过程中两种脂滴的甘油酯组成。CN组和MPL组脂滴在胃消化过程中,TAG含量明显降低,主要转化为DAG和FFA,生成MAG的量较少,这可能是由于胃脂酶结合在脂滴表面时,更倾向于脂解TAG分子中sn-3位的脂肪酸[25]。在胃消化20 min时,FFA含量显著增加,随着反应的进行呈现缓步上升的趋势。胃消化终点时,CN组和MPL组脂滴中TAG含量分别为22.58%和26.52%,表明胃蛋白酶在CN组脂滴消化过程中发挥了较大的作用。在肠消化初期(90 min),TAG和DAG含量明显下降,FFA含量急剧增加,表明在这个阶段TAG和DAG的脂解反应同时进行,生成较多的FFA,这是因为胰脂酶对TAG和DAG的sn-1,3位均具有活性。在肠消化终点,CN组和MPL组脂滴的TAG含量分别为11.22%和8.15%,与之前FFA释放量结果一致。

图5 两种脂滴在消化过程中的甘油酯组成Fig.5 Glyceride composition of two lipid droplets during digestion
2.3.5 消化过程中脂肪酸组成的变化
图6为两种脂滴在胃、肠消化终点时所释放的游离脂肪酸组成。在胃消化终点,CN组和MPL组脂滴释放的主要脂肪酸为油酸、亚油酸和棕榈酸,占总脂肪酸的70%以上。其中,油酸含量在CN组和MPL组分别达到40.19%和39.67%,这与所选油相为OPO型专用油脂有关。此外,还有一定的辛酸、癸酸、月桂酸、豆蔻酸以及亚麻酸释放。在脂肪酸释放种类上,CN组与MPL组在胃消化过程中并无显著差异。在肠消化终点,释放的主要脂肪酸仍为油酸、亚油酸和棕榈酸,但MPL组较CN组脂滴释放较多的游离棕榈酸。

图6 胃、肠消化终点的游离脂肪酸组成Fig.6 Free fatty acid composition at the end of gastric and intestinal digestion
图7为两种脂滴在胃、肠消化终点时MAG的脂肪酸组成。CN组和MPL组在各阶段消化终点释放的MAG均为月桂酸、棕榈酸、油酸和亚油酸MAG,其中饱和脂肪酸MAG的含量均低于不饱和脂肪酸MAG。在胃消化终点,CN组与MPL组脂滴释放的MAG组成并无显著性差异。在肠消化终点,两组脂滴释放的油酸MAG和亚油酸MAG含量降低,棕榈酸MAG含量增加。CN组释放了较多的棕榈酸MAG,而MPL组释放了较多的月桂酸MAG、油酸MAG和亚油酸MAG。从胃阶段到肠阶段,两组脂滴均释放了较多的饱和脂肪酸MAG,其中CN组脂滴的释放量更多。
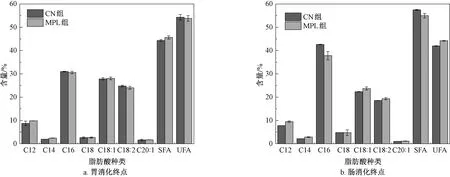
图7 胃、肠消化终点的单甘酯脂肪酸组成Fig.7 Fatty acid composition of monoglycerides at the end of gastric and intestinal digestion
3 结论
本研究从酪乳粉中提取并浓缩制得MPL,以MPL和CN为乳化剂制备了具有不同界面组成的脂滴,研究了两者的消化特性。结果表明,在粒径相近的基础上,界面组分对脂滴的消化具有一定影响。在整个消化过程中,MPL组脂滴的FFA释放量高于CN组,脂解程度较高,且MPL组在肠消化过程中的粒径峰显著下降,脂滴的脂解程度更高;MPL组脂滴的Zeta-电位处于较高水平,表明其消化过程中的稳定程度较高。CN组在消化终点释放了较多的棕榈酸单甘酯,而MPL组则释放了较多的游离棕榈酸、油酸单甘酯和亚油酸单甘酯。总的来说,以MPL为界面的脂滴具有更好的消化特性,更适合婴儿的消化。因此,在婴儿配方奶粉的实际生产中,适当地添加MPL对婴儿的消化是有益的。值得注意的是,由于体内消化的复杂性,体外消化很难完全模拟婴儿体内真实的消化情况,因此,需要开发与体内消化更加相似的消化模型,进一步探究界面组分对婴儿消化的影响。
