甘丙肽在肥胖型多囊卵巢综合征患者中的高表达及其意义
2022-07-10张真稳扬州大学临床医学院内分泌科江苏省苏北人民医院内分泌科江苏扬州22500南京鼓楼医院集团仪征医院内分泌科江苏仪征25004
陈 丹,张真稳 (.扬州大学临床医学院内分泌科,江苏省苏北人民医院内分泌科,江苏 扬州 22500;2.南京鼓楼医院集团仪征医院内分泌科,江苏 仪征 25004)
多囊卵巢综合征(PCOS)是一种临床表现多样、多伴随疾病的内分泌疾病,常见于育龄期妇女。多囊卵巢综合征患者50%以上合并肥胖,远高于人群肥胖率,且常呈腹型肥胖[1-3]。PCOS患者中约50%存在不同程度的高胰岛素血症及胰岛素抵抗。近年来脂肪细胞被定义为一种内分泌组织,分泌多种细胞因子,参与运动保护、能量平衡、血脂代谢等生理过程的调节[4-5]。其中,甘丙肽(GAL)是一种重要的神经多肽,参与多种中枢调节活动,其可以通过多个途径影响胰岛素功能。本文选取2017年8月~2018年7月江苏省苏北人民医院、南京鼓楼医院集团仪征医院内分泌科就诊的肥胖型PCOS患者30例及正常育龄期女性30例为研究对象,通过测定研究对象糖耐量试验中空腹及餐后2 h血糖、胰岛素、GAL等指标,分析GAL在肥胖PCOS患者中的表达及其在PCOS胰岛素抵抗中可能的意义,为PCOS的临床诊治提供理论基础。
1 资料与方法
1.1一般资料:选取2017年8月~2018年7月江苏省苏北人民医院、南京鼓楼医院集团仪征医院内分泌科门诊就诊的30例育龄期肥胖PCOS患者为试验组,同期正常体重的30例育龄期妇女为对照组,PCOS诊断标准为:①稀发排卵或无排卵;②高雄激素的临床表现和(或)高雄激素血症;③超声表现为多囊卵巢(一侧或双侧卵巢直径2~9 mm的卵泡≥12个)和(或)卵巢体积≥10 ml;④上述3条中符合2条,并排除其他可能引起高雄激素和排卵异常的疾病即可诊断为PCOS。BMI>28 kg/m2诊断为肥胖,本次研究经过本院医学伦理委员会同意。
排除标准:①合并各重慢性感染性疾病;②近期有急性感染病史;③既往有严重自身免疫性疾病、系统性疾病、肿瘤等疾病;④半年内使用过抗生素、类固醇激素、性激素等药物。
1.2方法:利用葡萄糖耐量实验(OGTT)测定研究对象的空腹、餐后2 h血糖和胰岛素含量;通过酶联免疫吸附法检测空腹血浆GAL、餐后2 h血浆GAL;其中,胰岛素抵抗指数(HOMA-IR)=空腹血糖(mmo/L)×空腹胰岛素/22.5;胰岛素敏感指数(ISI-OGTT)=10 000/SQRT(FPG×FPI×G×I),FPG 表示空腹血糖,FPI表示空腹胰岛素,SQRT为平方根计算,G为OGTT试验各点血糖平均值,I为OGTT各点胰岛素平均值。
1.3统计学方法:利用SPSS23.0统计软件对数据进行统计分析,同组实验数据采用Spearman检验,在Spearman检验中,分别以对照组、试验组、整体数据为样本空间进行统计计算;不同试验组之间利用t检验对同一参数进行分析;P<0.05为差异有统计学意义。
2 结果
2.1两组临床资料及生化指标比较 :肥胖PCOS组患者与正常对照组相比,年龄、身高、妊娠情况等一般临床资料比较,差异无统计学意义(P>0.05)。两组生化检测指标见表1,肥胖型PCOS组患者空腹血糖为(5.34±0.14)mmol/L、空腹胰岛为素(21.39±1.43)μIU/ml、餐后2 h血糖为(8.35±0.34)mmol/L、餐后2 h胰岛素为(69.58±5.05)μIU/ml、HOMA-IR为5.03±0.33、ISI-OGTT为6.18±0.54、空腹GAL(62.00±6.21)pg/ml及餐后2 h GAL(56.11±6.55)pg/ml,均明显高于对照组,差异有统计学意义(P<0.01)。肥胖PCOS患者的HOMA-IR为5.03±0.33,较对照组显著升高,差异有统计学意义(P<0.01),提示肥胖型PCOS患者存在严重的胰岛素抵抗。

表1 两组血糖、胰岛素、甘丙肽比较
2.2GAL与BMI、HOMA-IR相关性:以Spearman检验方法分别检验GAL与BMI、HOMA-IR的相关性,结果见表2。在对照组中GAL与BMI、HOMA-IR无相关性(r=0.128,P=0.304;r=0.254,P=0.175),在肥胖型PCOS组中GAL与BMI、HOMA-IR无相关性(r=0.136,P=0.474;r=0.201,P=0.286)。当以整体为研究对象时,GAL和BMI、HOMA-IR均呈现出正相关性(r=0.473,P=0.001;r=0.579,P=0.001),即GAL含量存在层次性变化,说明GAL与肥胖型PCOS存在多重联系。

表2 BMI、HOMA-IR与空腹GAL的Spearman检验
在进一步研究中,以整体(n=60)为对象,进行了BMI和GAL、HOMA-IR与GAL的回归模型拟合,见图1。
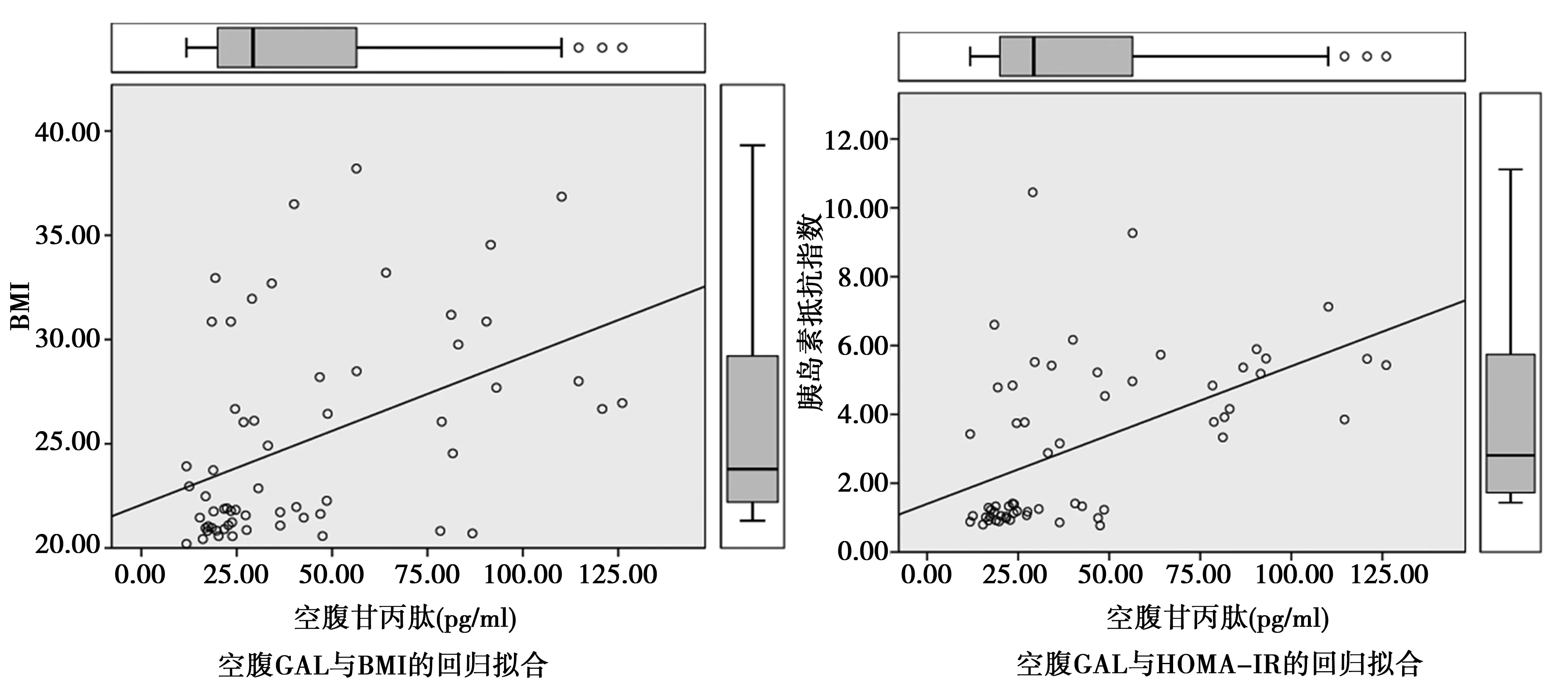
图1 BMI、GAL、HOMA-IR回归拟合图
3 讨论
PCOS患者伴发胰岛素抵抗的比例为50%~70%[6-8],在本临床研究中,肥胖型PCOS的血糖、胰岛素浓度均显著高于正常育龄期妇女,且伴发胰岛素抵抗的比例高达100%,提示肥胖可以加重PCOS患者的胰岛素抵抗。对于PCOS伴发胰岛素抵抗的机制尚不明确,体内游离脂肪酸(FFA)过高、胰岛素信号转导途径异常、细胞因子紊乱等都是肥胖PCOS伴发IR的重要途径[9-12]。目前已发现以下几条途径可能导致PCOS中胰岛素抵抗的发生:①脂肪细胞因子能够抑制胰岛素转运过程,肿瘤坏死因子-α(TNF-α)能够激活胰岛素受体底物-1(IRS-1)丝氨酸磷酸化,进而抑制脂肪细胞中葡萄糖载体蛋白4的表达,最终导致胰岛素抵抗[13-14];②脂肪因子含有类胰岛素结构,可以通过与胰岛素特异性受体竞争性结合致使胰岛素与受体结合效率下降,干扰胰岛素下游信号通路传导;③脂肪细胞因子中有一部分为炎性因子,如白细胞介素、脂联素、抑制素等,可以通过诱发体内炎性反应状态从而导致PCOS患者出现胰岛素抵抗[15-16]。因此,肥胖型PCOS患者伴发IR的比例远超痩型PCOS患者,且脂肪细胞因子在其中发挥重要的作用。
本研究对肥胖型PCOS患者进行回归拟合分析,结果提示GAL与机体糖代谢密切相关,可能是肥胖PCOS患者胰岛素抵抗产生的重要标志物之一。这可能是以下两种机制的影响结果:①GAL在中枢系统的各个脑区广泛分布,GAL样免疫活性神经元还以胞体的形式位于胃、十二指肠、回肠、结肠的肌层和黏膜,能够导致食管下括约肌收缩、抑制基础胃酸分泌和刺激后的胃酸分泌,还能够抑制肠道平滑肌收缩,引起胃肠神经传导改变,最终传导至食欲调节中枢,引起食欲增加[17-18],造成体重持续上升;②GAL升高是对胰岛素效能降低的一种应对,GAL可以通过调节Glut4转移效率促进葡萄糖在细胞质膜间的转运,提高机体对葡萄糖摄取水平[19]。Lerakis I等人[20]发现,敲除GAL基因后,小鼠胰岛素降低血糖的作用明显下降;当胰岛素效率下降,机体可能代偿性的增加GAL的分泌。综上所述,GAL与机体糖代谢密切相关,在肥胖型PCOS患者的体内显著升高,是其产生胰岛素抵抗产生的重要标志物之一。
总之,肥胖PCOS患者普遍存在糖代谢异常以及胰岛素抵抗、高胰岛素血症,当患者胰岛素敏感性降低时,其胰岛素抵抗指数显著升高;肥胖PCOS体内GAL水平增高,与BMI及胰岛素抵抗成正相关。GAL能否成为诊断PCOS的重要标志物,有待进一步实验研究。
