搜风祛痰中药对同型半胱氨酸损伤的心肌微血管内皮细胞线粒体凋亡的影响
2022-07-08肖福龙宫丽鸿
肖福龙,宫丽鸿
冠状动脉粥样硬化性心脏病是冠状动脉粥样硬化使管腔狭窄或阻塞,导致心肌缺血、缺氧而引起的心脏病,与冠状动脉功能性改变即冠状动脉痉挛统称为冠状动脉性心脏病(coronary heart disease,CHD),简称冠心病。近年来,随着我国国民经济的迅速发展,人民生活方式和生活水平发生巨大变化,冠心病的患病率和死亡率也逐渐升高,已经成为我国重要的公共卫生问题。研究显示,搜风祛痰中药通过抑制细胞凋亡发挥稳定动脉粥样硬化不稳定斑块的作用,但搜风祛痰中药对同型半胱氨酸(homocysteine,Hcy)损伤的大鼠心肌微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)的作用尚未明确[1-4]。本研究探讨Hcy对CMECs线粒体凋亡的影响及搜风祛痰中药的干预作用,为搜风祛痰中药的临床应用提供科学的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞 原代大鼠CMECs,购自北京北纳创联生物技术研究院公司。
1.1.2 实验动物 8周龄无特定病原体(SPF)级雄性Sprague-Dawley大鼠40只,体质量(240±20)g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SYXK(辽)2013-0009。所用动物实验均符合中国有关实验动物使用和操作的伦理规则,并获得辽宁中医药大学动物伦理委员会的批准(编号:21000092018010)。
1.1.3 实验药物 搜风祛痰中药:全蝎5 g,蜈蚣1条,地龙20 g,陈皮15 g,半夏15 g,白术15 g,水蛭15 g,加工制成含生药2 g/mL的中药浓缩液备用,由辽宁中医药大学附属医院中药局提供。
1.1.4 实验试剂与仪器 Hcy(Sigma,69453);CD31抗体(Servicebio,GB11063-1);Bax抗体(Cell Signaling Technology,#2772);Bcl-2抗体(CUSABIO,CSB-RA002611A0HU);Cyto-C抗体(Servicebio,GB11080);Caspase-9抗体(Cell Signaling Technology,#9508);Caspase-3抗体(Cell Signaling Technology,#9662);β-actin抗体(普利莱,C1845);辣根酶标记的山羊抗兔IgG(北京鼎国昌盛生物技术有限责任公司,SH-0031);BCA蛋白剂量测定试剂盒(恩晶生物,E1WP2012);十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒(索莱宝生物,P1200);Endothelial Cell Medium培养基(PromoCell,C-22010);胎牛血清(Sigma-Aldrich,12007C);EPS 600 电泳仪(Tanon,EPS 600);化学发光成像系统(Tanon,5200);二氧化碳培养箱(ThermoFisher,HERAcell 150i);超净工作台(ThermoFisher,1287);标准规格酶标仪(TECAN,infinite M200);低温离心机(Jouan SA,MR1822)。
1.2 实验方法
1.2.1 原代大鼠CMECs的培养及鉴定 将购买的大鼠CMECs 在37 ℃、5%CO2条件下常规培养,当培养瓶内细胞生长融合>85%时,用磷酸缓冲盐溶液(PBS)洗涤,在0.25%胰蛋白酶中消化并传代到6孔板上,然后在37 ℃孵育约48 h,使细胞黏附并铺展在基质上。第2代~第4代用于后续实验。倒置显微镜下观察大鼠CMECs形态,利用细胞免疫荧光法对大鼠CMECs细胞膜上CD31蛋白的表达进行鉴定[5]。
1.2.2 含药血清的制备[6]按成人与大鼠的体表面积折算系数,得出大鼠灌胃用药量,即搜风祛痰中药低、中、高剂量分别为4.05 g/kg、8.10 g/kg、16.20 g/kg。将40只大鼠按体重分为空白组、搜风祛痰中药低剂量组、搜风祛痰中药中剂量组、搜风祛痰中药高剂量组,每组10只,分别给予生理盐水、搜风祛痰中药4.05 g/kg、8.10 g/kg、16.20 g/kg灌胃,连续灌胃7 d,每日2次。在灌胃第7天,给药1 h后,用10%水合氯醛腹腔注射进行麻醉,腹主动脉取血,存放于促凝管中。在4 ℃下,以3 000 r/min速度离心30 min,分离血清。将同组血清收集后,放在一起混匀,灭活,用过滤器滤过血清除菌,放置在-80 ℃冰箱中保存,备用。
1.2.3 Hcy浓度的选择 依据梯度稀释法,将Hcy设置为8 mmol/L、4 mmol/L、2 mmol/L、1 mmol/L、0.5 mmol/L、0.25 mmol/L、0 mmol/L共7个浓度。显微镜下观察大鼠CMECs形态,弃去培养基,加入0.25%胰酶EDTA消化液1 mL,CO2培养箱中孵育2 min。加入完全培养基,终止消化,并加完全培养基至25 mL。在培养板每孔中加入100 μL含有大鼠CMECs的完全培养基,继续孵育24 h。弃去完全培养基,加入细胞外基质(ECM)培养基,继续孵育16 h。弃去ECM培养基,在每板中加入7种不同浓度的Hcy,继续孵育4 h。酶标仪检测各组细胞OD值。
1.2.4 分组及干预方法 将正常培养的大鼠CMECs随机分为5组。①空白对照组:正常培养的大鼠CMECs弃去原培养基,换为ECM基础培养基继续培养24 h;②模型对照组:正常培养的大鼠CMECs弃去原培养基,换为含1 mmol/L Hcy的ECM基础培养基孵育 4 h,换为ECM基础培养基继续培养24 h;③搜风祛痰中药高剂量组:正常培养的大鼠CMECs弃去原培养基,换为含1 mmol/L Hcy的ECM基础培养基孵育4 h后,换为含16.2 g/kg搜风祛痰中药的ECM基础培养基继续培养24 h;④搜风祛痰中药中剂量组:正常培养的大鼠CMECs弃去原培养基,换成含1 mmol/L Hcy的ECM基础培养基孵育4 h后,换成含8.1 g/kg搜风祛痰中药的ECM基础培养基继续培养24 h;⑤搜风祛痰中药低剂量组:正常培养的大鼠CMECs原培养基,换为含1 mmol/L Hcy的ECM基础培养基孵育 4 h后,换成含4.05 g/kg搜风祛痰中药的ECM基础培养基继续培养24 h。
1.2.5 细胞收集 对于进行蛋白免疫印迹法(Western
Blot)检测的细胞,在药物干预结束后,用PBS缓冲液洗涤细胞2次,吸去PBS缓冲液,直接将500 μL RIPA蛋白裂解液加入到培养孔中,4 ℃孵育10 min,收集裂解液,-20 ℃保存待用。
1.2.6 检测指标 ①四唑盐(MTT)法检测各组细胞生存活性[7]:将大鼠CMECs用胰酶消化后接种于96孔板中,加入含有相应剂量药物的培养液,每孔加入配制好的10 μL MTT贮存液。混匀后,37 ℃培养箱中孵育4 h;每孔加入150 μL 二甲基亚砜(DMSO),37 ℃孵育10 min;酶标仪上测定570 nm下各个样本的OD值。②Western Blot检测各组细胞Bax、Bcl-2、Cyto-C、Caspase-9、Caspase-3蛋白表达:BCA法测定样品蛋白浓度,并用无菌水调至2 μg/μL;每个样品取总蛋白15 μg与SDS上样缓冲液混合,95 ℃加热变性5 min;冰上冷却,4 ℃、10 000 r/min离心10 min;取上清进行SDS-PAGE,电压维持在100 V;电泳结束后,用湿转法进行恒流转膜35 min;Tris-HCl缓冲盐溶液(TBST液)洗膜3次,每次5 min;加封闭液,室温封闭1 h;TBST液洗膜1次,加入稀释好的一抗,4 ℃孵育过夜;TBST液洗膜3次,每次5 min;加入稀释好的对应的二抗,室温孵育1 h;TBST液洗膜3次,每次5 min;将配制好的ECL发光液加到膜上进行显色,化学发光成像仪检测成像结果,Image J 软件分析条带的灰度值。

2 结 果
2.1 大鼠CMECs形态学观察及鉴定 将购买的大鼠CMECs 培养至第5天时,可见细胞汇合成铺路石样,详见图1。CD31免疫荧光法鉴定显示所提取的大鼠CMECs 纯度大于 95%,详见图2。故本实验采用稳定生长的第3代细胞进行后续实验。

图1 倒置显微镜下细胞形态学观察(×200)
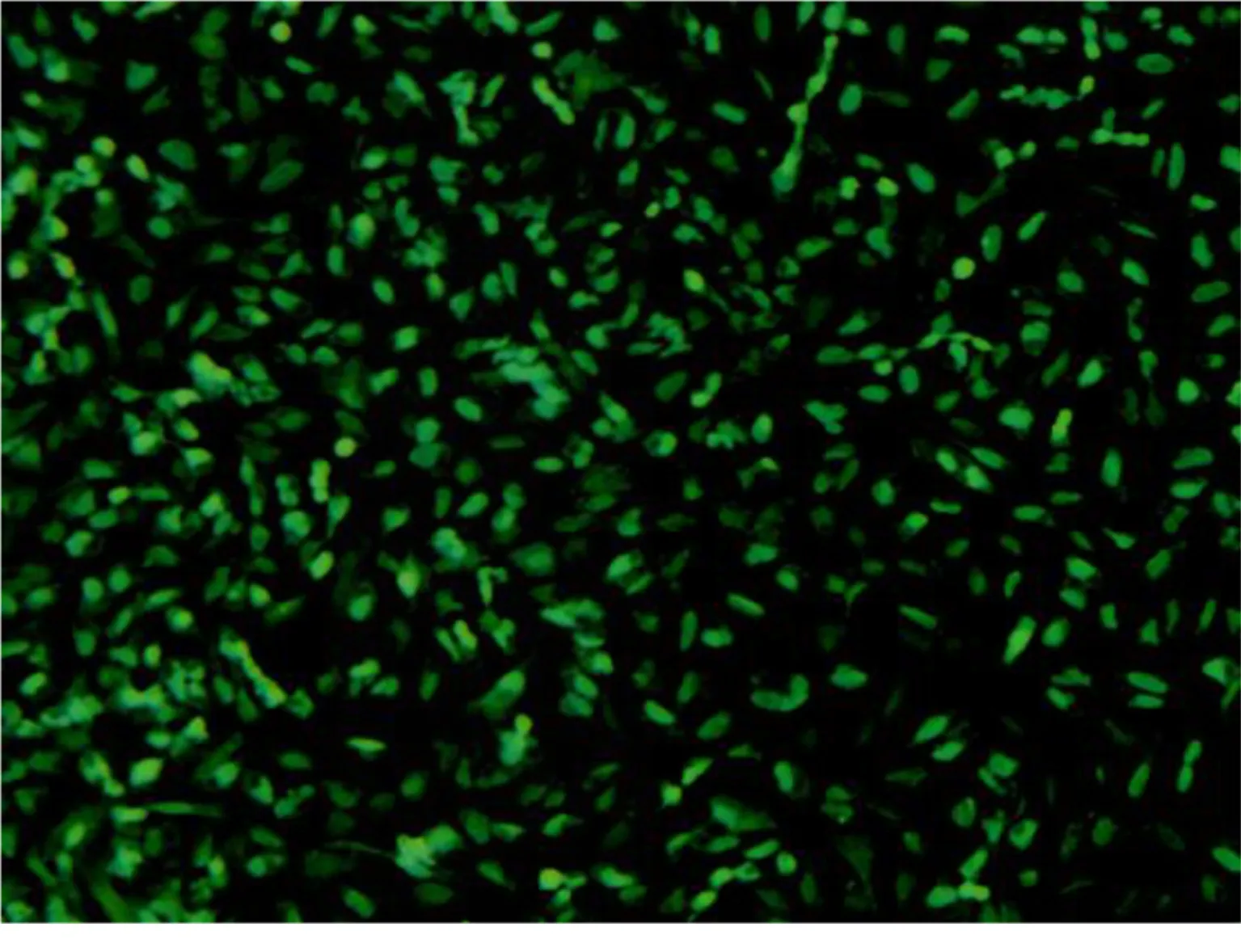
图2 CD31免疫荧光法鉴定细胞(×200)
2.2 Hcy浓度的确定 大鼠CMECs鉴定后需要确定Hcy干预浓度,因此将不同浓度的Hcy分别作用于大鼠CMECs,检测OD值变化。详见图3。

图3 Hcy浓度筛选折线图
2.3 搜风祛痰中药含药血清对Hcy损伤的大鼠CMECs生存活性的影响 与空白对照组比较,模型对照组、搜风祛痰中药低剂量组、搜风祛痰中药中剂量组、搜风祛痰中药高剂量组CMECs生存活性OD值均明显降低,差异均有统计学意义(P<0.01);与模型对照组比较,搜风祛痰中药低剂量组、搜风祛痰中药中剂量组、搜风祛痰中药高剂量组CMECs生存活性OD值均明显升高,差异均有统计学意义(P<0.01)。详见图4。

与空白对照组比较,* P<0.01;与模型对照组比较,# P<0.01。图4 各组CMECs生存活性柱状图
2.4 搜风祛痰中药含药血清对Hcy损伤大鼠CMECs、Bax、Bcl-2、Cyto-C、Caspase-9、Caspase-3蛋白表达的影响 与空白对照组比较,模型对照组Bax、Bcl-2、Cyto-C、Caspase-9、Caspase-3蛋白表达均升高,差异均有统计学意义(P<0.01);与模型对照组比较,搜风祛痰中药中剂量组、搜风祛痰中药高剂量组Bax、Cyto-C蛋白表达均降低,搜风祛痰中药低剂量组、搜风祛痰中药中剂量组、搜风祛痰中药高剂量组Caspase-9、Caspase-3蛋白表达均降低,Bcl-2蛋白表达均升高,差异均有统计学意义(P<0.05或P<0.01)。详见表1,图5。

表1 各组细胞Bax、Bcl-2、Cyto-C、Caspase-3、Caspase-9蛋白表达比较(±s)

图5 各组细胞Bax、Bcl-2、Cyto-C、Caspase-9、Caspase-3蛋白表达电泳图
3 讨 论
细胞凋亡是指生物体内一种生理性的程序性细胞死亡过程,是细胞针对所处环境因素的特定改变而产生的应答。当受到外界刺激后,线粒体内发生Ca2+沉积,三磷酸腺苷生成不足,引起线粒体凋亡,最终影响冠状动脉微血管内皮细胞功能[8]。Bcl-2家族分子是线粒体凋亡通路的关键调节蛋白,主要包括抗凋亡因子Bcl-2等和促凋亡因子Bax等,其能改变线粒体膜通透性,最终引起细胞凋亡[9]。Caspases是细胞发生凋亡的关键环节,起始凋亡蛋白酶Caspase-9形成凋亡体,激活下游效应凋亡蛋白酶Caspases-3,通过对维持细胞结构及生命活动所必需的蛋白进行裂解,导致细胞结构的破坏及 DNA 损伤断裂,最终引起细胞凋亡。血管内皮细胞是构成冠状动脉内壁的主要细胞,具有分泌功能,多种原因诱导的血管内皮细胞损伤是触发冠心病的首动因素[10]。研究表明,血瘀型冠心病病人存在凋亡相关基因Bcl-2的差异表达[11]。
冠心病属于中医学“胸痹心痛”范畴,风痰理论是冠心病的主要病机。现代人运动减少,饮食膏粱厚味致使脾虚生痰,百病皆由痰作祟,痰浊内生,困阻血脉,血行不畅,停滞为瘀,痰凝血瘀,痰瘀蕴结不解而生内痈毒热,热极生内风,风邪为百病之长,善行而数变,挟痰入络,痰风内动[12],筋脉失养,挛急刚劲,痹阻心脉。正如《医方考》谓“风痰者,湿土生痰,痰生热,热生风也”,《东医宝鉴·痰饮》谓“痰者,津液因热而成,热则津液熏蒸而稠浊故名曰痰”。故治疗以搜风祛痰、祛瘀通络为治法,予以搜风祛痰中药,方中全蝎、蜈蚣、地龙3药共为君药,白术、半夏、陈皮合用共为臣药,水蛭为佐使药,共奏搜风祛痰、祛瘀通络之效。
本研究结果表明,不同浓度Hcy均能够诱导大鼠CMECs出现损伤,浓度较低时,细胞活性变化较大,说明Hcy浓度对细胞活性影响较为明显,当Hcy浓度>2 mmol/L,曲线趋于平缓,说明Hcy浓度的增加对细胞活性的影响开始变得不明显。再结合以往同类研究的文献报道,因此选择Hcy浓度为1 mmol/L时,损伤程度最适于本研究,此时细胞损伤程度较为稳定。通过检测线粒体凋亡相关蛋白来检测细胞凋亡,与空白对照组比较,模型对照组Bcl-2、Bax、Cyto-C、Caspase-9、Caspase-3蛋白表达均升高(P<0.01),说明大鼠CMECs在给予Hcy干预后,促凋亡因子Bax、Cyto-C、Caspase-9、Caspase-3蛋白表达均出现上调,导致细胞凋亡活动增加,表明细胞凋亡途径为线粒体凋亡;其中抗凋亡因子Bcl-2蛋白表达亦出现上调,考虑与内皮细胞受到应激有关;与模型对照组比较,搜风祛痰中药组Bax、Cyto-C、Caspase-9、Caspase-3蛋白表达降低,Bcl-2蛋白表达升高,说明搜风祛痰中药含药血清均能够通过下调Hcy损伤的大鼠CMECs凋亡相关因子中的促凋亡因子Bax、Cyto-C、Caspase-9、Caspase-3蛋白表达、上调抗凋亡因子Bcl-2蛋白表达来抑制细胞线粒体凋亡。
综上所述,搜风祛痰中药含药血清能够上调Bcl-2蛋白表达,下调Bax、Cyto-C、Caspase-9、Caspase-3蛋白表达,抑制细胞线粒体凋亡,从而抑制Hcy诱导的大鼠CMECs损伤。
