法尼酯X受体激动剂GW4064减轻小鼠脓毒症诱导的炎症反应和急性肾损伤
2022-07-08徐素娟汪小燕邹周平丁小强
任 婷,徐素娟,汪小燕,邹周平,丁小强,2,3,贾 平,2,3*
1.复旦大学附属中山医院肾内科,上海 200032
2.上海市肾病与透析研究所,上海 200032
3.上海市肾脏疾病与血液净化重点实验室,上海 200032
急性肾损伤(acute kidney injury, AKI)是一种由多种因素引起、以肾功能迅速下降为特征的临床综合征[1]。脓毒症是引起AKI的主要原因之一,尤其在重症监护室,超过50%的AKI由脓毒症引起[2],且此类患者死亡率高达60%[3]。脓毒症AKI发病机制复杂,主要包括肾血流动力学改变、免疫细胞活化、促炎因子大量生成和内分泌失调等[4]。目前尚缺乏有效的防治措施。
法尼酯X受体(farnesoid X receptor,FXR)属于配体激活的核受体转录因子超家族,主要在肝、肠、肾和脂肪组织中表达[5]。近年来,FXR在胆汁代谢[6]、免疫调节、脂质代谢[7]等多方面的作用已被证实,尤其是FXR作为胆汁酸稳态的主要调节剂,在调节胆固醇、脂质和葡萄糖代谢中发挥重要作用。同时,越来越多的文献[8-9]表明FXR在调节免疫炎症反应的作用。FXR作为多种疾病的重要靶点,其在AKI中的作用鲜有报道。合成药物GW4064作为FXR的高亲和力激动剂,表现出较高的受体特异性和有效性[10]。本研究通过构建小鼠脓毒症AKI模型,观察脓毒症对肾脏FXR表达的影响,及FXR激活对脓毒症诱导的炎症反应和AKI的干预作用。
1 材料与方法
1.1 实验动物和主要试剂采用6~8周龄C57BL/6雄性小鼠,体质量18~22 g,购自上海杰斯捷实验动物有限公司。DMEM/F12培养基和DMEM高糖培养基购于美国Gibco公司,胎牛血清购于美国Gibco公司,反转录试剂和实时荧光定量PCR试剂购于TaKaRa公司,Trizol购于美国Sigma-Aldrich公司,胶原酶Ⅳ购于美国Sigma-Aldrich公司,胰蛋白酶抑制剂、胰岛素、转铁蛋白和氢化可的松均购于索莱宝公司,percoll液购于Coolaber公司,脂多糖(lipopolysaccharide,LPS)和GW4064购于美国Sigma-Aldrich公司,FXR抗体购于R&D和Biorbyt公司,β-actin抗体购于中杉金桥公司,肌酐检测试剂盒购于BioAssay Ststems公司。本研究引物由生工生物工程股份有限公司合成。
1.2 动物模型和实验分组小鼠随机分为4组:生理盐水(normal saline, NS)组、LPS组、LPS+溶剂对照组(dimethyl sulfoxide,DMSO)和LPS+FXR激动剂(GW4064)组,每组5~8只。LPS组小鼠腹腔注射LPS,剂量为10 mg/kg,NS组小鼠腹腔注射等量生理盐水,后2组分别在LPS注射前5 d始连续腹腔注射GW4064 30 mg/kg或DMSO。麻醉后颈椎脱臼处死小鼠,取其肾脏组织进行后续实验。本研究通过复旦大学附属中山医院动物实验伦理审查委员会批准(2021-406)。
1.3 小鼠原代肾小管上皮细胞(primary tubular epithelial cells,PTECs)分离和提取颈椎脱臼6~8周龄C57野生型雄性小鼠,放至75%的乙醇中浸泡5 min,取出小鼠肾脏,放入4℃预冷的Hanks液中。在超净台中剥离肾包膜,Hanks液晃洗肾脏3~5遍,在5 mL灭菌EP管中将肾脏剪碎成1 mm3大小,将剪碎的肾脏组织放入5 mL细胞消化液(1.5 mg/mL胶原酶Ⅳ+1.5 mg/mL胰蛋白酶抑制剂)中,37℃,120 rpm消化1 h;加入FBS终止消化;过40 µm筛网,100×g,4℃离心3 min,弃上清液;适量Hanks液重悬后,100×g,4 ℃离心3 min,弃上清;适量DMEM/F12培养基重悬后,100×g,4℃离心3 min,弃上清;用5 mL DMEM/F12重悬沉淀,加入50% percoll液上方,14 000r/min,4 ℃离心1 h;最上面一层为近端肾小管细胞,缓慢吸取最上层液体,1 000r/min,4 ℃离心5 min,弃上清;用含10%FBS的原代细胞培养液(DMEM/F12培养基+维生素C+氢化可的松+胰岛素+转铁蛋白)培养24 h后换液[11]。
1.4 细胞培养和处理取小鼠PTECs先于37℃、5%CO2的培养箱中培养3~4 d,待细胞扩增至60%~70%,随机分为4组:NS组、LPS组、LPS+溶剂对照组和LPS+GW4064组。LPS组细胞加入1 000 ng/mL LPS,培养24 h;NS组加入等量生理盐 水;LPS+GW4064 组 以 5 µmol/L GW4064[12]预处理细胞24 h,LPS+溶剂对照组给予等量DMSO后,加入1 µg/mL LPS继续培养24 h。
1.5 免疫组化染色小鼠肾组织石蜡切片经二甲苯脱蜡,梯度乙醇脱水,抗原修复,3%BSA室温封闭30 min,加入抗FXR抗体(1∶200,orb156973,Biorbyt公司)4℃孵育过夜,带有生物标记的二抗37℃孵育1 h,DAB显色,光镜下观察肾组织切片染色。
1.6 Western免疫印迹法提取小鼠PTECs蛋白后,经8%SDS-PAGE电泳,300 mA湿转90 min,5%脱脂奶粉室温封闭1 h,加入抗FXR抗体(1∶1 000,PP-A9033-00,R&D公司)4℃孵育过夜;β-actin抗体为内参(1∶1 000,TA-09,北京中杉金桥生物技术有限公司)。采用TBST洗膜3遍,每遍10 min,二抗室温孵育1 h,TBST洗膜3遍,每遍5 min,最后利用ECL显影。
1.7 RT-PCR检测小鼠肾组织或细胞内加入TRIzol,然后采用氯仿、异丙醇分离RNA, DEPC水配置的75%乙醇洗涤后,溶于DEPC水中,检测RNA浓度,以500 ng体系按照PrimeScript RT Master Mix试剂盒(TaKaRa公司,日本)说明进行逆转录,采用SYBR Premix ExTaq(TaKaRa公司,日本)进行PCR反应。采用β-actin作为内参。引物序列见表1。

表1 基因引物序列表
1.8 血清肌酐水平检测采用肌酐测定试剂盒(BioAssay Systems)配置标准液,吸取标准品和血清样本30 µL至96孔板中;A液和B液按1∶1配置肌酐测定工作液,每孔200 µL,510 nm测定0 min时的吸光度;37℃避光孵育 5 min,再次测定5 min时的吸光度,根据标准品的浓度计算每个样品的浓度。
1.9 统计学处理采用GraphPad软件,正态分布的计量资料以x±s表示,多组之间比较采用单因素方差分析,2组之间比较采用t检验。检验水准(α)为0.05。
2 结 果
2.1 LPS诱导小鼠肾脏炎症反应和AKI结果(图1A)显示:与NS组相比,LPS组小鼠在LPS注射6 h后肾组织出现水肿,炎性细胞浸润;12 h后出现散在空泡变性;24 h后表现为广泛的空泡变性,并伴有散在肾小管上皮细胞坏死脱落。血清肌酐检测结果(图1B)显示:LPS注射后12 h、24 h,LPS组小鼠血肌酐浓度明显高于NS组(P<0.01)。通过RT-PCR检测肾组织匀浆中炎症因子和趋化因子表达水平(图1C、1D)发现,LPS处理后6 h、12 h和24 h肾脏促炎细胞因子白细胞介素6(interleukin 6, IL-6)和趋化因子配体2(C-C motif chemokine ligand 2,CCL2)均明显上调(P<0.01)。

图1 LPS诱导小鼠肾脏炎症反应和AKI
2.2 GW4064对小鼠脓毒症AKI和炎症反应的减轻作用LPS组和LPS+溶剂对照组小鼠肾脏病理H-E染色(图2A)显示,2组小鼠均有肾间质水肿、明显的炎细胞浸润和肾小管上皮细胞变性,并有散在的细胞坏死,而LPS+GW4064组小鼠肾组织损伤明显减轻,仅表现为肾脏间质水肿和少量炎性细胞浸润。肾脏组织切片F4/80免疫组化染色(图2B、2C)显示,与NS组比较,LPS组和LPS+溶剂对照组小鼠肾脏均有明显的巨噬细胞浸润;而与LPS组和LPS+溶剂对照组比较,LPS+GW4064组小鼠肾脏巨噬细胞浸润明显减少,血肌酐水平(图2D)也显著下降(P<0.05),肾组织匀浆中促炎因子IL-6(图2E)和趋化因子CCL2(图2F)表达明显下调(P<0.05)。

图2 GW4064对小鼠脓毒症AKI和炎症反应的减轻作用
2.3 LPS对小鼠肾脏和PTECs的FXR表达的抑制作用肾组织切片免疫组化染色结果(图3A)显示,FXR主要表达于正常肾小管上皮细胞胞核内,经LPS处理后FXR表达明显下调。检测LPS处理不同时间点小鼠肾脏FXR mRNA水平(图3B)显示,LPS处理12 h后FXR表达水平明显下调(P<0.05)。进一步分离PTECs,在体外检测LPS对上皮细胞FXR表达的影响,Western免疫印迹法和RT-PCR结果(图3C、3D)均显示,与NS组相比,LPS 500 ng/mL和1 000 ng/mL 处理PTECs后FXR蛋白和mRNA水平明显下调。
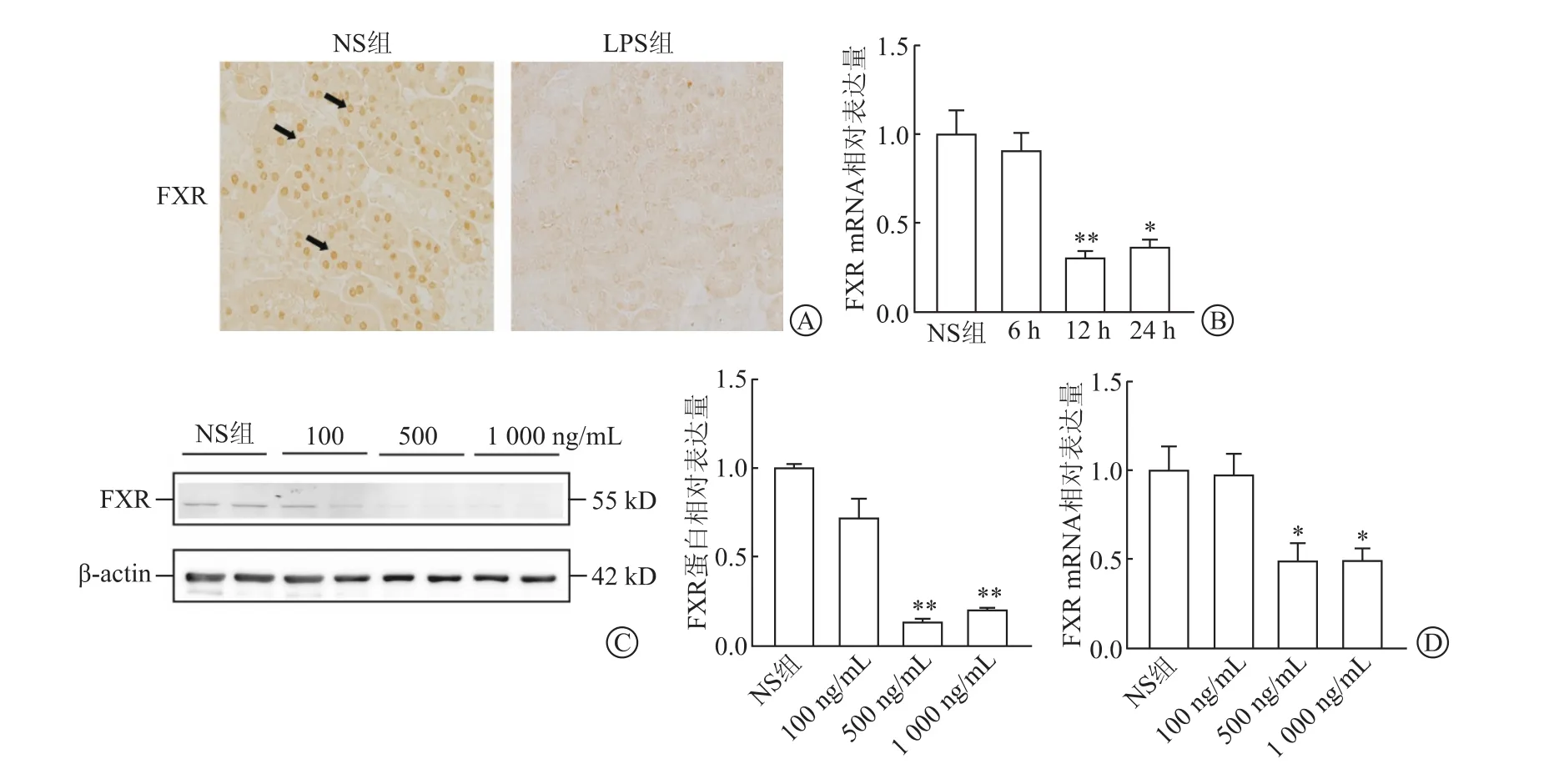
图3 LPS对小鼠肾脏和PTECs的FXR表达的抑制作用
2.4 FXR对LPS诱导的肾小管上皮细胞促炎因子的抑制作用利用RT-PCR检测PTECs促炎因子表达水平结果(图4A)显示,与NS组相比,不同浓度的LPS处理PTECs后,炎症因子IL-6表达均显著上调(P<0.01)。相较于NS组,1 000 ng/mL LPS处理PTECs趋化因子CCL2的mRNA水平也显著上调(P<0.01),见图4B。与LPS组和LPS+溶剂对照组相比,LPS+GW4064组炎症因子IL-6表达(图4C)明显下调(P<0.05);趋化因子CCL2的生成(图4D)也明显减少(P<0.01)。
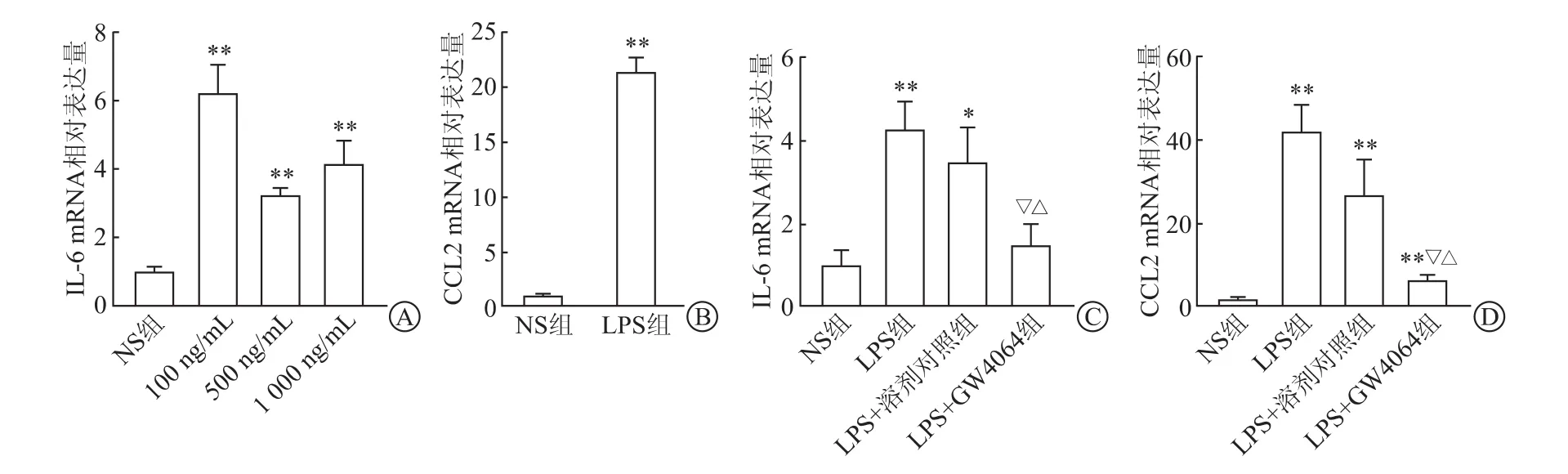
图4 FXR对LPS诱导的肾小管上皮细胞促炎因子的抑制作用
3 讨 论
脓毒症AKI仍是危急重症领域的常见疾病,具有高发病率和高死亡率的特点。临床研究[13]发现,脓毒症患者合并AKI死亡率明显高于单纯脓毒症患者。炎症反应在脓毒症AKI发生中发挥重要作用,促炎因子IL-6作为机体免疫应答的重要介质,在脓毒症小鼠肾脏中显著上调[14]。脓毒症一方面诱导肾小管上皮细胞生成多种促炎因子[15],另一方面,肾脏产生的趋化因子如CCL2可调节中性粒细胞和单核/巨噬细胞募集到肾组织[16],引起炎细胞浸润并分泌促炎细胞因子,进一步加重炎症反应,促进AKI发生。而抑制促炎因子和趋化因子的生成,可减轻脓毒症引起的AKI。已有研究[17]证实,巨噬细胞在脓毒症诱导AKI发生中发挥重要作用。在小鼠脓毒症模型中,LPS引起巨噬细胞浸润肾脏组织,活化的巨噬细胞产生如TNF-α等多种炎症细胞因子,促进AKI发生。Gong等[18]研究证实,Fractalkine(CX3CL1)敲除可通过抑制Wnt/β-catenin通路抑制巨噬细胞活化,减少多种炎症细胞因子的产生,减轻炎症反应。本研究结果显示,LPS诱导小鼠肾脏巨噬细胞浸润和炎症反应,而FXR激动剂GW4064可明显抑制肾脏巨噬细胞浸润。脓毒症AKI肾脏病理损伤除了炎症反应外,还可表现为细胞凋亡与非特异性改变,如肾小管上皮细胞空泡样变性、细胞肿胀和刷状缘消失等[19]。本研究发现,LPS促进肾脏和肾小管上皮细胞炎症因子IL-6和趋化因子CCL2表达增加,肾间质水肿、炎细胞浸润,细胞空泡样变性,肾小管坏死脱落,进而引起肾功能损伤。
FXR是核受体超家族成员,在肠肝循环调节和脂质稳态中发挥重要作用。既往FXR的研究主要集中在肝脏,在肝脏中参与调节代谢[20],具有抗炎特性[21]。另外,FXR激活可减少肝脏促纤维化相关基因表达[22]。在中枢神经系统自身免疫性疾病中,FXR通过激活抗炎巨噬细胞,抑制T细胞介导的自身免疫,以IL-10依赖的方式抑制神经组织的炎症损伤[23]。在肾脏方面,Wang等[22,24]研究证实FXR/TGR5双激动剂可抑制糖尿病肾病和肥胖相关肾病的进展;FXR与YAP之间交互作用可以抑制肾脏纤维化[25]。Kim等[26]研究表明,FXR通过调控细胞自噬和凋亡抑制AKI向慢性肾脏病的进展。本研究通过构建小鼠脓毒症体内外模型发现,LPS抑制肾脏和肾小管上皮细胞FXR表达;采用FXR激动剂(GW4064)可显著降低脓毒症小鼠血清肌酐浓度;FXR激活可显著抑制肾脏和PTECs炎症因子IL-6和趋化因子CCL2生成,减轻LPS诱导的肾脏炎症反应。
综上所述,本研究利用小鼠体内外模型证实FXR对LPS诱导AKI的保护作用,表明FXR激活可减少LPS诱导的肾小管上皮细胞促炎因子生成,减轻肾脏炎症反应和AKI,为临床防治脓毒症急性肾损伤提供新的思路和手段。
利益冲突:所有作者声明不存在利益冲突。
