儿童肝母细胞瘤预后影响因素分析
2022-07-08高鸿翔单禹华谢晨捷
梁 煜,高鸿翔,单禹华,谢晨捷,徐 敏,顾 松
上海交通大学医学院附属上海儿童医学中心普外科,上海 200127
肝母细胞瘤(hepatoblastoma,HB)是一种罕见的恶性肿瘤,发病率为(1.5~2.0)/100万,发病年龄多为 3 岁以内,约占80%[1]。HB起源于胚胎发育过程中肝脏上皮多能祖细胞的异常分化[2],组织学分类上,主要分为上皮型和上皮间叶混合型[3]。由于手术和辅助化疗手段的不断改进,HB的5 年总体生存率(overall survival,OS)从20 世纪 70 年代的 30% 提升至目前约80%[2]。
随着世界范围内临床和基础研究[4-5]的深入,已明确许多与HB 相关的预后影响因素,如甲胎蛋白(alpha fetoprotein,AFP)水平、诊断时年龄、PRETEXT分期及远处转移等,并发现越来越多可能影响HB患儿预后的危险因素[6-7]。乳酸脱氢酶(lactate dehydrogenase,LDH)在多种肿瘤中升高,但由于其灵敏度和特异度较低,不能作为诊断和预后的判断标志物,而乳酸脱氢酶与白蛋白比值(lactate dehydrogenase to albumin ratio,LAR)作为一种新的肿瘤预后标志物逐渐被学者认识。
本研究对2011年1月至 2019 年 1 月首诊于上海儿童医学中心普外科的HB患儿进行回顾性分析,归纳患儿的临床特征、治疗及预后情况,探讨影响HB预后的危险因素,发现LAR是影响HB患儿预后的独立危险因素,可作为评估患儿预后的重要生物标志物,从而为术前判断HB患儿预后提供一定的参考依据。
1 资料与方法
1.1 研究对象回顾性分析2011年1月至 2019年 1 月在上海儿童医学中心普外科接受诊治的120例HB患儿的临床资料。根据上海儿童医学中心危险度分层标准,分为标准危险组(n=39)和高度危险组(n=81),并采用不同的化疗方案。
纳入标准:(1)就诊于我院门诊HB患儿(年龄<18岁);(2)经影像学及病理学检查确诊;(3)有胸、腹部增强CT,腹部彩超,腹部MRI检查随访记录。排除标准:(1)非我院首诊患儿;(2)临床资料和随访检查缺失患儿。从数据库中收集患儿有关的人口学特征、手术、门诊随访及电话随访等资料。本研究遵循赫尔辛基宣言,已通过上海交通大学医学院附属上海儿童医学中心伦理委员会批准(SCMCIRB-K2017004)。
1.2 观察指标及定义完善血清LDH、白蛋白、铁蛋白、AFP、血常规等血生化检查。完全缓解:体格检查和CT或MRI显示肿瘤完全消失,且AFP正常4周以上。复发:经病理活检证实;清晰的影像显示肿瘤复发,AFP在4周内增加3倍。部分缓解:肿瘤缩小≥50%,无新发进展的证据。疾病稳定:肿瘤缩小<50%,无任何肿瘤扩大或新的病变。疾病进展:肿瘤增大≥25%或有新发肿瘤或 AFP 升高[8]。无事件生存期(event-free survival,EFS):患儿确诊入组后未发生肿瘤进展、复发、远处转移及疾病相关死亡的时间。总体生存期(overall survival,OS):从患儿确诊入组至发生疾病相关死亡的时间。早期死亡率:为出院前院内死亡;晚期死亡:出院后随访期间死亡[9]。 血 清AFP、LDH、 白 蛋 白(albumin,ALB)测定值为入院首次外周血化验结果。
1.3 诊断及治疗我院首诊HB患儿诊治流程见图1。诊断依据:HB通过综合实验室检查(AFP水平)、影像学检查(腹部增强CT检查)和病理学(免疫组织化学检测、组织学分型等)。所有确诊患儿均经过HB活检或手术切除。危险度分层方案:参考国际儿童肝肿瘤协作组(International Childhood Liver Tumor Strategy Group,SIOPEL)制定的PRETEXT分期和北美儿童肿瘤协作组COG Evans分期,结合我院情况及临床应用实际,制定上海儿童医学中心危险度分层标准SCMC-2011[10],即标准危险组为肿瘤局限于肝脏(PRETEXT Ⅰ期或Ⅱ期)且肿瘤可切除,AFP>100 ng/mL。高度危险组为肿瘤转移或PRETEXT Ⅲ或Ⅳ期,门静脉受累(P+)、下腔静脉或肝静脉受累(V+)、肝外腹内疾病(E+)或AFP≤100 ng/mL。
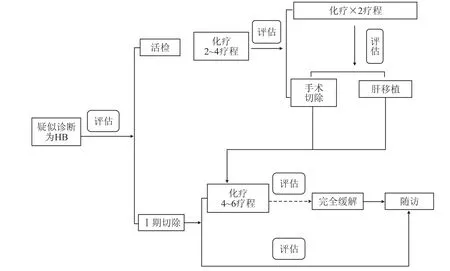
图1 我院首诊HB患儿诊治流程图
治疗策略:若肿瘤可Ⅰ期切除则采用直接切除,术后依据病理类型决定是否继续化疗,单纯胎儿型可不予化疗。若肿瘤不可Ⅰ期切除则采用新辅助化疗方式,必要时行肝移植治疗。化疗方案:标准危险组,手术完整切除肿瘤后予以C5V方案化疗(顺铂+ 5-氟尿嘧啶+长春新碱)长程化疗,每2个化疗周期评估原发灶及转移灶(血清AFP及胸腹部CT)。高度危险组,活检手术后予以C5VD方案化疗(顺铂+5-氟尿嘧啶+长春新碱+阿霉素)4个疗程,其中每2个疗程予以评估,若可切除则行手术切除,术后予以ICE方案(异环磷酰胺+卡铂+依托泊苷)继续化疗;若C5VD方案4程化疗后仍不可切除则建议行肝移植手术,术后继续予以ICE方案,当疾病进展或对C5VD没有反应时,患者将放弃方案,则接受个体化治疗计划。各治疗方案均以原发灶或转移灶完全消失且血清AFP恢复至正常水平为止。
1.4 随访方法AFP、胸腹平片、腹部超声:术后第1年,1月/次;术后2~3年,6月/次;术后4~5年,12月/次。胸部增强CT:肺转移瘤患儿术后随访需要行胸部增强CT检查,术后第1年,3月/次;术后第2年,4月/次;术后第3~4年,6月/次。听力、心脏彩超及心电图检查:应用铂类患儿进行听力、心脏彩超及心电图检查至停药后2年。
1.5 统计学处理采用X-Tile(3.6.1版;www.tissu earray.org)、SPSS 25.0、Graphpad Prism 8.0进行统计分析。采用 Shapiro-Wilk 检验数据的正态性。正态分布的计量资料以x±s表示,采用独立样本t检验,非正态分布的计量资料以M(P25,P75)表示,采用Mann-WhitneyU检验。分类变量以n(%)表示,采用χ2检验,频数小于5时,采用Fisher确切概率法。通过受试者工作特征曲线(receiver operating characteristic curve,ROC),确定LAR预测OS的最佳截断值。多变量分析采用Cox比例风险回归模型分析影响HB患儿EFS和OS的影响因素。采用双侧检验,检验水准(α)为0.05。
1.6 LAR最佳截断值根据患儿LAR值和EFS和OS信息,通过 X-tile 软件,由计算机程序运用ROC 分析:LAR值预测患儿终点指标EFS和OS最佳截断值(LAR=31.6)。根据截断值“ LAR=31.6 ”,可将120例患儿被分为2组:低LAR组和高LAR组,并将LAR作为影响因素纳入Cox回归模型分析,见图2。
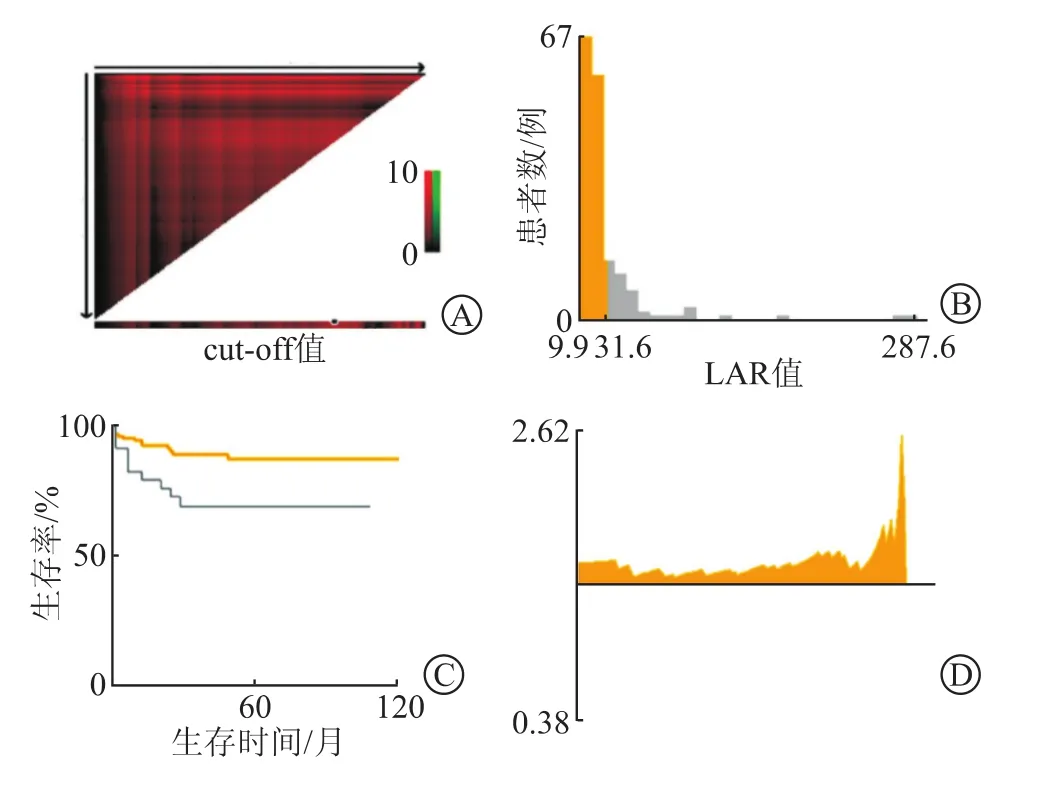
图2 X-tile软件确定LAR最佳截断值
2 结 果
2.1 一般资料分析我院首诊患儿纳入与排除标准流程见图3。结果(表1)显示:最终纳入 120例患儿,男性73例,女性47例,中位确诊年龄为16(7.0,30.0)个月。标准危险组39例 (32.5%),高度危险组81例(67.5%)。肿瘤一期手术切除后联合化学治疗42例,化学治疗联合二期手术切除治疗78例。影像学提示肝静脉受累10例,入院AFP水平≤100 ng/mL患儿2例。120例患儿病理组织学分型有3种:未具体分型63例(52.5%);上皮型23(19.2%)例;上皮间叶混合型32例(28.3%)。
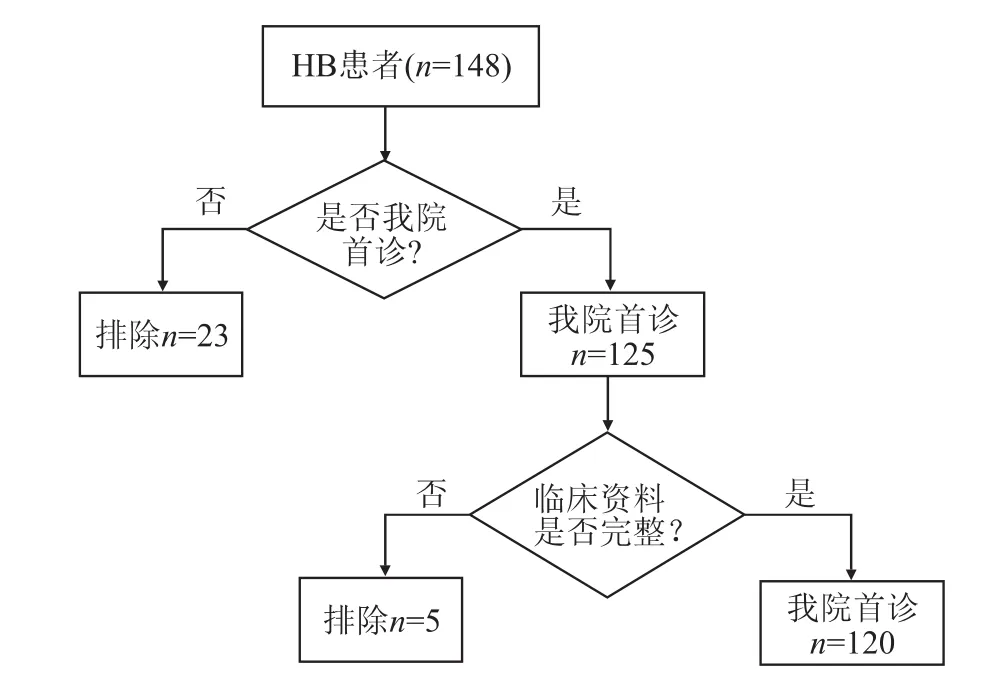
图3 我院首诊患儿纳入与排除标准流程图

表1 120例患儿基本临床特征资料n(%)/M(P25, P75)
2.2 随访结果结果(图4)显示:总体死亡 15例,其中早期死亡4例,晚期死亡11例。随访中位时间为 29(6,120)个月。120例HB患儿,其中标准危险组39例,高度危险组81例。经临床个体化治疗达到疾病稳定状态患儿15例,完全缓解患儿83例,失访患儿4例。
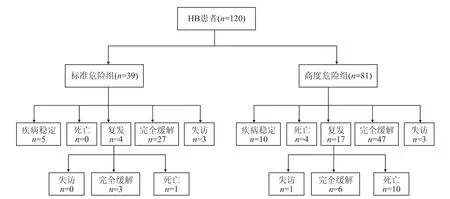
图4 120例HB患儿随访结果
2.3 单因素回归分析结果(表2)表明:确诊年龄增加(P<0.001)、高LAR值(P=0.007)、危险度分层-高危(P=0.005)、发生远处转移(P=0.006)以及AFP≤100 ng/mL(P=0.001)是预测HB患儿接受治疗后EFS的危险因素。确诊年龄增加(P<0.001)、高LAR值(P=0.009)、危险度分层-高危(P=0.008)、发生远处转移(P=0.005)以及AFP≤100 ng/mL(P=0.001)是预测HB患儿接受治疗后OS的危险因素。
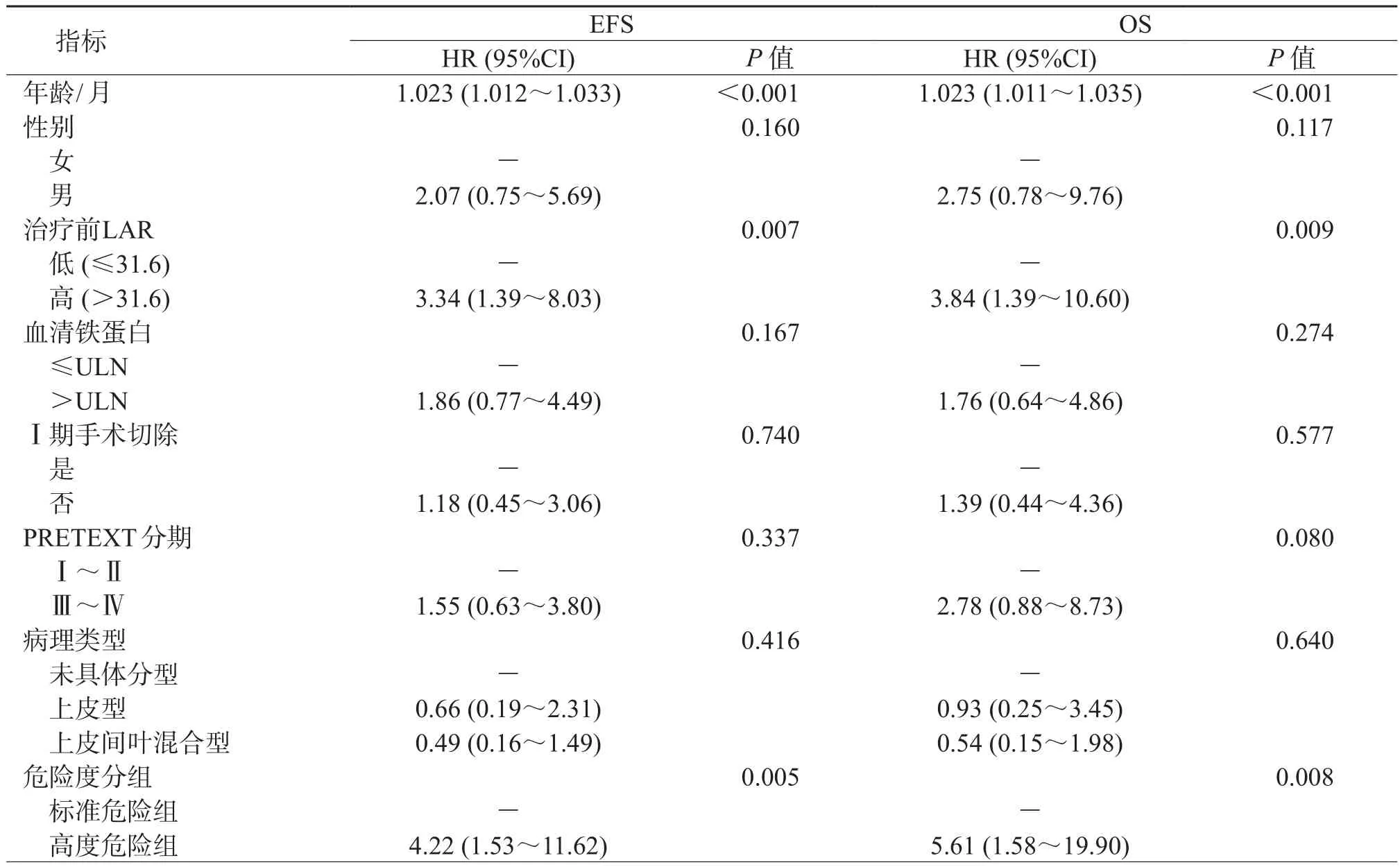
表2 影响HB的OS和EFS的单因素分析
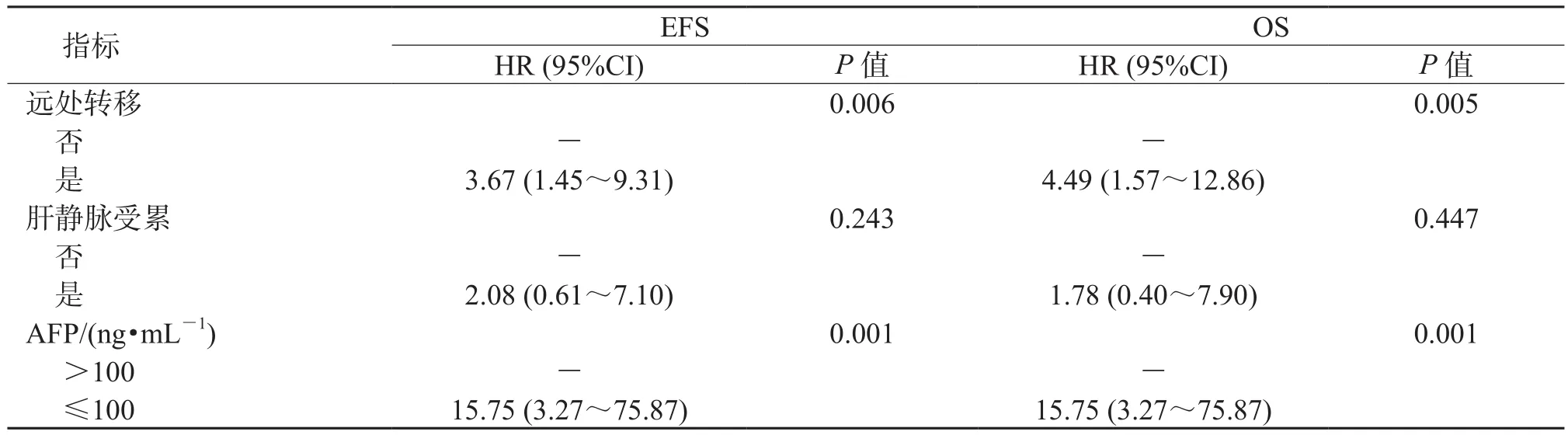
续表2
2.4 多因素回归分析结果(表3)显示:确诊年龄增加(P<0.001)、高LAR值(P=0.002)、发生远处转移(P=0.038)以及AFP≤100 ng/mL(P=0.001)是预测HB患儿接受治疗后EFS的独立危险因素。确诊年龄增加(P<0.001)、高LAR值(P=0.004)、发生远处转移(P=0.024)以及 治疗时AFP≤100 ng/mL(P=0.001)是预测HB患儿接受治疗后OS的危险因素。

表3 HB的OS和EFS危险因素的多元线性回归分析
3 讨 论
HB是儿童最常见的肝脏原发性恶性肿瘤[11]。目前在临床上,HB的治疗策略主要是一期手术+术后化疗及新辅助化疗。尽管随着近些年手术方式的改进及化疗方案的优化,HB的总体5年总体生存率已提升至80%左右,但仍有约20%的患儿出现复发或死亡,对患儿家庭造成极大的经济和心里创伤[11]。因此,进一步提高HB患儿的治愈率也是儿科医生共同努力的方向。通过单中心回顾性研究分析影响HB患儿预后的危险因素,为实现患儿个体化治疗以改善预后提供帮助。
年龄是儿童HB公认的危险因素[12]。目前研究[13]表明,3岁以下确诊儿童的预后明显好于3岁以上的儿童。随着年龄的增加,其他危险因素对预后的影响逐渐降低,当年龄大于10岁时,其他危险因素的作用变得极其微弱[14]。本研究中,随着确诊年龄的增加,患儿EFS或OS也分别随之降低(P<0.001)。约90%的HB患儿在确诊时AFP升高,血清水平<100 ng/mL是一个重要的危险因素。治疗前AFP≤100 ng/mL的患儿5年EFS仅为35%[15],而本研究中2例患儿AFP≤100 ng/mL均在确诊入组后6个月内死亡。HB的远处转移最常见的远处转移部位是肺[16]。有文献[16]报道尽管诊断时有肺转移的患儿2年的OS与无远处转移的患儿接近,但全化疗疗程中出现肺转移患儿5年EFS和OS则较无转移患儿明显降低。在本研究中远处转移均为肺转移,无肺转移患儿的5年EFS及OS分别为84.5%±4.0%和89.3%±3.5%,而伴肺转移患儿5年EFS及OS分别为51.7%±15.0%和57.4%±15.6%。
LDH是一种由LDH-A和LDH-B 2个主要亚基组成的四聚体酶,可以组装成5种不同的同工酶(LDH1、LDH2、LDH3、LDH4 和 LDH5)[17]。有报道[18]显示,肿瘤患儿LDH水平与肿瘤负荷有一定的相关性,同时LDH可改变血液和部分实体肿瘤中的肿瘤微环境,允许肿瘤细胞抑制和逃离免疫系统[19]。有研究表明, LDH与肝脏肿瘤预后有关[6,20-21],在转移性结直肠癌中,高 LDH水平则患者预后更差,并对于此类患者推荐应用更加强效的化疗联合靶向治疗方案[22]。然而,由于灵敏度和特异度较低,LDH病不能作为评估预后的参考指标。血清白蛋白(albumin,ALB)是肝脏产生的重要蛋白质之一,可反映肝脏储备功能和全身营养状态[23-24]。既往文献[23-25]表明,血清ALB降低与肝癌和结直肠不良预后有关。而LAR作为一种新的预后影响因素逐渐被学者认识。Aday等[22]研究表明,在接受根治性切除的结直肠癌患儿中,高LAR是OS的独立危险因素。同样地,Feng等[7]也报道,治疗前LAR是食管鳞状细胞癌患儿能否行一期手术治疗有效且独立的判断指标。此外,Nobuhiro等[26]研究也显示升高的LAR与胃癌患者的不良预后相关。本研究通过单因素和多因素回归分析首次表明,治疗前LAR>31.6是影响HB的EFS和OS的独立危险因素(P<0.05)。
本研究通过回顾性分析单中心120例HB患儿,按照危险度分组将所有患儿分为高度危险组与标准危险组,针对不同分组采用相应的手术及化疗策略。然而目前可作为危险度分组依据的HB预后影响因素中,PRETEXT分期及肝脏门静脉、肝静脉、下腔静脉浸润、远处转移等都高度依赖影像学诊断,而在实际日常诊疗由于低辐射剂量X线摄片导致的影像清晰度的降低及患儿检查时配合度较差等客观因素的存在,影像学结果对于辅助判断HB患儿危险度有一定的局限性。本研究结果表明,LAR是判断HB患儿预后的独立危险因素,因此可以协助临床医生更加准确地判断HB患儿危险度分层,为临床治疗方案的选择提供适当的参考依据,有望提高HB患儿生存率和生存质量,具有一定的临床应用价值。
本研究存在一定的局限性:(1)受限于回顾性和非随机性的试验设计以及研究周期较长,导致统计分析效力下降,另外存在部分患儿失访的情况;(2)病例资料来自单中心,不具有普遍代表意义;(3)研究整体所涉样本相对较少,部分组别患儿数量较少,也一定程度上对统计分析结果产生影响。后续需要开展多中心前瞻性研究以验证本研究结果。
综上所述,HB患儿年龄增加、远处转移、AFP≤100 ng/mL、治疗前LAR>31.6可作为判断HB患儿不良预后的独立危险因素,具有良好的临床参考价值。
利益冲突:所有作者声明不存在利益冲突。
致谢:本研究所涉患儿化疗方案的制定离不开上海儿童医学中心血液肿瘤科汤静燕主任,潘慈主任和高怡瑾主任的参与,在此一并致谢。
