赖氨酸羟化酶2在原发性肝癌组织中表达及其对肝癌细胞迁移、侵袭影响
2022-07-08胡志勇
文 斐, 顾 磊, 胡志勇
鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)1.病理科;2.消化内科,湖北 黄石 435000
原发性肝癌(hepatocellular carcinoma,HCC)作为发病率和病死率均较高的恶性肿瘤,已成为威胁我国人群生命安全的主要恶性肿瘤之一[1]。多数HCC患者在临床确诊时已不易手术切除,即使手术切除,复发转移率依然较高[2-3]。有研究报道,细胞外基质在肿瘤细胞侵袭转移中发挥重要作用,尤其是胶原纤维交联重构,为肿瘤细胞发生远处转移搭建了平台[4]。赖氨酸羟化酶2(procollagen-lysine 2-oxoglutarate 5-dioxygenase 2,PLOD2)作为PLOD家族的重要成员,是胶原纤维交联重构过程中关键性的催化酶[5]。已有研究报道,PLOD2可通过影响胶原纤维交联参与肿瘤细胞侵袭转移[6]。本研究旨在探讨PLOD2在HCC组织中的表达,并观察HepG2细胞转染PLOD2干扰序列后对癌细胞迁移、侵袭的影响。现报道如下。
1 对象与方法
1.1 研究对象 选取自2017年5月至2019年5月于鄂东医疗集团黄石市中心医院行手术治疗的93例HCC患者的癌组织及癌旁组织为研究对象。纳入标准:患者术前均未行放化疗;病理学检查证实为肝细胞癌。其中,男性69例,女性24例;平均年龄(58.62±12.41)岁;肿瘤直径>5 cm者42例,肿瘤直径≤5 cm者51例;分化程度:低分化31例,中分化29例,高分化33例;TNM分期:Ⅰ~Ⅱ期54例,Ⅲ~Ⅳ期39例;38例存在淋巴结转移。本研究经医院伦理委员会批准。所有患者均行知情同意。
1.2 主要试剂 兔抗人PLOD2多克隆抗体购自上海钰博公司,免疫组化试剂盒及配套试剂购自北京中杉公司,HepG2细胞购自上海信裕生物公司,胎牛血清、青-链霉素、RPMI-1640培养液购自美国Gibco公司,Trizol总RNA提取试剂盒和Lipofectamine 2000转染试剂购自美国Invitrogen公司,逆转录和PCR扩增试剂盒购自日本TaKaRa公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司,实时荧光定量PCR仪购自美国ABI公司。由上海美轩生物科技有限公司设计合成目的基因干扰序列及对照序列。引物由上海生工生物公司设计合成。
1.3 免疫组织化学法 检测PLOD2蛋白表达 将组织石蜡标本连续切片,烤片、脱蜡至水,浸入3%过氧化氢以灭活内源性过氧化物酶,浸入枸橼酸缓冲液中高温、高压抗原修复,PBS冲洗3次,10%山羊血清封闭。加入按1:500稀释后的一抗兔抗人PLOD2抗体,4℃条件下孵育过夜,滴加二抗,反应60 min,DAB显色,苏木素复染,阴性对照组采用PBS替代。显微镜下观察,PLOD2蛋白主要表达于细胞质中,随机取5个高倍视野,根据染色情况和阳性细胞数进行评分[7-8];(1)染色情况,无着色0分,浅黄1分,棕黄2分,黄褐3分;(2)阳性细胞数,染色细胞比例<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,比例≥76%为4分;(3)结果判定根据染色情况×阳性细胞数得分,0~2分为阴性(-),评分≥3分为阳性(+)。
1.4 细胞培养及处理 用含10%胎牛血清的RPMI-1640培养液培养HepG2细胞,条件:37℃含5% CO2。取对数生长期细胞,按2×106个/孔接种于6孔板,过夜培养。根据转染试剂盒说明,采用稳定转染的方法分别对细胞进行转染。(1)PLOD2干扰组,转染PLOD2基因的干扰序列 正 义 链:5’-GCUCCAUAUGUCAACCGUA-3’,反 义 链:5’-UACGGUUGACAUAUGGAGC-3’;(2)阴性对照组转染阴性对照序列:正义链:5’-CCACTAATGTCCAGCGTTT-3’,反 义 链:5’-ACAAGTAGCTGATATTGAT-3’;(3)空白组仅加入转染液。转染后培养48 h,完成后续实验。
1.5 实时荧光定量PCR检测PLOD2 mRNA表达 取各组培养48 h细胞,加入裂解液,提取总RNA并检测浓度。逆转录获得cDNA,按扩增试剂盒说明对引物扩增。引物序列:PLOD2:上 游:5’-ATGGAAATGGACCCACCA-3’,下 游:5’-TGCAGCCATTATCCTGTGTC-3’;β-actin:上游:5’-CCTCATGAAGATCCTCACCGA-3’,下 游:5’-TGCCAATGGTGATGACCTGG-3’。反应条件:95℃、2 min,95℃、30 s,58℃、30 s,72℃、30 s,循环38次,利用2-△△Ct法获得PLOD2 mRNA在细胞中的相对表达量[9]。
1.6 划痕实验 在6孔板底部划横穿孔的直线,每孔划5条。取各组细胞,按5×104个/孔接种在6孔板,加入含血清的RPMI-1640培养液。细胞融合度>90%时,垂直于孔板横线用枪头划痕,PBS冲洗,加入无血清培养液。分别在0 h和24 h时测量划痕宽度,重复实验3次。
划痕愈合率[10]=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%
1.7 Transwell实验检测细胞侵袭能力 用不含血清培养液对Matrigel基质胶进行稀释,平铺在Transwell小室上室,风干备用。取各组培养48 h的细胞,用不含血清的培养液重悬细胞沉淀,密度调整为2×105个/ml。Transwell小室上室加入200 μl细胞悬液,下室加入600 μl含10%胎牛血清的培养液。24 h后取出小室,4%多聚甲醛固定,结晶紫染色,将上室中散落的细胞清除,倒置显微镜观察,计算穿膜细胞数量[11-12],重复实验3次。
1.8 统计学方法 采用SPSS 21.0统计学软件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析及t检验;计数资料以例(百分率)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PLOD2蛋白表达情况 HCC组织PLOD2蛋白表达阳性率为77.42%(72/93),高于癌旁组织的33.33%(31/93),差异有统计学意义(P<0.05)。见图1。
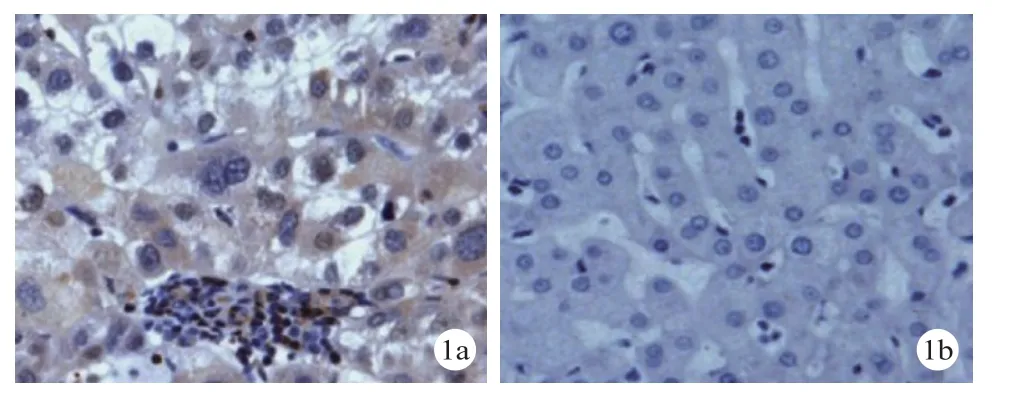
图 1 PLOD2蛋白表达(a.HCC组织; b.癌旁组织;SP×400)
2.2 HCC组织PLOD2蛋白表达与临床指标相关性 PLOD2蛋白阳性表达率与分化程度、TNM分期、淋巴结转移和微血管侵犯有关(P<0.05)。见表1。
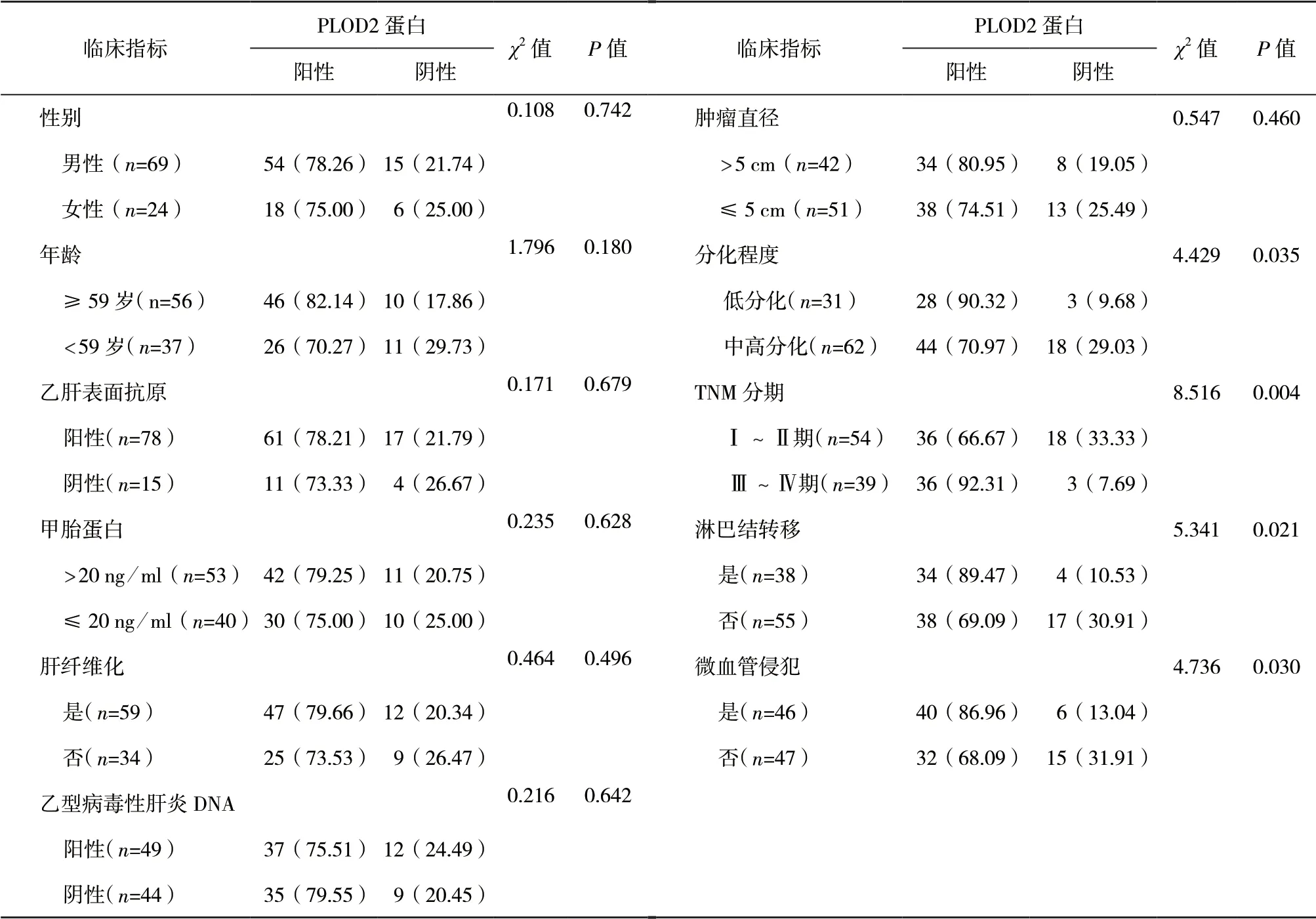
表1 HCC组织中PLOD2蛋白表达与临床病理指标相关性
2.3 3组细胞PLOD2 mRNA表达量比较 PLOD2干扰组PLOD2 mRNA相对表达量为(0.22±0.11),低于阴性对照组的(1.03±0.08)和空白组的(1.00±0.07),差异有统计学意义(P<0.005)。
2.4 3组细胞细胞迁移能力比较 PLOD2干扰组24 h时划痕愈合率为(43.91%±3.44%),低于阴性对照组的(60.37%±4.47%)和空白组的(63.17%±6.68%),差异有统计学意义(P<0.05)。见图2。
2.5 3组细胞侵袭能力比较 PLOD2干扰组侵袭细胞数(81.81±4.19)个,低于阴性对照组的(133.91±6.72)个和空白组的(128.11±7.87)个,差异有统计学意义(P<0.05)。见图3。

图 2 划痕实验检测结果(a.PLOD2干扰组0 h;b.阴性对照组0 h;c.空白组0 h;d.PLOD2干扰组24 h;e.阴性对照组24 h;f. 空白组24 h)
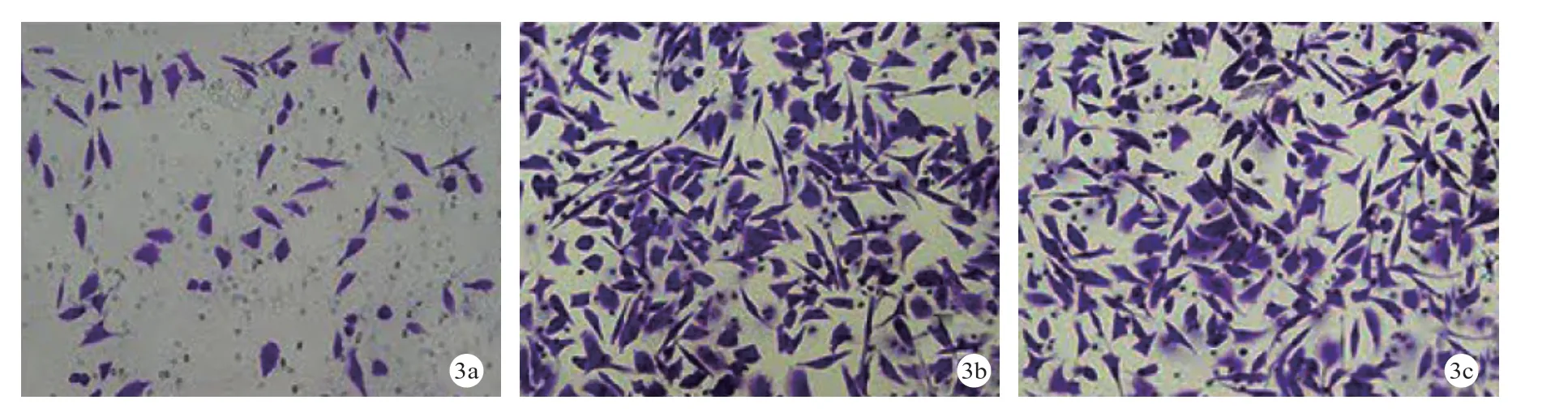
图 3 Transwell法检测结果(a.PLOD2干扰组;b.阴性对照组;c.空白组;200倍)
3 讨论
肿瘤细胞侵袭转移与细胞周围的微环境密切相关[13]。其中,细胞外基质是微环境的主要构成部分,而细胞外基质中的胶原纤维交联增多、硬度增加为肿瘤细胞快速运动及远处转移搭建了平台[14]。在此过程中,PLOD2是调控胶原蛋白合成,促进胶原纤维交联、重构的主要赖氨酸羟化酶[15]。有研究报道,食管鳞癌组织中PLOD2高表达,参与了细胞迁移和侵袭[16]。此外,PLOD2蛋白在肾透明细胞癌[17]、喉癌[18]、肺腺癌[19]组织中表达也明显增多。本研究结果显示,PLOD2蛋白在HCC组织中阳性表达率升高,说明HCC组织中PLOD2蛋白高表达可能与HCC发生有关。进一步分析不同临床指标患者PLOD2蛋白的表达情况,结果显示,PLOD2蛋白阳性表达率在低分化、Ⅲ~Ⅳ期、淋巴结转移和微血管侵犯的患者癌组织中升高,提示PLOD2蛋白可能与HCC恶性化进展及侵袭转移有关。
本研究利用转染PLOD2干扰序列的方法对人肝癌细胞HepG2进行分组处理,结果显示,PLOD2干扰组PLOD2 mRNA相对表达量降低,说明PLOD2干扰组PLOD2基因表达被成功抑制。有研究报道,PLOD2驱动IL-6/STAT3信号通过激活整合素β1促进口腔鳞状细胞癌的侵袭和转移[20]。另有研究报道,PLOD2可能通过上皮-间质转化促进子宫内膜癌细胞侵袭[5]。本研究结果显示,PLOD2干扰组24 h时划痕愈合率较阴性对照组和空白组降低,说明PLOD2参与了细胞迁移过程,抑制细胞中PLOD2基因表达可抑制细胞侵袭。
综上所述,PLOD2蛋白在HCC组织中呈高表达,且与恶性进展指标有关,在发生淋巴结转移和微血管侵犯的组织中表达明显升高,下调PLOD2基因表达可明显抑制人肝癌细胞HepG2迁移和侵袭,但有关的分子机制仍需进一步研究明确。
