陆地棉基因GhMIPS1A 的克隆及功能分析
2022-07-07徐婷婷张弛冯震刘其宝李黎贝俞啸天张雅楠喻树迅
徐婷婷,张弛,冯震,刘其宝,李黎贝,俞啸天,张雅楠,喻树迅,2*
(1.浙江农林大学/ 省部共建亚热带森林培育国家重点实验室,杭州 311300;2.中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000)
肌醇(myo-inositol),又称环己六醇,分子式是C6H12O6,结构类似于葡萄糖。 大量研究表明,肌醇是植物生长发育所必需的[1],可以作为重要的前体和原料,广泛参与植物细胞壁和细胞膜的生物合成、生长发育、细胞膜信号转导、逆境调节等多种生命活动[2-4]。肌醇的合成主要分为3 个步骤: 首先D- 葡萄糖在己糖激酶的作用下磷酸化生成D- 葡萄糖-6- 磷酸, 然后D- 葡萄糖-6- 磷酸在肌醇-1- 磷酸合酶(myo-inositol-1-phosphate synthase,MIPS)[5]的作用下环化生成肌醇-1- 磷酸, 最后肌醇-1- 磷酸在肌醇单磷酸酶的作用下脱磷酸化生成游离的肌醇,其中MIPS 是限速酶,在维持肌醇稳态中起关键作用[6]。 研究表明,MIPS 不仅可以作为限速酶参与肌醇的合成,还可以作为转录调控因子参与植物的生长发育[7]。
MIPS 广泛存在于原核生物和真核生物中,目前已经在高等植物、动物、真菌、细菌等多种生物中被分离并检测出活性[8]。 已有多项研究表明MIPS 在植物的耐盐性、耐旱性、生长发育中发挥重要作用[9-10]。在拟南芥(Arabidopsis thaliana)中已鉴定出3 个MIPS基因,分别为AtMIPS1、AtMIPS2、AtMIPS3[11]。 其中,AtMIPS1在种子发育中起关键作用,缺失AtMIPS1会导致抗坏血酸(ascorbic acid,AsA) 和磷脂酰肌醇含量减少,从而导致子叶出现病斑、叶片卷曲、植株矮化[12]。 通过RNA 干扰技术 (RNA interference, RNAi)抑制马铃薯(Solanum tuberosum)中MIPS基因的表达,会导致叶片形态变化和块茎产量降低[13]。利用RNAi 降低苹果(Malus pumila)中MdMIPS基因的表达,导致肌醇含量降低,进而导致细胞程序性死亡,叶和根坏死,最终造成植株死亡,表明MIPS在苹果中发挥重要的生理作用[14]。 从1 种盐生稻(Porteresia coarctata)中分离出MIPS耐盐基因PINO1, 将该基因转入烟草(Nicotiana tabacum)植株后检测肌醇含量,发现转基因烟草在高盐环境中能够积累更多的肌醇,表明PINO1基因在植物的抗逆中起着关键作用[15]。 转PdMIPS山新杨(Populus davidiana)比野生型山新杨具有更好的盐胁迫耐受性, 说明PdMIPS基因参与植物抗逆胁迫过程[16]。 在玉米中克隆获得2 个ZmMIPS基因, 发现这2 个MIPS基因都能响应盐、干旱等多种非生物胁迫[17]。
棉花(Gossypiumspp.)是世界上重要的经济作物之一[18],其中陆地棉(G.hirsutum)因产量高、纤维较长、品质较好是重要的栽培种[19]。 目前,高产仍然是棉花育种的主要目标[20]。 棉纤维是由胚珠外突起的表皮细胞分化发育而来的,纤维突起的密度和衣分呈显著正相关。 大量研究表明,棉花产量与衣分有着十分密切的关系[21]。GhMIPS1D基因在陆地棉纤维细胞起始期和伸长期早期高水平表达,且可以有效地弥补拟南芥mips1突变体的生长发育缺陷[22]。近年来,土壤盐渍化和干旱等非生物胁迫因素同样严重制约着棉花产量的提高[23]。因此,利用各种分子育种手段挖掘潜在的有价值的基因并进行功能分析,从而提高棉花在逆境中的生存能力和产量显得尤为重要[24-25]。 研究表明,肌醇的氧化产物D- 葡萄糖醛酸(Dglucuronic acid,GlcA) 可用于细胞壁果胶类非纤维素化合物和抗坏血酸的合成。 果胶前体、抗坏血酸以及由抗坏血酸过氧化物酶催化的代谢产物在棉纤维伸长发育中起关键作用[26]。
宿俊吉[27]利用简化测序的关联分析结合连锁分析定位到与陆地棉衣分相关的候选基因GhMIPS1A(Gh_A02G1268),属于MIPS基因家族成员, 比对后发现该基因与拟南芥调节胚胎、种子发育的基因AtMIPS2(AT2G22240)同源。 目前对于MIPS 参与棉纤维发育过程的调控机制研究较少。 因此,本研究从陆地棉标准系材料TM-1中克隆得到GhMIPS1A基因,通过生物信息学分析、亚细胞定位、拟南芥过表达试验、病毒诱导的基因沉默 (virus-induced gene silencing,VIGS)技术和逆境胁迫响应分析,对该基因的功能进行初步研究,为培育抗逆高产的棉花新品种提供优质的基因资源。
1 材料与方法
1.1 植物材料与处理
将陆地棉材料TM-1、新陆早18 号、德字棉531 种植于浙江农林大学平山温室试验基地。 选取新陆早18 号和德字棉531 的根、茎、叶、萼片、花瓣、雄蕊,以及开花前3 d(-3 days post anthesis,-3 DPA)、开花当天、开花后3 d 和5 d 的胚珠(5 DPA 及之前纤维与胚珠无法准确区分),开花后10 d、15 d 和20 d 的胚珠和纤维用于实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction, qRT-PCR)分析,每个样品取3 个生物学重复。
使用本生烟(N.benthamiana)进行瞬时转化,材料种植于浙江农林大学人工气候室,温室的培养条件为:温度22 ℃,光照16 h/ 黑暗8 h,相对湿度75%。
使用拟南芥哥伦比亚型(Col-0)进行遗传转化,材料种植于浙江农林大学人工气候室,培养条件为:温度25 ℃,光照16 h/ 黑暗8 h,相对湿度50%。
1.2 载体和试剂
所用的载体pBI121、pCAMBIA3301、pCLCr-VA、pCLCrVB 保存于本课题组。大肠杆菌DH5α感受态、农杆菌(Agrobacterium tumefaciens)菌株GV3101、LBA4404 感受态购于上海唯地生物公司。 限制性内切酶购于NEB 公司。 DNA 提取试剂盒购于天根生化科技(北京)有限公司。 多糖多酚植物的RNA 提取试剂盒、 质粒小提试剂盒购于天根生化科技有限公司。GXL DNA Polymerase高保真酶、 反转录试剂盒、 荧光试剂TB GreenPremix Ex Taq TMⅡ(Tli RnaseH Plus)购于宝日医生物技术(北京)有限公司。 乙酰丁香酮、2-吗啉乙磺酸、1/2 MS 固体培养基购于源叶生物。 肌醇提取试剂盒、D- 葡萄糖提取试剂盒购于北京智微科技有限公司。 引物合成和测序由杭州有康生物有限公司完成。 本研究所用引物序列见表1。

表1 本研究中使用的引物Table 1 Primers used in this study
1.3 棉花DNA、RNA 的提取与基因表达分析
棉花DNA 的提取参考说明书。 参考多糖多酚植物总RNA 提取试剂盒说明书,提取1.1 中各材料的RNA。 使用反转录试剂盒进行反转录,合成第一条链互补DNA(complementary DNA,cDNA)。 将得到的cDNA 加水稀释50 倍后作为qRT-PCR 模板。 反应体系参考试剂盒说明书,使用Stepone Plus Real-time PCR System 仪器检测分析,每个材料进行3 次技术重复。以GhHistone 3为棉花的内参基因, 以AtUBQ5为拟南芥的内参基因。
1.4 陆地棉GhMIPS1A 基因的克隆及生物信息学分析
从CottonFGD 网站 (http://cottonfgd.org/)获得Gohir.A02G132300基因的全长序列, 该基因位于A02 染色体上,根据Ma 等[22]的命名规则,将其命名为GhMIPS1A。 从陆地棉TM-1 中克隆GhMIPS1A基因, 通过双酶切构建过表达载体PBI121-GhMIPS1A。 通过热激法转化农杆菌GV3101。通过CottonFGD 网站获得陆地棉、雷蒙德氏棉(G.raimondii)、亚洲棉(G.arboreum)和海岛棉 (G.barbadense) 中MIPS 蛋白序列。 通过NCBI 在线网站(https://www.ncbi.nlm.nih.gov)查找获得榴莲(Durio zibethinus)、可可(Theobroma cacao)、大 豆(Glycine max)、拟 南 芥、玉 米(Zea mays)和水稻(Oryza sativa)6 个物 种 的MIPS 蛋白序列。 使用ClustalX(http://www.clustal.org/)进行氨基酸序列比对, 利用MEGA 7.0 软件(http://www.mega-software.net/) 采用邻接法构建系统进化树,自展值设为1 000,其余参数设置为默认值。 使用DNAMAN 软件对GhMIPS1A氨基酸序列进行保守性分析。 使用GSDS(http://gsds.cbi.pku.edu.cn/index.php)进行外显子- 内含子结构分析。
1.5 亚细胞定位分析
采用冻融法,将构建的35S∷GhMIPS1AGFP 融合表达载体、35S∷GFP 空载体转化农杆菌菌株GV3101。 利用烟草瞬时转化进行亚细胞定位,选取生长4 周左右的烟草的第三或第四片平滑且完整的叶片进行注射。 注射后避光培养24 h, 恢复光照继续培养48 h, 然后在蔡司LSM510 激光共聚焦显微镜下进行观察并拍照。
1.6 病毒诱导的基因沉默试验及拟南芥转化
参考Gu 等[28]的具体试验步骤构建VIGS 载体并进行棉花侵染。 VIGS 所用载体系统为:pCLCrVA (空 载 体)、pCLCrVB (辅 助 载 体)、pCLCrVA-PDS(阳性对照)。 以TM-1 叶片cDNA为模板进行基因片段的克隆,构建pCLCrVAGhMIPS1A 载体并转化农杆菌LBA4404。阳性菌液可添加终浓度为20%(体积分数)甘油,长期保存于-80 ℃冰箱。 将TM-1 种子播种于育苗盘,放于长日照条件(16 h 光照/8 h 黑暗)下的光照培养箱培养,待生长至子叶完全展平后使用注射法侵染棉花幼苗子叶, 以pCLCrVA-PDS 作为阳性对照, 侵染后的棉花幼苗在黑暗中放置24 h后, 重新放置于培养箱(25 ℃,16 h 光照/8 h 黑暗)培养,后续持续观察表型。
采用花序侵染法,将构建好的GhMIPS1A过表达载体转化拟南芥, 使用含有卡那霉素的1/2 MS 固体培养基筛选转基因株系, 对筛选的阳性植株移栽并进行检测。 至T3进行阳性鉴定、表型观察、肌醇含量测定。
1.7 代谢物肌醇和D-葡萄糖含量的测定
待测样品制备方法:精确称取并记录植物样品组织质量,加入适量蒸馏水,使用研磨机粉碎制成匀浆, 将匀浆完全转移至干净的100 mL 容量瓶中备用,按照肌醇提取试剂盒说明书测定肌醇含量和D-葡萄糖含量。
1.8 干旱、盐胁迫处理及脯氨酸、丙二醛含量的测定
将TM-1 棉花种子播种于育苗盘, 放于长日照条件(16 h 光照/8 h 黑暗)下的光照培养箱培养生长,待棉花生长至幼苗4 叶期,选取展平的真叶在水中培养1 d 后, 将离体叶片分别转移至含有200 mmol·L-1NaCl 及20%(质量分数)聚乙二醇6000(PEG 6000)溶液中进行胁迫处理,以水处理的叶片作为对照[29-30]。 分别在处理0 h、2 h、4 h、6 h、8 h、12 h、24 h 后进行取样,样品立即用蒸馏水洗净后擦干水分, 用剪刀去掉叶脉,剩余部分剪成0.5 cm×0.5 cm 小块,在液氮中速冻后,于-80 ℃冰箱储存或直接用于RNA 提取、生理指标的测定。 以上样品均取3 个生物学重复。脯氨酸(proline,Pro)含量测定方法为酸性茚三酮法[31],丙二醛(malondialdehyde, MDA)含量测定方法为硫代巴比妥酸法[32]。
2 结果与分析
2.1 MIPS 基因家族成员鉴定及保守序列分析
MIPS基因家族是一个非常小的家族, 在大多数植物中通常包含1~2 个成员。 但是在陆地棉和海岛棉中分别发现4 个MIPS基因。 为研究MIPS基因家族在植物中的进化特征,将陆地棉、海岛棉、雷蒙德氏棉、亚洲棉、榴莲、可可、大豆、拟南芥、玉米、水稻10 个物种中的29 个MIPS 蛋白序列进行系统进化分析,结果显示单子叶植物的MIPS 蛋白聚在一起, 双子叶植物的MIPS 蛋白聚在一起(图1)。 将GhMIPS1A 和其他6 个物种的MIPS 蛋白进行多序列比对发现,MIPS 蛋白在植物中的保守性很高,氨基酸序列相似性高达93%,并且存在4 段高度保守的序列(图2):GWGGNNG、LWTANTERY、NGSPQNTFVPGL、SYNHLGNNDG, 推测这4 个保守基序对于MIPS 发挥功能至关重要。
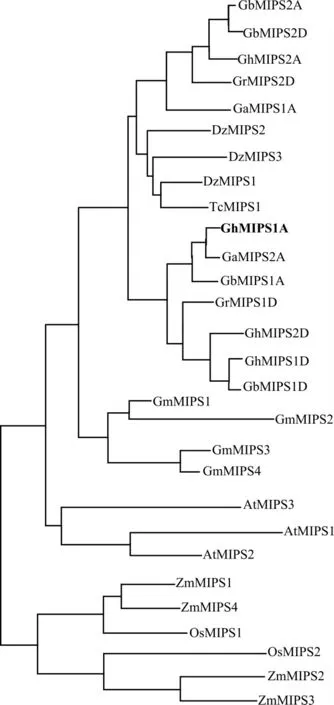
图1 10 种植物的29 个MIPS 同源蛋白序列的进化分析Fig. 1 Phylogenetic analysis of 29 MIPS proteins of ten species

图2 7 个代表性植物MIPS 蛋白的多重序列比对Fig. 2 Multiple sequence alignment of MIPS proteins in seven representative plants
2.2 MIPS 基因的结构分析
为了进一步研究MIPS基因家族成员的进化关系, 对4 个陆地棉MIPS基因序列和其他9 个植物25 个MIPS基因进行外显子- 内含子结构分析。在绝大多数高等植物中,MIPS基因都有10个外显子, 说明MIPS基因在进化过程中高度保守。 然而拟南芥中AtMIPS1和AtMIPS12基因分别含有9 个和7 个外显子, 这表明拟南芥在进化过程中可能经历了特殊的进化事件(图3)。
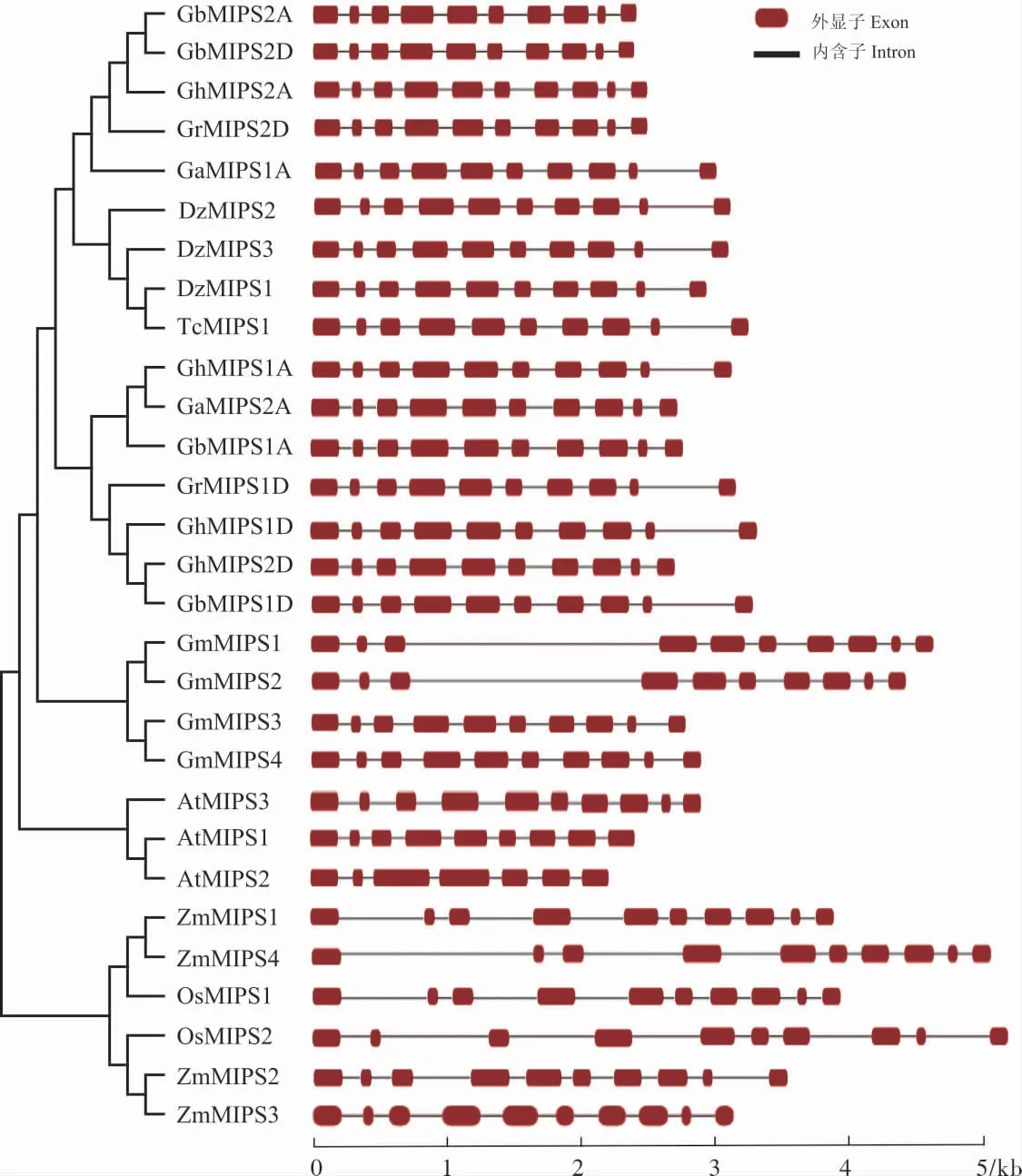
图3 10 种代表性植物MIPS 基因的外显子-内含子结构Fig. 3 Exon-intron structure of MIPS genes in ten species
2.3 GhMIPS1A 的时空表达模式分析
为了探究GhMIPS1A的组织表达特性和空间表达特性, 分别使用高衣分材料新陆早18 号和低衣分材料德字棉531 进行基因表达分析,结果显示:GhMIPS1A在0 DPA、3 DPA、5 DPA 的胚珠中较高水平表达(图4A),在根、茎、叶、纤维中表达量较高(图4B),而且GhMIPS1A基因在高衣分材料新陆早18 号上述器官中的表达量均高于其在低衣分材料德字棉531 中的表达量(图4)。由此推测,该基因在陆地棉纤维发育早期发挥重要作用,可能影响陆地棉的产量。
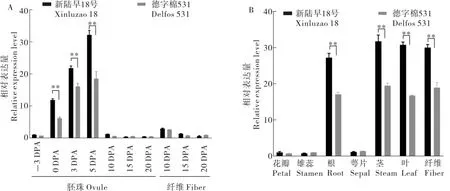
图4 GhMIPS1A 的时空表达分析Fig. 4 Temporal and spatial expression patterns of GhMIPS1A
2.4 GhMIPS1A 的亚细胞定位
亚细胞定位试验观察发现,GhMIPS1A-GFP融合蛋白的绿色荧光仅分布于细胞膜 (图5A~C),而对照的荧光分布于整个细胞中(图5D~F)。
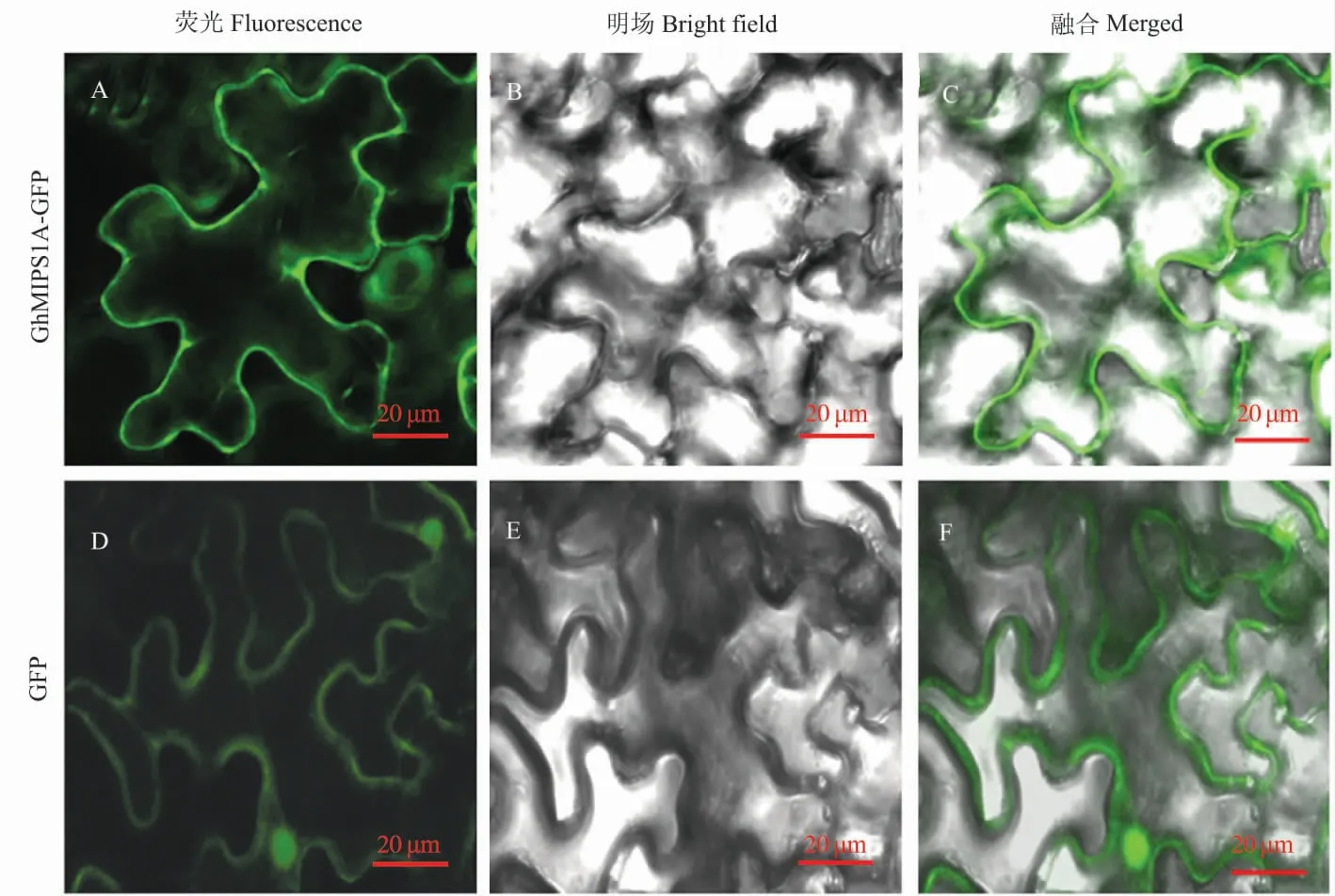
图5 GhMIPS1A 蛋白的亚细胞定位Fig. 5 Subcellular localization of GhMIPS1A protein
2.5 病毒诱导的GhMIPS1A 基因沉默
转化pCLCrVA-PDS 的阳性对照植株整株叶片出现不同程度的白化现象,表明该沉默系统成功且有效。 转化空载体的对照植株及GhMIPS1A沉默植株在表型上并没有明显差异 (图6A)。qRT-PCR 结果表明, 在GhMIPS1A沉默株系VL1、VL2、VL3 中,GhMIPS1A的表达量不同程度地降低,说明该基因被成功沉默(图6B)。 测定代谢物肌醇和D- 葡萄糖的含量(图6C)发现,随着GhMIPS1A基因的沉默, 肌醇含量也随之显著降低,3 个沉默株系的肌醇含量分别降低31.83%、32.90%、29.46%,但葡萄糖含量无显著变化。 测定成熟棉铃衣分发现,与空载体对照植株相比,GhMIPS1A沉默植株的纤维密度降低(图6D),3 个GhMIPS1A沉默株系VL1、VL2、VL3 的衣分分别降低4.48、4.93、3.95 百分点(图6E)。
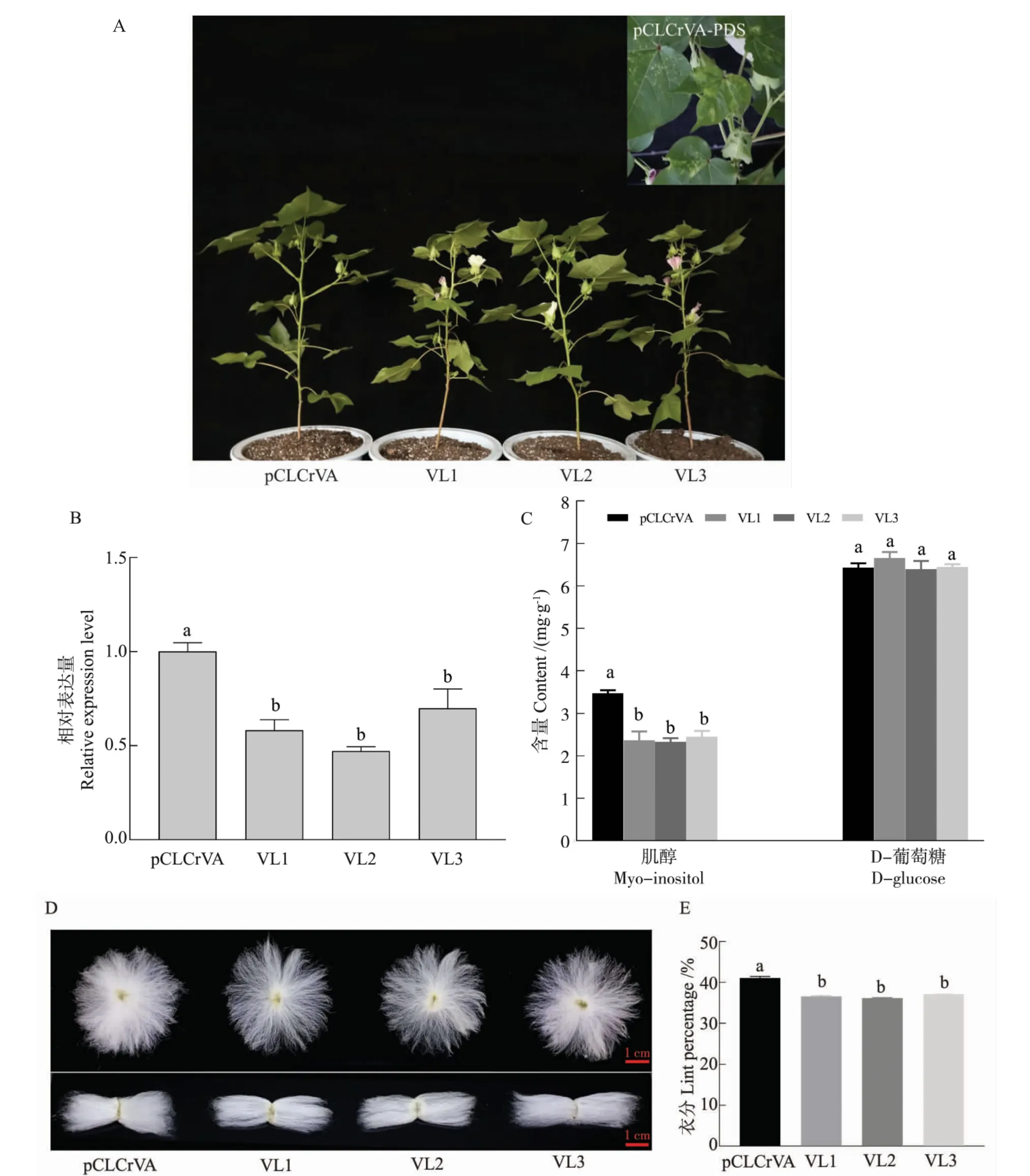
图6 GhMIPS1A 沉默植株的表型Fig. 6 Phenotypes of GhMIPS1A-silenced plants
2.6 GhMIPS1A 在拟南芥中的功能研究
为了探究GhMIPS1A基因在植物生长发育过程中所发挥的功能,构建过表达载体转化拟南芥,得到3 个过表达株系,分别为L1、L2、L3(图7A~B)。将T3种子播种于1/2 MS 固体培养基上垂直培养1 周,观察测定拟南芥根长,结果发现转基因拟南芥的根长显著长于野生型 (图7A、7C)。 同时测定肌醇含量和D- 葡糖糖的含量发现,转基因拟南芥中肌醇含量比野生型拟南芥高1 倍以上,但是D- 葡萄糖含量无显著差异,其原因可能是D- 葡萄糖的含量由多条不同的代谢途径共同决定(图7D)。
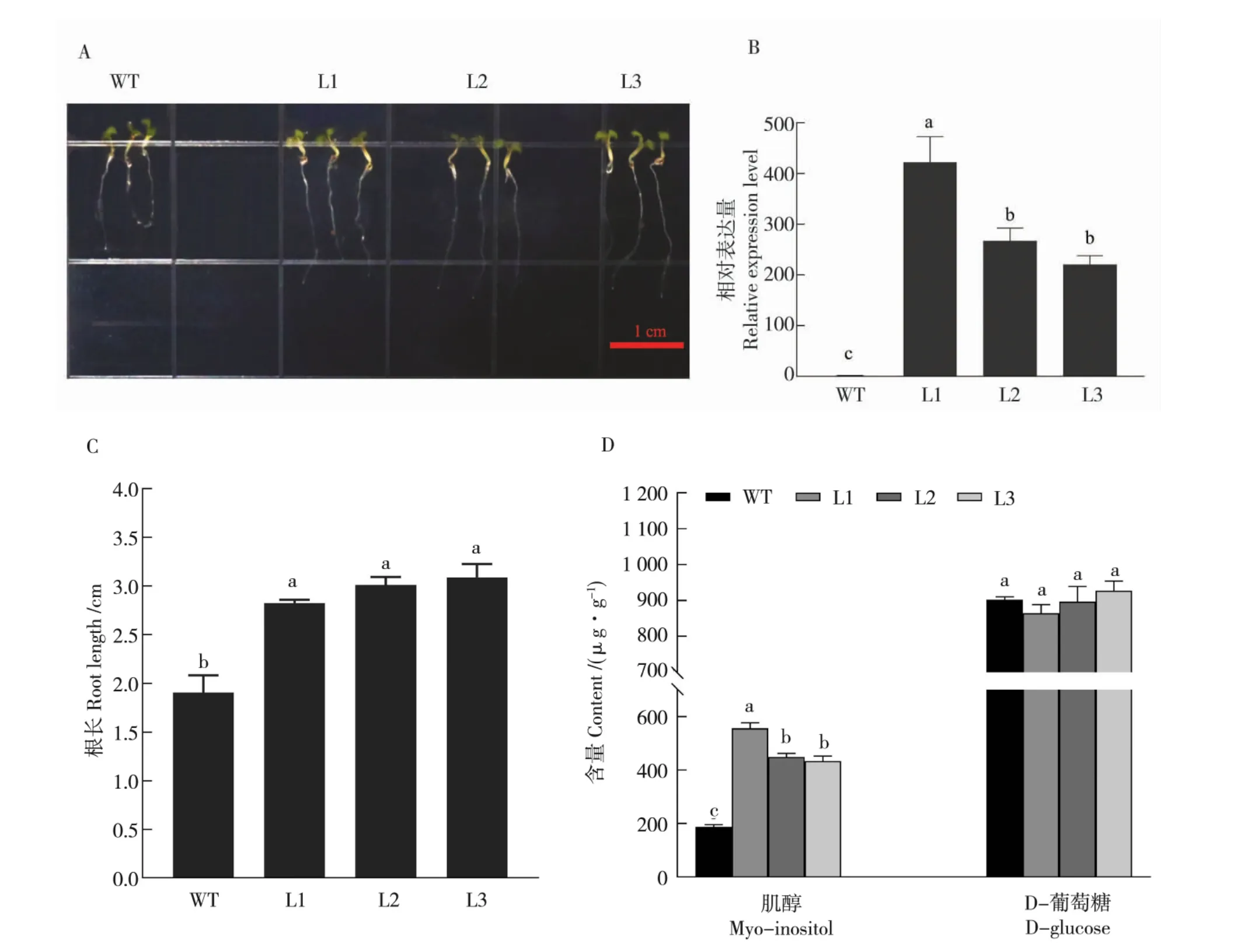
图7 GhMIPS1A 基因在拟南芥中的功能研究Fig. 7 Functional analysis of GhMIPS1A in A. thaliana
2.7 干旱胁迫下和盐胁迫下GhMIPS1A 的表达变化及相关代谢物含量的变化
为了分析GhMIPS1A在多种胁迫下的表达模式, 本研究使用4 叶期的陆地棉幼苗作为材料,分别进行干旱、高盐胁迫处理,检测处理后叶片脯氨酸和丙二醛含量。 结果显示:随着干旱或盐胁迫处理时间的延长,脯氨酸的含量也随之增加(图8B),同时丙二醛的含量整体呈现增加的趋势(图8A),表明棉花叶片对胁迫做出了响应。qRT-PCR 结果表明, 无论是盐胁迫还是干旱胁迫,GhMIPS1A的表达量都呈现先增后减的趋势(图8C~D),肌醇含量随着GhMIPS1A基因的表达呈现相同的变化趋势(图8E~F),这些结果均表明GhMIPS1A基因积极响应盐胁迫和干旱胁迫,可能在抗逆胁迫过程中发挥重要作用。
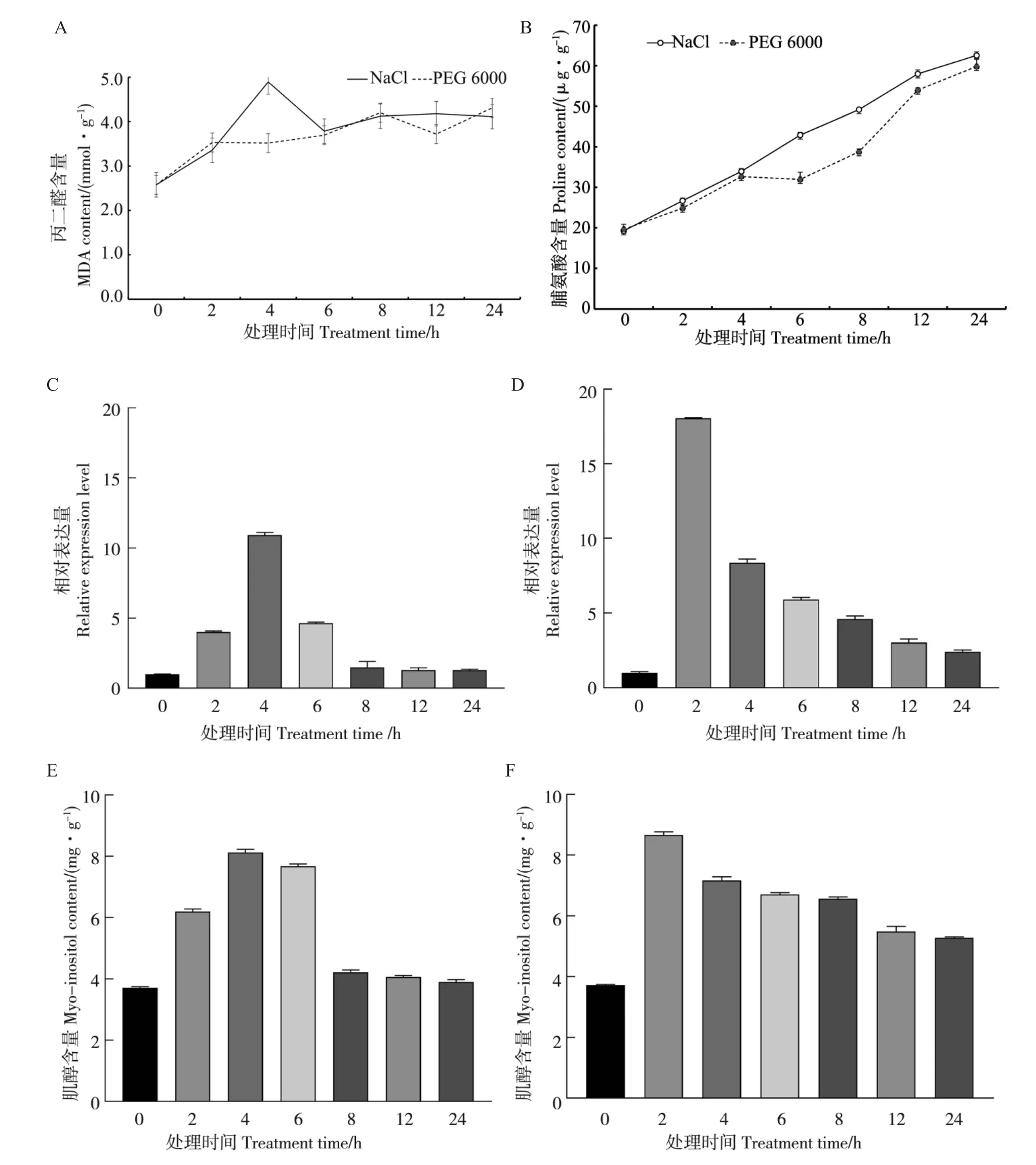
图8 非生物胁迫下GhMIPS1A 的表达模式及相关代谢物含量Fig. 8 Expression patterns of GhMIPS1A and relative metabolite contents under different abiotic stresses
3 讨论
MIPS基因家族成员非常少,除了拟南芥有3个MIPS家族成员,陆地棉、海岛棉、大豆和玉米各有4 个MIPS家族成员外, 绝大多数植物中仅有1~2 个成员[33]。所有高等植物MIPS基因大多编码约510 个氨基酸, 氨基酸序列相似性高达93%,且存在4 个高度保守的基序,这与前人的研究结果[34-35]一致。而内含子-外显子结构分析显示拟南芥可能经历了复杂的进化事件。
MIPS 是肌醇及其衍生物合成中的关键酶,在植物的生长发育、 细胞壁和细胞膜的生成、信号转导、抗逆调节等过程中起关键调控作用。 已有的研究表明,MIPS基因在陆地棉纤维发育的起始期和伸长期早期发挥重要的作用[22],棉花的产量通常由棉纤维起始期的突起细胞数目决定,分析高低衣分材料间基因表达量的差异, 推测GhMIPS1A可能是控制陆地棉产量的正向调控因子。
在拟南芥中发现3 个MIPS基因AtMIPS1、AtMIPS2、AtMIPS3。 其中,AtMIPS1对于种子的发育至关重要,缺少AtMIPS1可使脱落酸和肌醇衍生物含量减少,从而产生叶片卷曲、植株矮小、子叶病变等异常表型。 MIPS 能够改变植物细胞壁和细胞膜的通透性,促进植物细胞对营养成分的吸收转运,在植物对逆境胁迫的耐受中起非常重要的作用。 在拟南芥中过表达GhMIPS1A基因,转基因拟南芥的根长显著增加,肌醇含量也随着提高。 亚细胞定位结果显示MIPS 蛋白定位于细胞膜中, 由此推测GhMIPS1A基因是参与细胞信号转导、影响植物生长的重要信号分子。
已有报道表明,果胶前体物质和抗坏血酸对于棉纤维的生长发育是必不可少的[36-37],MIPS 影响果胶前体UDP-D- 葡萄糖醛酸和抗坏血酸的合成[38]。 UDP-D-葡萄糖醛酸、磷脂酰肌醇和磷脂酰肌醇激酶是重要的肌醇衍生物,已被证明是细胞壁、细胞膜的重要组成部分,参与棉花纤维的伸长生长[39]。 为了进一步探究GhMIPS1A在陆地棉中发挥的作用, 本研究通过VIGS 试验沉默GhMIPS1A基因在棉花TM-1 中的表达, 导致肌醇含量降低, 发现随着该基因表达量的降低,棉花的纤维密度和衣分均降低, 初步表明GhMIPS1A基因对于陆地棉棉纤维的生长发育起正向调控的作用。 若要进一步明确GhMIPS1A基因在纤维发育过程中所发挥的作用,则需要进行更深入的研究。 如针对该基因构建CRISPRCas9 载体,获得突变株系进一步探究其在陆地棉中的调控机制。
肌醇是植物的第二信使分子1,4,5- 三磷酸肌醇(IP3) 的前体物质,IP3通过液泡膜和粗糙内质网上的钙离子通道结合,激活钙调蛋白,形成Ca2+/CaM 复合物,并激活一系列下游蛋白,从而调控与抗逆胁迫相关的一系列级联反应[40]。 肌醇的生物合成是不同生化途径高度调控的过程,因此GhMIPS1A基因是如何与其他相关酶基因相互协作参与肌醇代谢通路调控,以及如何和生长素、赤霉素等植物激素相互作用影响植物的生长发育需深入挖掘。
干旱、盐碱等非生物胁迫是限制植物生长发育和作物产量的主要因素,因此挖掘优异的耐盐耐旱基因资源具有重要的现实意义[41]。 本研究利用200 mmol·L-1NaCl 和20%PEG 6000 处理模拟盐胁迫和干旱胁迫环境,发现GhMIPS1A基因可以快速响应逆境胁迫,且肌醇含量在盐胁迫和干旱胁迫下显著增加。 然而,该基因在逆境胁迫响应信号中的位置以及如何作用尚不清楚,需进行更深入的研究验证其耐盐、耐旱性。
4 结论
本研究从陆地棉TM-1 中克隆出1 个MIPS基因,将其命名为GhMIPS1A。 通过氨基酸序列保守性分析、系统发育树分析、外显子-内含子结构分析表明MIPS 在进化过程十分保守。 亚细胞定位结果显示GhMIPS1A蛋白定位于细胞膜。GhMIPS1A基因在根、茎、叶、纤维组织中具有较高的表达量,在纤维发育的起始期和伸长期早期优势表达,且在高低衣分材料中的表达量有显著差异。过表达GhMIPS1A基因的拟南芥植株根长增加,肌醇含量随之增加。VIGS 技术沉默GhMIPS1A基因后的棉花植株出现纤维密度降低的现象, 且衣分也随之减少。GhMIPS1A基因在盐胁迫、干旱胁迫响应途径中具有积极作用。
