不同翅型棉蚜体内细菌群落组成和多样性分析
2022-07-07史庆雨李东阳王丽高雪珂张开心朱香镇姬继超雒珺瑜
史庆雨,李东阳,王丽,高雪珂,张开心,朱香镇,姬继超,雒珺瑜
(中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南安阳 455000)
棉蚜(Aphis gossypii)属半翅目蚜科,是世界性分布害虫,可危害多种寄主植物,也是危害棉花作物的重要害虫之一[1]。 它通过刺吸式口器取食植物汁液从而影响植物生长发育,且可在不同寄主间转移导致植物病毒的传播,对农业生产造成严重危害[2]。
翅多型是相同基因型个体产生有(长)翅型和无(短)翅型不同形态的现象,是昆虫在繁殖与飞行扩散间权衡的一种策略[3]。 翅多型现象使得昆虫能更好地适应多变的生存环境,对种群环境适应性进化有着重要意义[4-5]。 如:沙蟋(Gryllus firmus)长翅型成虫主要进行远距离迁徙,而短翅型成虫主要进行快速繁殖[6];不同环境下褐飞虱(Nilaparvata lugens)可分化为长翅型和短翅型,长翅型具有季节性远距离迁飞习性,而短翅型具有产卵前期短、寿命长等特点[7];飞蝗(Locusta migratoria)在高密度下会出现群居型,低密度下则会出现散居型,群居型翅长,散居型翅短[8];蚜虫因种群密度和营养条件可分化为有翅型和无翅型2 种形态, 有翅型有强壮的飞行肌和翅,而无翅型具有快速繁殖的能力。 食物不充足或者棉蚜种群密度过大等因素均会诱导大量有翅蚜产生,以迁徙寻找更好的生存环境。 综上所述,种群密度和植物营养是影响翅多型的主要因素[9-10]。翅多型调控机理更是研究热点之一,例如:褐飞虱中胰岛素和c-Jun 氨基端激酶 (c-Jun N-terminal kinase,JNK) 信号通路介导褐飞虱翅型多样性;在豌豆蚜(Acyrthosiphon pisum)中蜕皮激素信号通路影响翅型分化[11-13]。
共生菌分为初生共生菌和次生共生菌,初生共生菌一般是宿主生长发育所必需的,次生共生菌一般与宿主的适应性有关[14]。 共生菌可以给宿主提供营养、促进新陈代谢、影响生长发育、影响昆虫的行为[15]。沃尔巴克氏体(Wolbachia)是一种立克氏体,1936 年才被命名, 对宿主生殖活动起重要调控作用, 主要包括诱导宿主的胞质不亲和、孤雌生殖、雌性化、雄性致死等[16]。 研究表明,共生菌参与调控昆虫翅型分化[17]。 对长翅型以及短翅型埃及扁胸切叶蚁(Vollenhovia emeryi)进行微生物多样性分析发现,所有长翅型均携带沃尔巴克氏体,而所有短翅型均不携带沃尔巴克氏体,推测沃尔巴克氏体可能参与翅型分化的调控[18]。 然而,微生物参与蚜虫翅型分化作用机理的研究并不深入。 Reyes 等[19]在对比3 种次生共生 菌Serratia symbiotica、Hamiltonella defensa和Regiella insecticola对豌豆蚜后代有翅蚜产生的影响时,发现R.insecticola对有翅后代的影响最大;Shang 等[20]对褐色橘蚜(Aphis citricidus)有翅和无翅成虫体内细菌进行16S 核糖体RNA(ribosome RNA,rRNA)测序,发现无翅成虫具有较高的细菌多样性。
分子生物学和高通量测序技术的发展为细菌群落特征鉴定提供了新方法[21]。 对聚合酶链式反应(polymerase chain reaction,PCR)扩增的细菌16S rRNA 片段进行测序, 可以检测到样本中存在的大多数细菌群落,是研究蚜虫微生物群落的一种高效方法[22-24]。 利用高通量测序技术能够研究不同生物体的整个微生物群落,Zepeda-Paulo等[25]通过16S rRNA 扩增子测序检测了麦长管蚜(Sitobion avenae) 和禾谷缢管蚜(Rhopalosiphum padi)的细菌群落多样性,并发现蚜虫具有作为植物致病菌载体或替代宿主的潜在作用。
为明确有翅型与无翅型棉蚜成虫体内细菌群落的差异,本研究通过高通量测序技术对2 组样品16S rRNA 扩增子进行检测, 从而获得棉蚜有翅、 无翅型体内细菌的组成与结构, 并比较2组棉蚜样品体内细菌群落间的差异,为后续探究体内细菌在棉蚜翅型分化中的作用奠定基础。
1 材料与方法
1.1 供试昆虫
供试棉蚜采集于中国农业科学院棉花研究所试验农场试验棉田棉花上, 于中棉所49 的离体棉花子叶上单头饲养建立单克隆种群。 饲养条件为:26 ℃±1℃,光周期为14 h(光照)/10 h(黑暗),相对湿度70%~80%。 所用的有翅型和无翅型棉蚜,均源于同一个单克隆。
1.2 样品收集
通过高种群密度诱导棉蚜产生有翅蚜,通过低种群密度使棉蚜保持无翅状态[26]。 在实验室中通过离体棉花子叶进行棉蚜的饲养,收集无翅蚜时,每片离体棉花子叶上均放置20 头1 龄若蚜;收集有翅蚜时, 每片离体棉花子叶上均放置100头1 龄若蚜,分别收集2 日龄有翅棉蚜成蚜与无翅棉蚜成蚜, 然后依次用75%(体积分数) 的乙醇、磷酸盐缓冲溶液(pH 7.4)和超纯水清洗3 次(每次5 min)。 有翅蚜与无翅蚜各4 个生物重复,每个重复有30 头成蚜。 将有翅型棉蚜4 个重复分别命名为AL_1、AL_2、AL_3、AL_4,无翅型棉蚜4 个重复命名为AP_1、AP_2、AP_3、AP_4。
1.3 DNA 提取和PCR 扩增
使用天根血液试剂盒(DP304)分别提取无翅蚜和有翅蚜虫体总DNA。 采用1%(质量分数)琼脂糖凝胶电泳法检测DNA 质量, 用NanoDrop 2000 微量紫外分光光度计(Thermo,美国)测定DNA 的最终质量浓度。 使用通用引物(338F:5'-ACTCCTACGGGAGGCAGCAG-3',806R:5'-GGACTACHVGGGTWTCTAAT-3') 扩增样本中16S rRNA 基因V3~V4 可变区序列[27]。所用仪器为GeneAmp 9700 热循环PCR 系统(Applied Biosystems 公司,美国)。 扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环35 次;72 ℃延伸10 min。 扩增体系为20 μL,其中模板DNA 10 ng,每种引物0.8 μL(5 μmol·L-1),2.5 mmol·L-1的4 种脱氧核糖核苷三磷酸(deoxyribonucleosidetriphosphate,dNTP)各0.5 μL,4 μL 5×FastPfu 缓 冲 液,0.4 μL FastPfu 聚合酶,最后添加无菌水至20 μL。
1.4 Illumina 测序和数据处理
测序工作由上海美吉生物医药科技有限公司完成,所用平台为Illumina MiSeq,测序平均长度为429 bp。 采用Fastp 对原始序列进行质控:1)过滤读长(reads)尾部质量值20 以下的碱基,设置50 bp 的窗口, 如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的读长,去除含N 碱基的读长;2)根据双端(paired-end,PE )测序读长之间的重叠(Overlap)关系,将成对读长拼接成1 条序列,最小重叠长度为10 bp;3) 拼接序列时允许重叠区最大错配率为0.2,筛除无法拼接的序列;4)根据序列首尾两端的识别码(Barcode)和引物区分样品,并调整序列方向,允许的barcode 错配数为0,引物错配数为2。 使用UPARSE(v7.1,http://drive5.com/uparse/)在97%的相似性水平下对所有序列进行运算分类单元(operational taxonomic unit,OTU)生物信息统计分析[28]。 利用UCHIME(http://drive5.com/uchime/)鉴定并移除嵌合序列[29]。 通过威尔科克森秩和检验(Wilcoxon's rank-sum test)进行差异显著性分析, 并用伪发现率(false discovery rate,FDR)对概率(P)进行检验校正[30]。利用阈值FDR<0.01 和P<0.05,在OTU 水平上鉴定有翅蚜和无翅蚜体内细菌相对丰度的差异显著性。
1.5 多样性分析方法
根据OTU 利用软件Mothurs (v1.30,http://www.mothur.org)采用Shannon 和Chao 1 指数[31]进行细菌多样性分析。采用主坐标分析(principal coordinatesanalysis,PCoA)和主成分分析(principle component analysis, PCA)对不同数据进行可视化[32]。 使用RDP classifier(https://sourceforge.net/projects/rdp-classifier/)在Silva(SSU128)16SrRNA数据库中以70%的置信度分析每个16S rRNA 基因序列的分类[33];整理分析从属到门的OTU 水平上的细菌相对丰度(某属细菌在有翅与无翅棉蚜体内细菌中的占比) 分布, 并使用Microsoft Excel 制作属水平上群落相对丰度柱状图; 采用威尔科克森秩和检验方法在属水平上对有翅型棉蚜和无翅型棉蚜体内细菌的相对丰度进行差异显著性检验,显著性水平设为0.05[34]。对相似性水平为97%的属到门水平的样品, 使用R 语言(v3.3.1)进行数据统计和维恩图(Venn diagram)制作。
1.6 系统发育分析
为了研究已鉴定的棉蚜OTU 的进化关系,使用ClustalW 在默认设置下对16S rDNA 序列进行比对。 基于比对结果在Mega(v5.05)中使用邻接法(neighbor-joining,NJ)构建系统发育树,设置自展值(bootstrap value)为1 000[35]。
2 结果与分析
2.1 16S rDNA 测序数据分析
在Illunina Miseq PE 300 平台上对有翅型与无翅型棉蚜体内细菌16S rRNA 基因V3~V4 区进行测序, 共得到360 461 条高质量读长, 全长154 598 655 bp,平均长度约为429 bp(表1)。 为去除微量的差异,对所有的样本按照最小样本数进行抽平, 并基于97%的序列相似性进行OTU聚类。 通过Shannon 指数和Chao 1 指数稀释曲线对样本进行物种多样性评估,曲线在样品读长数下均能趋于平稳(图1A、1B),表明测序样本量足够,可在此基础上进行数据分析。
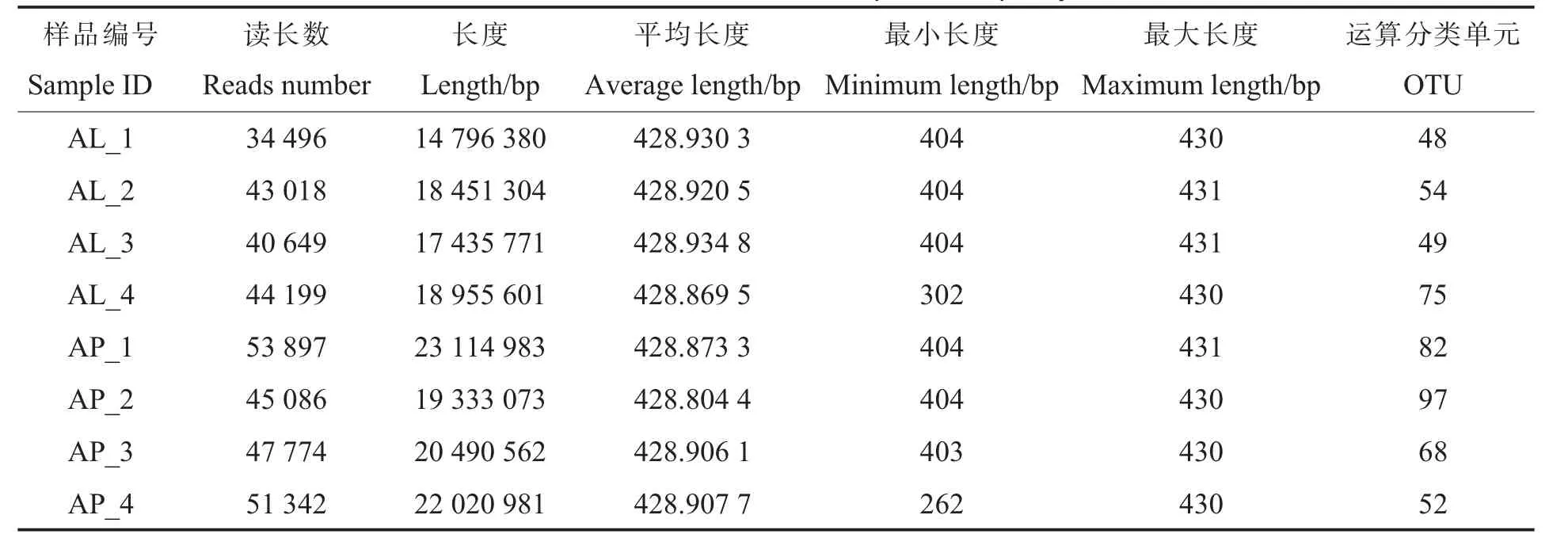
表1 各样本质控后的数据统计Table 1 Statistical data of each sample after quality control
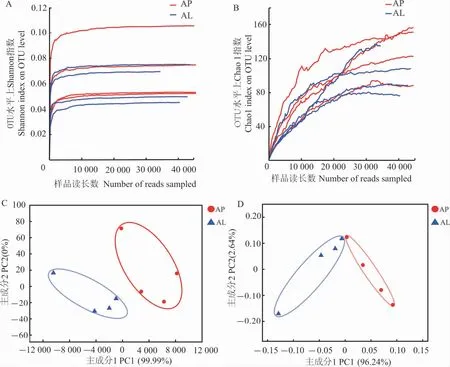
图1有翅(AL)和无翅(AP)棉蚜体内细菌群落α多样性指数稀释曲线和样本聚类分析结果Fig. 1 Rarefaction curves from α-diversity indices and samples cluster analysis plot of bacteria communities from alate (AL) and apterous (AP) morphs of A. gossypii
2.2 物种注释与分析
2 组棉蚜样本共聚类到234 个OTU, 这些OTU 按分类阶元可划分为16 门、32 纲、64 目、107 科、148 属、187 种。 在门水平上,变形菌门(Proteobacteria)为优势菌门(相对丰度99.55%);在纲水平上,丙型变形菌纲(Gammaproteobacteria)为优势菌纲(相对丰度99.50%);在目水平上,肠杆菌目(Enterobacteriales)为优势菌目(相对丰度99.46%); 在科水平上, 肠杆菌科(Enterobacteriaceae)为优势菌科(相对丰度99.46%)(表2)。
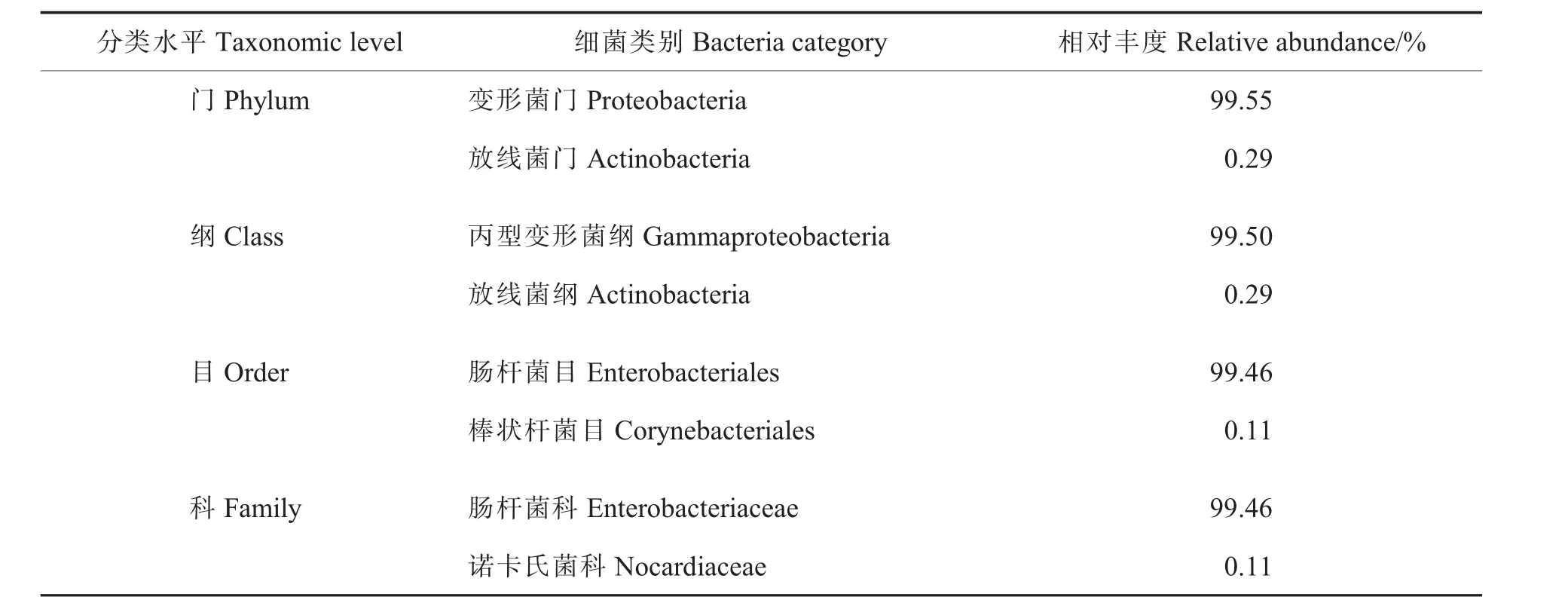
表2 棉蚜体内细菌在不同分类水平上的组成Table 2 Community composition of bacteria in A. gossypii at different taxonomic levels considering both alate and apterous morphs
2.3 棉蚜体内主要细菌的系统发育树
选取相对丰度前100 个OTU 进行系统发育树构建, 在门水平上发育树一共有10 个分支,分别为放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、异常球菌-栖热菌门(Deinococcus-Thermus)、酸杆菌门(Acidobacteria)、单糖菌门(Saccharibacteria)、梭杆菌门(Fusobacteria)和变形菌门。 其中:变形菌门为门水平上最大类群,包含34 个OTU;其次为放线菌门,包含31 个OTU(图2)。
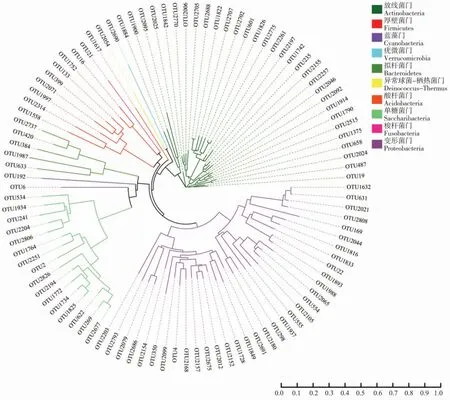
图2 基于OTU 的棉蚜体内主要细菌系统进化树Fig. 2 Phylogenetic tree of bacteria in A. gossypii based on OTU sequence
2.4 有翅和无翅型体内细菌多样性的对比
通过PCA、PCoA 分析发现: 有翅型棉蚜4个重复和无翅型棉蚜4 个重复各形成1 个类群(图1C、D)。 鉴定出的234 个OTU 中,有翅型棉蚜体内细菌多样性相对较低, 仅有143 个OTU,隶属于14 门、26 纲、45 目、72 科、97 属、120 种;无翅型棉蚜体内细菌多样性较高, 共有172 个OTU, 隶属于12 门、23 纲、50 目、82 科、106 属、136 种。 维恩图(图3)显示,无翅型棉蚜特有的OTU 隶 属 于2 门、6 纲、19 目、35 科、51 属、67种,有翅型棉蚜特有的OTU 隶属于4 门、9 纲、14目、25 科、42 属、51 种, 有10 门、17 纲、31 目、47科、55 属、69 种为无翅型、有翅型棉蚜所共有。 在门水平上, 无翅型棉蚜特有的是脱铁杆菌门(Deferribacteres)和俭菌总门(Parcubacteria),有翅型棉蚜特有的是硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、梭杆菌门和未定义门(Unclassified),两者共有的为放线菌门、厚壁菌门、蓝藻门、变形菌门等10 个门;在纲水平上,无翅型棉蚜特有的为脱铁杆菌纲(Deferribacteres)、δ- 变 形 菌 纲(Deltaproteobacteria)、ε- 变 形 菌 纲(Epsilonproteobacteria) 等6 个纲, 有翅型棉蚜特有的为浮霉菌纲(Planctomycetacia)、硝化螺旋菌纲(Nitrospira)、绿弯菌纲(Chloroflexia)等9 个纲,而共有的为β- 变形菌纲(Betaproteobacteria)、拟杆菌纲(Bacteroidia)、丙型变形菌纲等17 个纲。
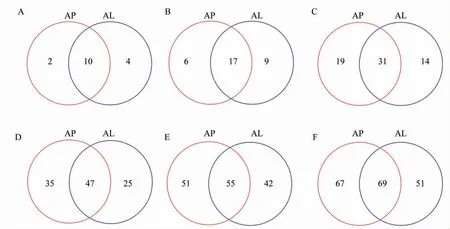
图3 有翅与无翅棉蚜各分类水平的细菌群落维恩图Fig. 3 Venn diagram of community of bacteria from alate and apterous morphs of A. gossypii at different classification levels
在属水平上,有翅型和无翅型棉蚜体内细菌群落中,布赫纳氏菌属(Buchnera)所占比例最高, 在有翅型棉蚜体内细菌中平均占比为99.6%, 在无翅型棉蚜体内细菌中平均占比为99.5%。 其次是红球菌属(Rhodococcus),在有翅型和无翅型棉蚜成虫中分别占0.136%和0.078%(图4A)。 在2 种翅型的棉蚜中,多种细菌的丰度具有显著差异, 红球菌属在有翅型棉蚜中的相对丰度显著高于其在无翅型棉蚜中的相对丰度,而未分类- 蓝藻纲(“未分类”表示该纲的未分类属) 在有翅型棉蚜中的相对丰度(0.005%)显著低于其在无翅型棉蚜中的相对丰度(0.024%)(图4B)。
3 讨论
共生菌与宿主存在互利共生关系, 在昆虫的生长发育、繁殖、寄主适应等过程中发挥重要作用,是最近研究的热点[36]。 共生菌在沙漠蝗(Schistocerca gregaria)肠道产生一些对其有益的酚类物质能够抗菌和防御病原体[37];吴玉新 等[38]研 究 发 现 桃 蚜(Myzus persicae) 与 其 共生菌存在协同进化的关系。 研究发现,宿主的表型是由其基因组和微生物基因组共同决定的[39]。 近年的研究表明,许多微生物参与宿主各种表型可塑性,其中一些微生物似乎与蚜虫的翅多型现象有关[40]。 为了更好地了解棉蚜体内细菌群落与翅多型之间的关系,本研究对有翅型与无翅型棉蚜体内细菌群落进行测序,分析有翅与无翅2 种翅型棉蚜体内细菌的多样性与丰度差异。 本研究共鉴定出棉蚜体内细菌187 种,其中有翅蚜特有的为51 种,无翅蚜特有的为67 种。
在16S rRNA 基因序列高通量测序中, 布赫纳氏菌属是棉蚜优势菌属,在2 组样品中平均相对丰度均最高,这与Shang 等[20]的研究一致。布赫纳氏菌为初级共生细菌,在蚜虫宿主体内经历了长期的平行进化,参与蚜虫生长发育和繁殖等主要生命活动[41]。它可以影响麦长管蚜翅的可塑性,为宿主提供生长发育的必需氨基酸[17,42]。 布赫纳氏菌属在有翅型棉蚜中的相对丰度为99.6%,在无翅型棉蚜中的相对丰度为99.5%,差异不显著。这一结果与Hardie 等[43]的研究结果相悖,可能是因为物种的差异,也可能是因为测序手段存在一定的局限性。 红球菌属在有翅型棉蚜中的相对丰度为0.136%, 而在无翅型棉蚜中的相对丰度为0.078%,在2 种翅型棉蚜中的相对丰度存在显著差异; 虽然蓝藻纲细菌在棉蚜中的相对丰度低,但其在2 种翅型棉蚜中的相对丰度具有显著差异(图4B)。 对昆虫中红球菌属细菌的研究不多,在蚜虫中的相关研究更是寥寥无几。 本研究中红球菌属在2 种翅型棉蚜中的相对丰度不高却存在显著差异,这是否与棉蚜翅型分化存在联系有待验证。
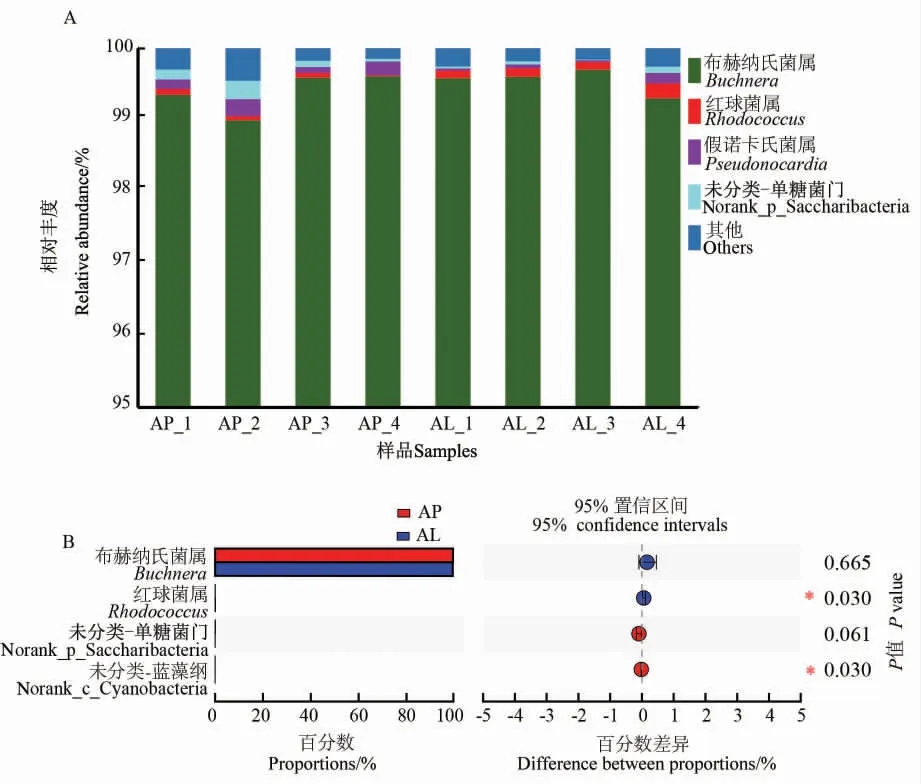
图4 有翅型和无翅型棉蚜在属水平上的细菌多样性差异Fig. 4 The difference of diversity of bacteria on genus level in alate and apterous morphs of A. gossypii
4 结论
本研究分析了有翅型与无翅型棉蚜体内细菌群落的差异,以探究其与宿主翅型分化之间的联系。 结果显示:无翅型棉蚜成虫的体内细菌群落多样性高于有翅型棉蚜成虫;在棉蚜有翅型与无翅型成虫中都含有大量布赫纳氏菌属细菌,且有翅型棉蚜成虫体内布赫纳氏菌属的相对丰度略高;在2 种翅型棉蚜中均检测到一定含量的红球菌属细菌,并且该菌属在2 种翅型棉蚜中的相对丰度存在显著差异。
