GhROP6 通过调控茉莉酸合成与木质素代谢参与棉花抗黄萎病反应
2022-07-07周雪慧高二林王钰静李焱龙袁道军朱龙付
周雪慧,高二林,王钰静,李焱龙,袁道军,朱龙付
(华中农业大学/ 作物遗传改良国家重点实验室,武汉 430070)
棉花 (Gossypium) 作为一种重要的经济作物,是纺织品行业的重要原料来源,在各主产棉国家和地区的国民经济中占据重要地位。 然而,棉花在生长过程中往往受到各种生物胁迫和非生物胁迫,如虫害、病害、干旱等,严重影响其产量和品质。 黄萎病是影响我国棉花产量和品质的主要病害之一,大丽轮枝菌(Verticillium dahliae)是我国棉花黄萎病的主要致病菌[1],也入侵马铃薯、辣椒、橄榄等多种粮食和经济作物[2]。 黄萎病导致植物叶片失绿黄化、维管束褐变,甚至整株坏死[3-4]。 但棉花抗黄萎病的分子机制仍不清楚。
小G 蛋白是具有鸟苷三磷酸酶(guanosine triphosphatase,GTPase)活性的GTP 结合蛋白。根据功能的差异, 小G 蛋白可以划分为5 个家族,即Ras、Rho、Rab、Ran 和Arf。 素有植物“分子开关” 之称的Rho GTPase (Rho-related guanosine triphosphatase from plants,ROP), 广泛参与植物生长发育及多种信号转导过程[5-6]。 高度保守的小G 蛋白有4 个GTP/GDP 结合结构域和1 个与下游效应蛋白结合的结构域[5,7-8]。 小G 蛋白活性由一些调控因子控制, 即鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)、GTPase激活蛋白(GTPase-activating protein, GAP)以及鸟嘌呤核苷酸解离抑制剂(GDP dissociation inhibitor,GDI)等。GEF 与结合GDP 的GTPase形成低亲和力复合物,在核苷酸裂解后,转化为高亲和力的无核苷酸复合物。GTP 的结合使复合物回到低亲和状态,GEF 被释放, 生成激活态的GTPase。 激活状态下的小G 蛋白与GAP 相互作用,促使ROP 失活[9-11]。 GDI 抑制GDP 与GTP 的交换,是ROP 活性的负调节因子[10]。小GTP 结合蛋白有组成型结合GDP 的非激活形式(dominant negative,DN) 突变体以及组成型结合GTP 的激活形式(constitutively active,CA)突变体[9-10]。 研究表明,ROP 的N 端第15 位甘氨酸突变为缬氨酸导致ROP 被锁定在结合GTP 的组成型激活形式,即形成CA 突变体,第20 位苏氨酸突变为谷氨酰胺产生抑制GDP 结合的DN 突变体[10]。
研究证实ROP 参与包括调控花粉管生长、根毛生长、植物生长发育、响应生物和非生物胁迫在内的多种信号转导过程[7,12-16]。 激活ROP2 可以促进盐胁迫下拟南芥(Arabidopsis thaliana)微管细胞的重新聚集及幼苗的存活[17]。 水稻(Oryza sativa) 中超表达OsRac1能增加粒宽和粒重,推测OsRac1 通过影响细胞分裂来调节水稻的粒宽和产量[18]。 激活OsRac1 还可增强水稻对细菌疫病和稻瘟病的抗性,影响相关防御基因的表达[16],进一步研究发现,OsRac1 和转录激活因子RAI1 共同作用参与水稻对稻瘟病抗性[19]。超表达组成型StRac1显著增加马铃薯细胞中过氧化氢含量, 增强马铃薯对晚疫病菌的抗性; 抑制StRac1表达则削弱马铃薯对晚疫病菌的抗性[20]。棉花Rac13 能激发活性氧 (reactive oxygen species,ROS)产生,参与棉花次生壁形成过程,影响纤维品质[21]。 目前,尚未见关于ROP 参与棉花抗病的报道。
前期棉花转录组分析发现Gh_A01G1392.1基因的编码产物与拟南芥ROP6 高度同源, 抑制Gh_A01G1392.1的表达会削弱棉花对黄萎病的抗性。 本研究拟对棉花ROP家族进行生物信息学分析, 对Gh_A01G1392.1在棉花抗黄萎病中的功能进行初步鉴定,为棉花抗黄萎病的分子育种提供理论基础。
1 材料与方法
1.1 植物材料
供试植物材料为陆地棉(G.hirsutum) 品系Jin668、拟南芥哥伦比亚生态型(Columbia-0)、本氏烟(Nicotiana benthamiana)。
1.2 基因克隆和生物信息学分析
从Cotton FGD(http://cottonfgd.org/)网站下载GhROP6(Gh_A01G1392.1)基因的全长序列,从Jin668 叶片中扩增克隆GhROP6基因。
通过blast 获得棉花基因组中所有ROP基因, 使用DNAMAN 软件进行序列相似性分析。利用MEGA 5 软件对GhROP基因和AtROP基因进行系统进化分析,自展值(bootstrap value)设为1 000,其他参数为系统默认值[22]。
根据陆地棉基因组信息找到每个基因在染色体上的位置, 利用Mapchart 软件绘制GhROP基因的染色体分布图。 从Cotton FGD 网站下载棉花转录组数据,利用MEV 软件绘制热图,分析GhROP家族基因组织表达模式。
1.3 基因表达分析
取正常生长4 周的棉花幼苗根、茎、叶,开花期的花瓣、花药、柱头及开花当天、开花后1 d(1 day post anthesis,1 DPA)、5 DPA 和10 DPA 的胚珠和纤维,迅速在液氮中冷冻,-70 ℃保存备用[23],用于分析GhROP6在棉花不同组织中表达水平。
利用Jin668 的4 周龄叶片,研究不同激素处理下GhROP6的表达变化。 分别用100 mmol·L-1茉莉酸甲酯(methyl jasmonate,MeJA)和1 mmol·L-1水杨酸(salicylic acid,SA)喷施叶片,以清水作为对照(mock),于处理后0、1、3、6、12 h 取棉花根系并迅速在液氮中冷冻,-70 ℃保存备用[23]。
采用异硫氰酸胍法[24]从Jin668 组织器官中提取总RNA,通过1.5%(质量分数)琼脂糖凝胶电泳检测其完整性后,参考Gao 等[23]方法进行反转录聚合酶链式反应 (reverse transcription polymerase chain reaction,RT-PCR)。以反转录得到的cDNA 为模板, 在ABI 7500 Real-Time PCR 仪(Applied Biosystems,美国)上进行实时荧光定量聚合酶链式反应(quantitative real-time PCR,qRTPCR), 程序为95 ℃5 min,95 ℃30 s、55~60 ℃30 s、72 ℃20 s、 扩 增28 ~35 个 循 环, 以GhUBQ7(Gh_A11G0969.1)作为内参基因,每个样本设3 次生物学重复。 所用引物及本研究中其他引物信息见附表1。
1.4 载体构建和遗传转化
通过病毒介导的基因沉默(virus-induced gene silencing,VIGS) 试验研究GhROP6基因功能。 参考Gao 等[23]的方法,利用烟草脆裂病毒(tobaccorattlevirus,TRV)VIGS 载体,扩增GhROP6的保守片段,构建包含TRV:GhROP6 载体、阴性对照空载体TRV:00、 阳性对照GhCLA1(Cloroplastos alterados 1) 载体TRV:GhCLA1 分别转化农杆菌。 将农杆菌重悬液分别注射到生长10 d 左右的棉花子叶, 对应的植株分别记为TRV:GhROP,TRV:00 及TRV:CLA1,2 周后利用RT-PCR 检测GhROP6基因的沉默效果。
在GhROP6突变位点设计2 对引物,进行重叠PCR 分别获得组成型激活的CA-GhROP6突变体序列和组成型非激活的DN-GhROP6突变体序列,将GhROP6及其2 个突变体序列分别构建到超表达载体pMDC83, 并转化农杆菌GV3101。 通过叶片注射法[25]转化烟草叶片,以注射含绿色荧光蛋白(green fluorescent protein,GFP)基因的空载体作为对照。 侵染后48 h,取转化烟草叶片在激光共聚焦显微镜(徕卡,德国)下观察绿色荧光蛋白的分布情况,研究GhROP6 蛋白及其突变体的亚细胞定位。
利用蘸花法[27]将CA-GhROP6 和DN-GhROP6超表达载体分别转化拟南芥,获得转基因拟南芥材料, 经阳性筛选和表达量检测选取T2植株进行后续试验。
1.5 黄萎病抗性鉴定
棉花接种。VIGS 处理后15 d,选取长势一致的棉花幼苗接种强致病力落叶型黄萎病菌V991,接种后7~10 d 观察植株发病情况。 按植株黄萎病发生程度分为5 个病级[28],根据Xu 等[29]方法统计接种后15 d 的病情指数并进行真菌恢复培养试验[28]。真菌恢复培养:将棉株茎段置于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,于25 ℃培养箱中培养4 d 左右,观察表型并拍照。 在接种V991 后24 h 取棉花叶片和根系、接种后16 d 取棉花根系迅速在液氮中冷冻,-70 ℃保存用于后续研究。
拟南芥接种实验:拟南芥生长4 周左右开始接种黄萎病菌V991, 取接种后24 h 拟南芥叶片和根系、接种后18 d 的拟南芥根系迅速在液氮中冷冻,-70 ℃保存用于后续研究。
1.6 JA 含量测定及相关基因的表达
利用1.5 中接种V991 后24 h 的棉花和拟南芥叶片,参考Liu 等[30]方法提取和检测茉莉酸-异亮氨酸(jasmonic acid-isoleucine,JA-Ile)含量。以1.5 中接种V991 后24 h 的棉花和拟南芥根系为材料,通过qRT-PCR 进行JA 合成及信号转导通路相关基因的表达分析。
1.7 木质素含量测定及相关基因的表达
取1.5 中接种后16 d 的棉花根系和接种后18 d 的拟南芥根系,参照Bubna 等[31]的巯基乙酸法测定木质素含量(以鲜物质质量计)。 以1.5 中接种后24 h 的棉花和拟南芥根系为材料, 利用qRT-PCR 检测木质素合成相关基因的表达。
1.8 数据处理
利用Microsoft Excel 2019 软件进行数据处理及作图, 采用t检验分析处理与对照间的差异显著性。
2 结果与分析
2.1 陆地棉ROP 基因家族成员鉴定及表达分析
根据拟南芥11 个AtROP 序列,通过序列比对和结构分析, 在陆地棉中鉴定出28 个同源基因(附表2)。对拟南芥和陆地棉ROP 的氨基酸序列的系统发育分析表明,Gh_A01G1392.1 与AtROP6 同源性最高(图1A),相似性达到93.4%(附 图1), 将 其 编 码 基 因 命 名 为GhROP6。GhROP6编码区共597 bp,编码198 个氨基酸残基, 氨基酸序列比对发现GhROP 蛋白都含有ROP 结构,包括4 个GTP/GDP 结合域、与下游靶蛋白结合的效应域和碳末端的可变区域 (附图2)。 染色体分布研究发现,24 个基因对称分布在A 亚基因组和D 亚基因组,3 个基因特异性地分布在D 亚基因组,另外1 个基因分布在未分配染色体的scaffold 上(附图3)。
根据棉花转录组数据对GhROP进行组织表达模式分析,结果(图1B)显示,GhROP在胚珠、柱头、开花后10 d 和20 d 的种子中表达量较高,在根、茎、花瓣、花药和开花后20 d 的纤维中表达量较低;qRT-PCR 分析发现GhROP6在花瓣、柱头和开花后10 d 的纤维中高水平表达(图2A),表明GhROP可能存在功能分化。 与清水对照相比,GhROP6的表达量在SA 处理1 h 后显著下调,在MeJA 处理6 h、12 h 后显著上调(图2B),推测其可能参与JA 抗病信号通路的调控。

图1 棉花ROP 基因的系统进化分析及转录水平分析Fig. 1Phylogenetic analysis and transcript level profiles of ROP genes in upland cotton
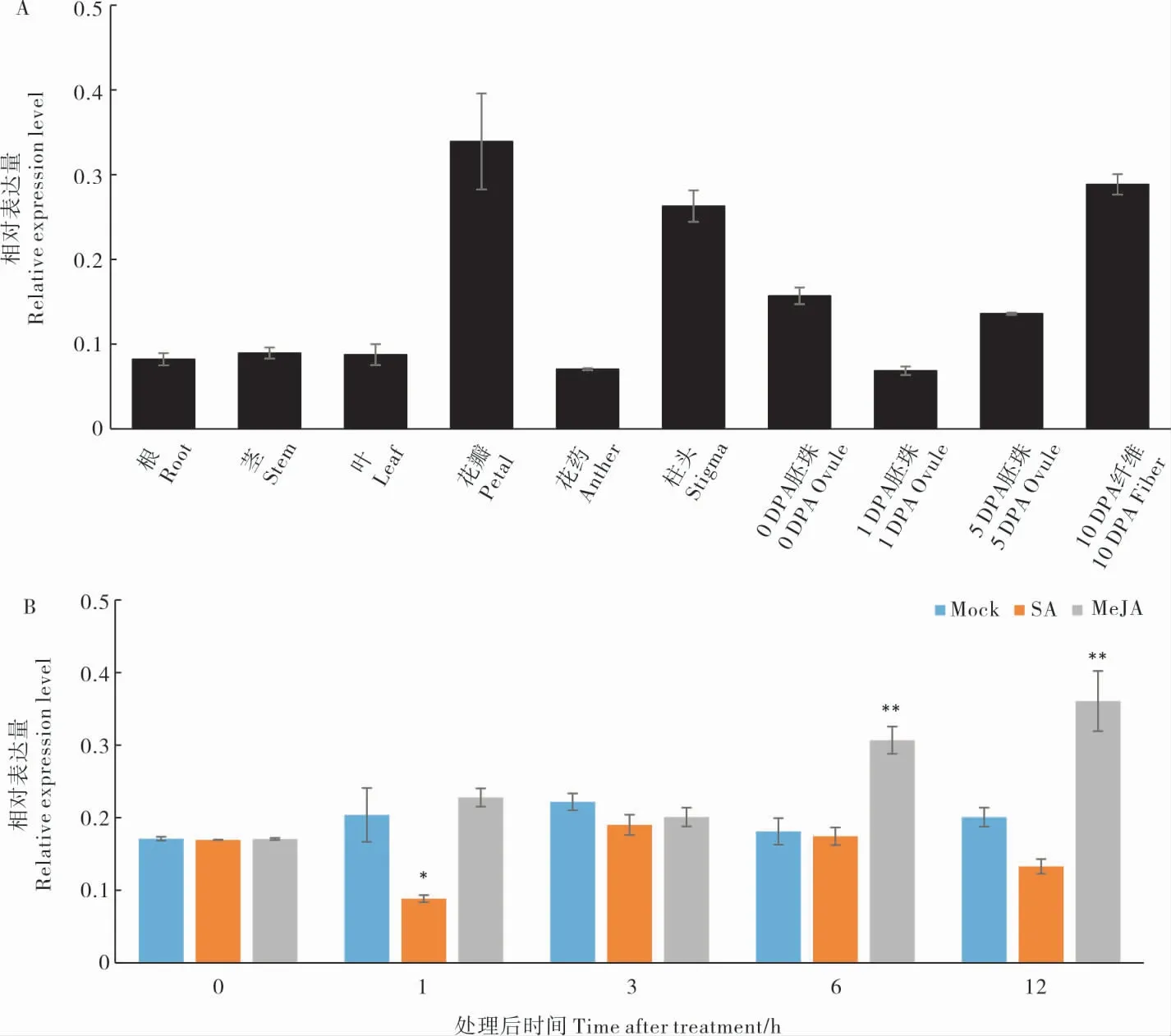
图2 GhROP6 在不同器官和不同激素处理下的表达模式分析Fig. 2 Expression profile analysis of GhROP6 in cotton organs and different phytohormone treatments
2.2 GhROP6 的亚细胞定位分析
激光共聚焦显微镜观察发现,GhROP6-GFP、CA-GhROP6-GFP 和DN-GhROP6-GFP 3 个 融 合蛋白的荧光均分布在烟草叶表皮细胞质膜,单独表达GFP 的对照处理荧光则分布在细胞质和细胞核中(图3),这表明GhROP6 及其2 个突变蛋白均定位于细胞质膜且其亚细胞定位不依赖于其活性。
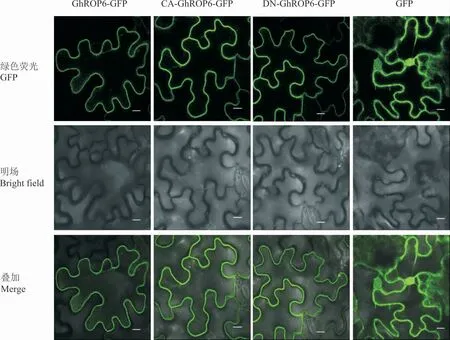
图3 GhROP6 及其突变型的亚细胞定位Fig. 3 Subcellular localization of GhROP6 and its mutants
2.3 抑制GhROP6 表达降低棉花对黄萎病抗性
注射后14 d,阳性对照TRV:CLA1 植株出现叶片白化表型, 表明VIGS 体系正常 (图4A),RT-PCR 检测发现, 沉默棉花植株根中GhROP6的表达水平降低(图4B)。 水处理后,GhROP6沉默植株植株与对照植株无明显差异 (图4C);接种V991 后,GhROP6沉默植株萎蔫、黄化、发病、坏死的叶片比对照植株更多(图4C),GhROP6沉默植株的病情指数极显著高于对照植株 (图4D)。 棉花剖秆试验与真菌恢复培养可以看出,GhROP6沉默植株体内病菌数量更多 (图4E~F)。 上述结果表明,抑制GhROP6表达会削弱棉花对黄萎病的抗性。
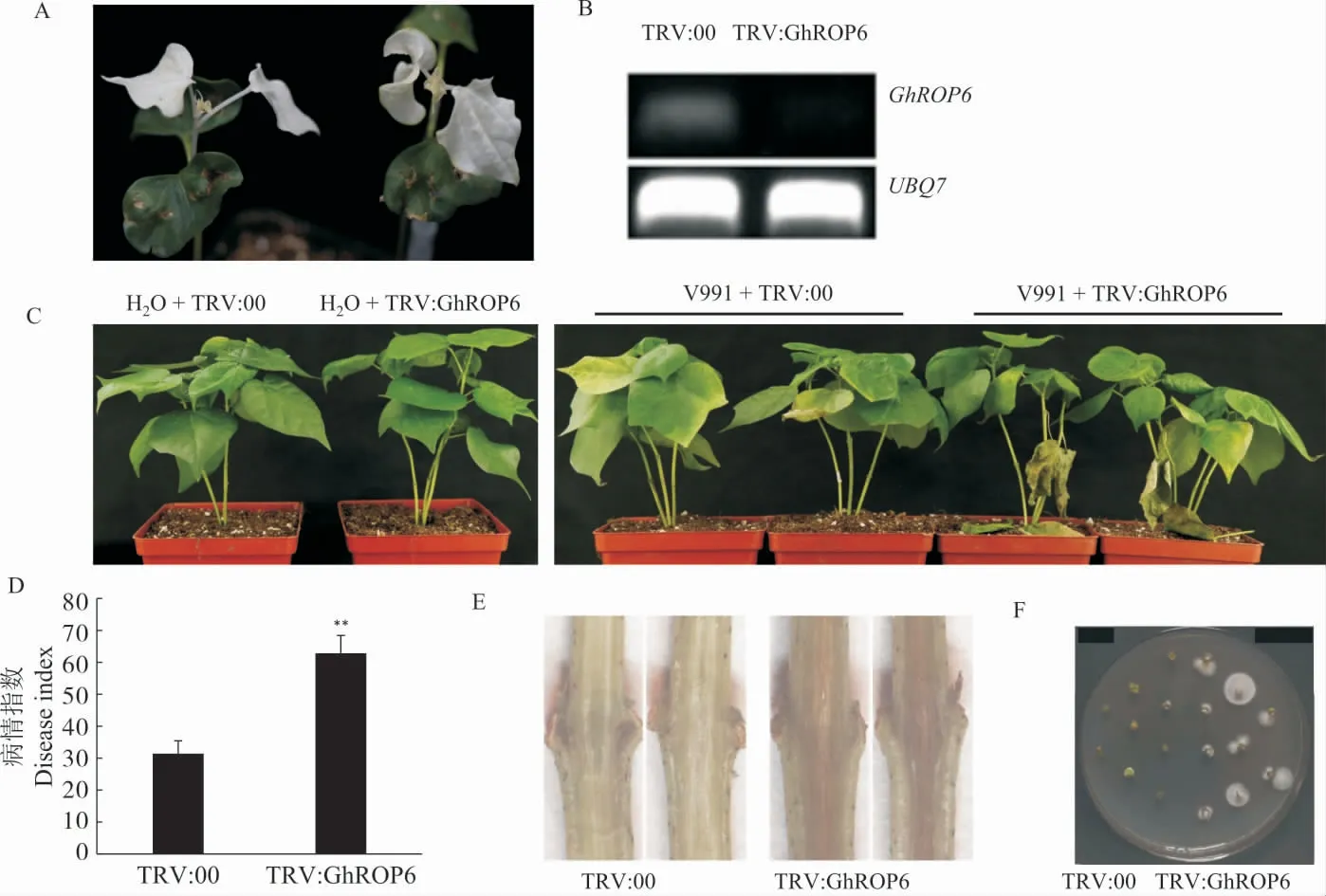
图4 抑制GhROP6 表达削弱棉花对黄萎病菌的抗性Fig. 4 Silencing of GhROP6 impairs cotton resistance to V. dahliae

图5 JA 信号通路相关基因的表达量和JA-Ile 含量Fig. 5 The expression level of JA-related genes and JA-Ile content
对JA 信号通路相关基因的表达分析结果(图5A~B)显示:在接种V991 后24 h,对照植株根中参与JA 生物合成的GhLOX1、GhAOS1、GhAOS2、GhAOC1、GhOPR3-1、GhOPR3-3基 因以及参与JA 信号转导的GhMYC2基因表达量均增加; 同样,GhROP6沉默植株的GhLOX1、GhAOS1、GhAOS2、GhOPR3-1、GhOPR3-3以 及GhMYC2在接菌后的表达量均高于水处理植株,说明GhLOX1、GhAOS1、GhAOS2、GhOPR3-1、GhOPR3-3以及GhMYC2基因受黄萎病菌诱导上调表达。 未接种黄萎病菌时,GhROP6沉默植株中参与JA 生物合成的基因GhLOX1、GhAOS1、GhAOS2、GhAOC1、GhOPR3-1、GhOPR3-3和参与JA 信号通路的基因GhMYC2的表达水平低于对照植株; 接种V991 后,GhROP6沉默植株中这些基因的表达水平均极显著低于其在对照植株中的表达水平。 这些结果表明, 接种大丽轮枝菌会诱导棉花JA 信号通路相关基因的表达, 抑制GhROP6的表达会降低JA 信号通路相关基因表达量。 检测结果(图5C)表明,抑制GhROP6表达后植株中JA-Ile 含量极显著降低。 这暗示GhROP6 可能参与棉花JA 合成及信号通路的调控,沉默GhROP6基因会抑制黄萎病菌诱导的JA 的生物合成和信号转导。
2.4 抑制GhROP6 基因表达会减少木质素的合成
对接种V991 后16 d 的棉花根中的木质素含量测定结果(图6A)表明,未接种V991 时,对照植株(TRV:00)和GhROP6沉默棉株(TRV:GhROP6) 木质素含量无显著差异; 接种V991后,对照植株和GhROP6沉默植株的木质素含量均增加;但GhROP6沉默植株木质素含量显著低于对照植株。 棉花茎秆切片的组织化学染色结果(图6B)显示,GhROP6沉默植株染色较对照植株更浅。 基因表达量分析结果(图6C)显示:接种V991 后, 对照植株中参与木质素合成的基 因GhCCR-1、GhF5H-1、GhCCoAOMT-2和GhCCoAOMT-3的表达量均增加,GhROP6沉默植株的GhCCR-1和GhF5H-1表达水平上调。未接种V991 时,GhROP6沉默植株植株中GhCCR-1、GhF5H-1、GhCCoAOMT-2和GhCCoAOMT-3等基因的表达水平低于对照植株,其中仅GhF5H-1的表达量与对照差异极显著;接种V991 后,这4个基因在TRV:GhROP6 植株中的表达水平均极显著低于对照植株。 这些结果表明,接种大丽轮枝菌会诱导棉花木质素合成,沉默GhROP6的表达会抑制V991 诱导的木质素合成和积累。
太原市君怡小区B座位于太原市平阳路与晋阳街交叉路口,地上32层,地下1层,采用剪力墙结构。传统的剪力墙结构由于刚度大,地震作用下吸收能量多,且变形性能较差,结构的耗能高,破坏严重。由于建筑功能的需要,常在剪力墙上开设门、窗以及结构洞,形成了连肢剪力墙。连肢剪力墙又有两种,一种为等肢,另一种为不等肢。在该工程中,不等肢剪力墙发挥着重要的作用,而连梁的强度、刚度以及变形性能对连肢剪力墙的抗震性能有很大的影响。本文运用MIDAS/GEN研究该工程中连梁刚度对不等肢连肢梁抗震性能的影响。
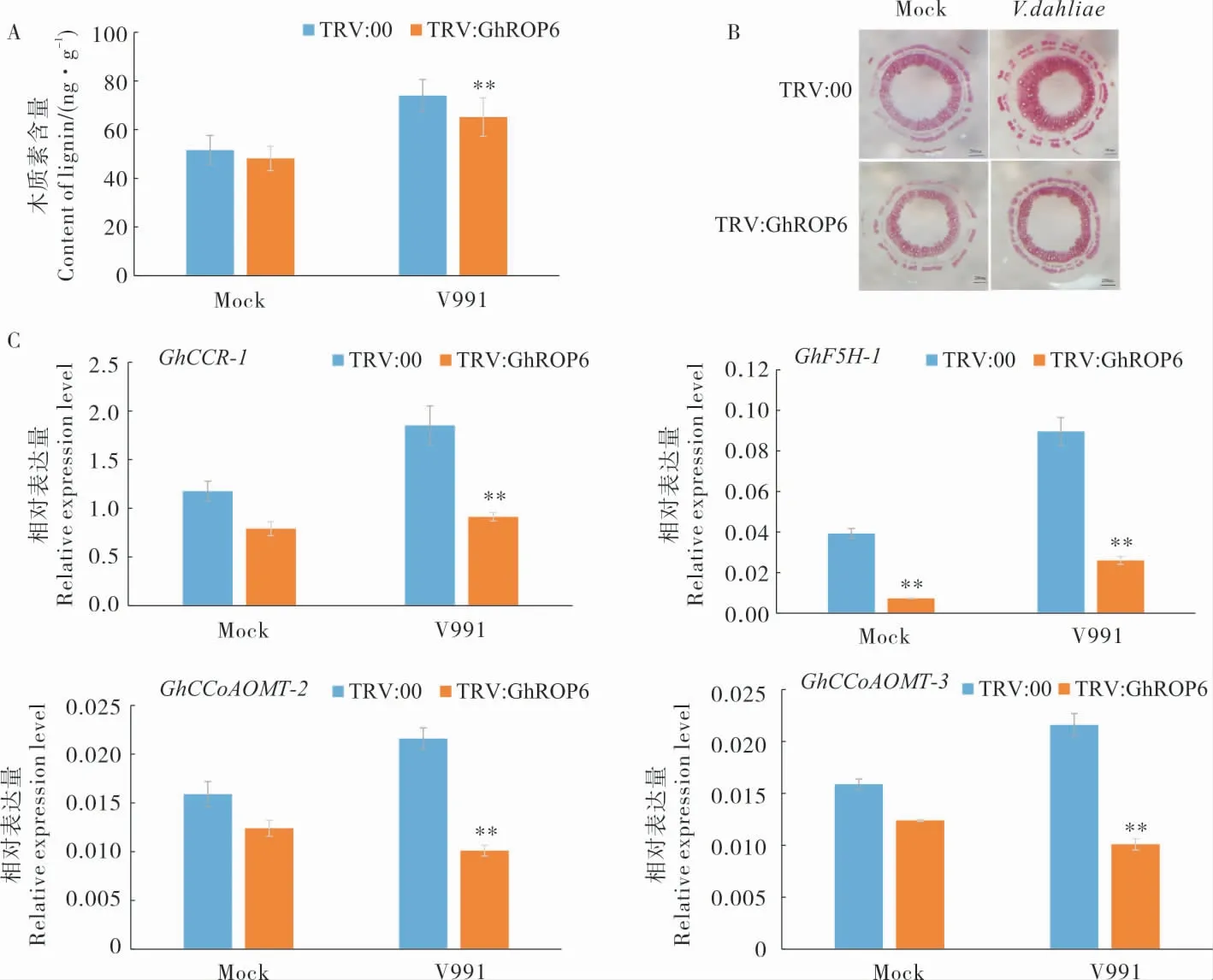
图6 木质素含量及木质素合成相关基因表达量Fig. 6 Lignin content and the expression level of genes-involved in lignin biosynthesis
2.5 GhROP6 在拟南芥中超表达增强其抗病性
在拟南芥中超表达CA-GhROP6和DNGhROP6(附图4),经转基因阳性检测和GhROP6表达量测定(附图5),选取超表达CA-GhROP6的CA2、CA3 和 超 表 达DN-GhROP6的DN18、DN19 株系用于后续研究。接种黄萎病菌后,与野生型(wild type,WT)拟南芥相比,CA2、CA3 发病较轻、萎蔫叶片数量较少,病情指数低于野生型;而DN18 和DN19 的发病情况稍重,叶片萎蔫严重,病情指数更高(图7A~B)。
基因表达分析表明,CA2 和CA3 中JA 信号通 路 相 关 基 因AtAOS1、AtAOC1、AtOPR3和AtMYC2表达水平均显著高于WT、DN18 和DN19, 且CA2 和CA3 中JA-Ile 含量显著高于WT、DN18 和DN19 (图7C~D)。 与WT 相比,CA2 和CA3 中木质素含量增加,且CA2 中木质素含量显著高于WT, 而DN18、DN19 中木质素含量降低。 与WT 相比,CA2 和CA3 中木质素合成相关基因AtPAL1、AtPAL2、AtC4H、AtF5H的表 达 水 平 升 高, 且CA2 中AtPAL1、AtPAL2、AtF5H表达水平显著高于WT 中的表达水平,(图7E ~F)。 这 些 结 果 说 明 组 成 型 激 活 的GhROP6 可以促进拟南芥JA 合成与木质素合成,提高JA-Ile 和木质素含量,提升植株对黄萎病抗性。
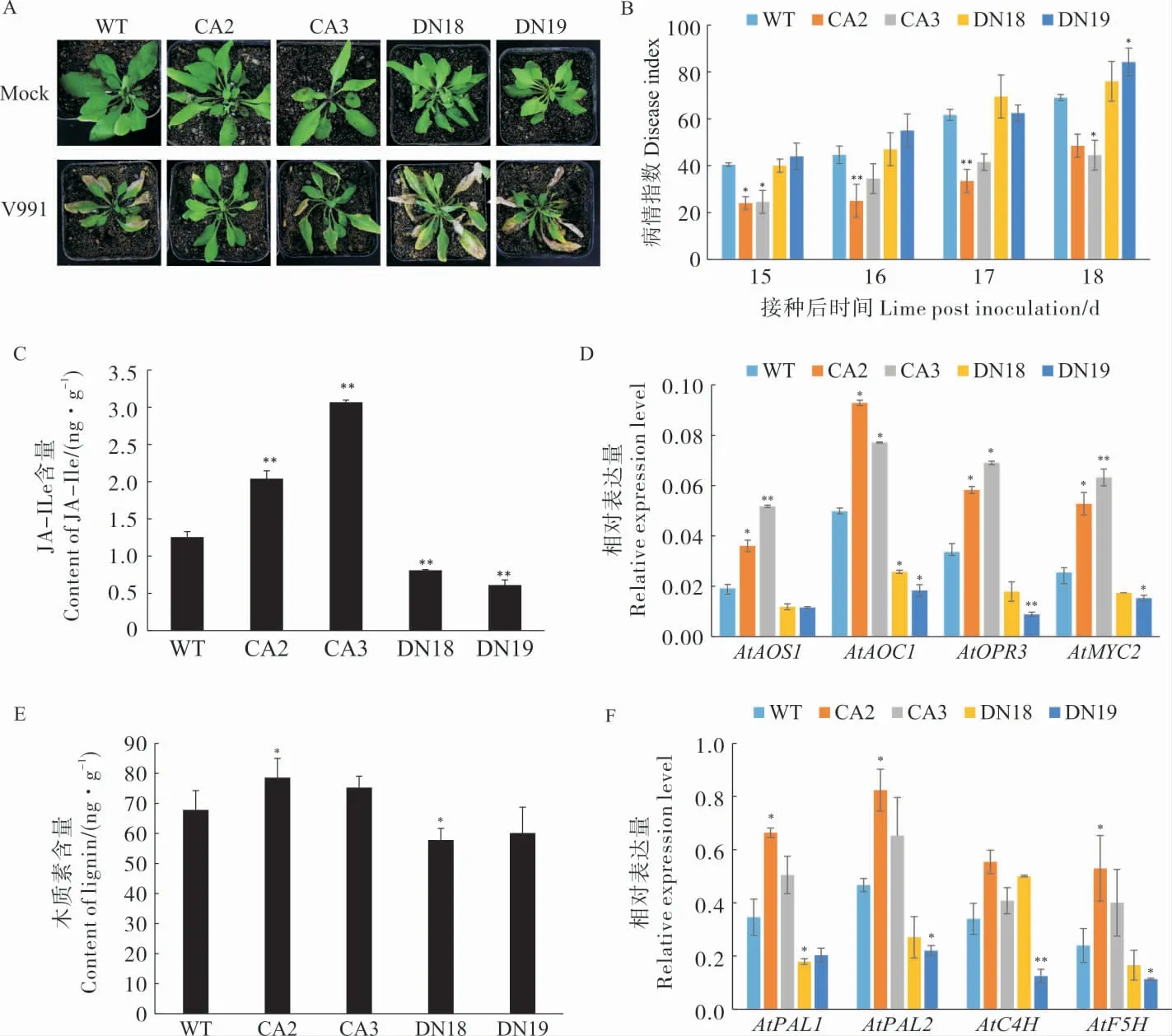
图7 超表达GhROP6 提高转基因拟南芥的抗病性Fig. 7 Overexpression of GhROP6 enhances A. thaliana resistance to V. dahliae
3 讨论
黄萎病是棉花生产中的主要病害,研究棉花与大丽轮枝菌互作的分子机理具有重要意义。 越来越多的研究发现木质素合成、SA 和JA 介导的抗病信号通路的相关基因在棉花抗黄萎病过程中发挥重要作用[22,32-34]。 在黄萎病菌侵染的棉花RNA 测序数据中发现编码小G 蛋白的ROP基因的表达水平有明显变化[32]。 序列分析显示该基因编码产物在氨基酸水平与AtROP6 相似度高,因此,将其命名为GhROP6。 ROP 蛋白包含一个N 端催化G 结构域用于核苷酸和效应子结合,一个C 端的HVR 结构域负责亚细胞定位[9]。 研究报道CA-AtROP6 N 端融合GFP 的蛋白定位于质膜,而DN-AtROP6 C端融合GFP的蛋白主要定位于核周区域[35]。 本研究发现GhROP6、CAGhROP6 和DN-GhROP6 与GFP 的融合蛋白均定位于烟叶表皮细胞的质膜, 与OsRac1 在水稻原生质体中的定位相似[16]。
通过VIGS 初步证实GhROP6在植物免疫中发挥重要作用。抑制GhROP6表达降低了植株抗性,暗示GhROP6 可能参与了棉花抗病性的信号转导。 此外,获得了超表达GhROP6的转基因拟南芥株系,CA-GhROP6株系相比于WT 和DN株系更抗黄萎病,DN-GhROP6则在一定程度上抑制拟南芥黄萎病抗性。 这进一步证明GhROP6参与了棉花抗黄萎病的信号转导过程。
JA 在植物对病原菌的防御反应中发挥重要作用,利用MeJA 处理可提高拟南芥对多种病原菌的抗性[36]。 前人研究发现,沉默JA 信号通路中的负调控因子GhHDTF1 能激活JA 抗病信号通路,进而增强棉花对黄萎病抗性[37]。 GhCPK33 是棉花黄萎病抗性的负调控因子,磷酸化GhOPR3导致其稳定性降低,从而抑制JA 的合成[38]。ROP也与植物激素介导的免疫反应密切相关。 超表达大麦ROP基因的CA-HvRAC1 植株对大麦白粉病的抗性增强[39]。AtROP6突变体内SA 含量增加, 推测ROP6可能调控SA 信号通路影响拟南芥对白粉病的响应过程[40]。也有研究报道ROP 为植物免疫反应的负调节因子。 在马铃薯中超表达拟南芥DN-ROP1会增强马铃薯对晚疫病的抗性。 在DN-AtROP1转基因植株中,LOX的表达被显著诱导, 说明AtROP1主要通过影响JA 信号通路负调控马铃薯对晚疫病抗性[41]。 在本研究中, 经MeJA 处理后,GhROP6的表达量明显上调, 经SA 处理后,GhROP6的表达量略有降低,说明GhROP6主要响应激素JA 的诱导。同时,接种V991 后,GhROP6沉 默 植 株JA-Ile 含 量、JA信号通路中相关基因的表达量均显著低于对照植株, 表明抑制GhROP6的表达会削弱JA 合成及信号通路。 对接种V991 的转基因拟南芥进行JA 含量和相关基因表达量分析发现,CA 株系相比于WT 和DN 株系,JA-Ile 含量更高。综合前人研究, 推测ROP作用于不同的病原菌可能会有不同的功能。
除植物激素外,木质素作为机械屏障在植物抗性建立过程中是非常重要的[42-43]。 木质素合成酶OsCCR1 是OsRac1 的 靶 标 蛋 白,OsCCR1 与激活态的OsRac1 结合可控制木质素的合成,进而调节水稻防御反应[44]。 在烟草中超表达小麦TaRac1能提高木质素含量, 增强烟草对黑胫病和青枯病的抗性[45]。 本研究中, 接种V991 后,GhROP6沉默植株中木质素含量低于对照,与木质素生物合成相关的GhCCR、GhCCoAOMT、GhF5H等基因的表达水平也有所下降。对接种后的拟南芥进行木质素含量以及木质素信号通路相关基因表达量分析发现, 超表达CA-GhROP6拟南芥中木质素含量高于野生型拟南芥和超表达DN-GhROP6的拟南芥的木质素含量, 表明GhROP6参与木质素生物合成调控, 但GhROP6调控JA 合成与木质素代谢的具体机制仍有待进一步研究。
4 结论
本研究鉴定了陆地棉中28 个ROP基因家族成员并克隆了GhROP6。 激素处理表明GhROP6基因可能响应JA 抗病信号通路。 抑制GhROP6表达导致参与茉莉酸合成及信号转导、木质素抗病信号通路的相关基因表达水平显著下降,降低棉花对黄萎病抗性、降低JA-Ile 和木质素含量。 此外,在拟南芥中,超表达组成型激活的GhROP6 能增强拟南芥抗病性,提高JA-Ile 和木质素含量,说明GhROP6 能通过调控JA 合成、JA 信号转导和木质素代谢参与棉花抗黄萎病反应。
附件:
详见本刊网站(http://journal.cricaas.com.cn/)本文网页版。
附表1 本研究所用的引物序列
Table S1 List of primers used in this study
附表2 陆地棉中ROP基因基本信息
Table S2 The information ofROPgenes in upland cotton(Gossypium hirsutum)
附图1 AtROP6 和GhROP6 氨基酸序列比对
Fig.S1 Sequence alignment analysis between AtROP6 and GhROP6
附图2 陆地棉ROP 蛋白序列比对
Fig. S2 Sequences alignment of ROP proteins in upland cotton
附图3GhROP基因的染色体分布
Fig.S3 ThechromosomedistributionofGhROPgenes
附图4 GhROP6 与CA、DN 突变体氨基酸序列比对分析
Fig.S4 SequencealignmentanalysisbetweenGhROP6、CA and DN mutant
附图5 不同转基因拟南芥株系中GhROP6基因表达分析
Fig.S5 Expression ofGhROP6in different transgenicArabidopsislines
