肉桂精油和肉桂醛的抑菌、抗氧化和酪氨酸酶抑制活性研究
2022-07-06束成杰潘洁尘石宝俊
路 露, 束成杰, 葛 翎, 潘洁尘, 朱 凯, 石宝俊*
(1.南京林业大学 化学工程学院,江苏 南京 210037;2.南京野生植物综合利用研究院,江苏 南京 211100;3.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037)
精油是由芳香植物形成的具有强烈气味的挥发性复合物。 目前已生产了大约3 000种精油,其中将近300种精油已用于保健、香料、化妆品、农业和食品工业[1-2]。肉桂为樟科樟属植物肉桂(CinnamomumcassiaPresl)的干燥树皮,又名玉桂、牡桂等,是世界上重要的香料和药材之一[3]。肉桂中可以提取出丰富的肉桂油,其主要含肉桂醛等挥发性成分以及多糖、多酚、黄酮等非挥发性成分。近年来肉桂精油的生物活性研究备受关注。Chen等[4]研究发现,肉桂中的多酚类物质可对胰岛素敏感性具有一定的影响;肉桂中黄酮类物质不仅可以延缓食物的变质,而且对自由基造成的损伤有抑制作用[5]。Ka等[6]发现肉桂醛能抑制癌细胞的增殖,同时还有报道肉桂醛具有抑菌[7-9]、抗氧化[10]和杀螨[11]的作用,而对于肉桂精油及其内在成分与生物活性构效关系的研究较少涉及。因此,本研究对比了肉桂精油及其主要成分肉桂醛的生物活性,以期为进一步开发肉桂在医药、食品、化妆品等行业的选择应用奠定基础。
1 实 验
1.1 原料、试剂与仪器
肉桂精油,购于广西藤县龙庆农业科技发展有限公司。肉桂醛(纯度≥99%)、 2,2′-联氮双(3-乙基苯并噻唑啉- 6-磺酸)二铵盐(ABTS)、 2,4,6-三吡啶基三嗪(TPTZ)、丁基羟基茴香醚(BHA,纯度98%),上海阿拉丁生化科技股份有限公司;酪氨酸酶溶液、熊果苷(纯度99%),Sigma公司;左旋多巴(L-DOPA)溶液,Abcm公司;二甲基亚砜(DMSO,纯度>99%),分析纯。大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、白色念珠菌(Candidaalbicans)、枯草芽孢杆菌(Bacillussubtilis)和绿脓杆菌(Pseudomonasaeruginosa),南京野生植物资源综合利用研究院提供。
LB培养基:胰蛋白胨1 g、酵母抽提物0.5 g、NaCl 1 g、琼脂2 g、蒸馏水100 mL,121 ℃进行高压灭菌20 min。YPD 培养基:酵母抽提物1 g、蛋白胨2 g、葡萄糖2 g、琼脂2.5 g、蒸馏水100 mL,121 ℃进行高压灭菌20 min。
气相色谱-质谱(GC-MS)联用仪,安捷伦科技公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限公司;SPX-150B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;DZX-50KBS立式压力蒸汽灭菌锅,上海三申医疗器械有限公司。
1.2 肉桂精油GC-MS成分分析
色谱条件为:DB-5MS色谱柱,初温80 ℃,保留时间为5 min,以5 ℃/min升温至200 ℃,并保留5 min。进样口温度为250 ℃,FID检测器温度为280 ℃;以氦气为载气,进样量为1μL。
质谱条件为:EI离子源230 ℃,四级杆150 ℃,电子能量70 eV,全程扫描。
1.3 抑菌试验
1.3.1滤纸片试验 参考文献[12]的方法,稍作改动。100 μL的菌液均匀涂布在培养基表面,无菌镊子夹取已灭菌的6 mm滤纸片放在对应培养基上。取10 μL样品打在滤纸片上,丙酮作为对照,静置10 min。放置培养箱中37 ℃培养24 h,每组做3个平行,用游标卡尺测量其抑菌圈直径。
1.3.2最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 根据Tu等[13]所使用的方法稍加修改。用丙酮配制0.04~10 g/L的肉桂精油和肉桂醛溶液,取1 mL液体培养基加入150 μL不同浓度的肉桂精油或肉桂醛溶液,同时加入500 μL菌液(2×108CFU/mL),各试管在37 ℃,180 r/min摇床培养24 h。澄清无菌生长的最低浓度即为MIC;取澄清试管液体50 μL均匀涂布于对应固体培养基上,37 ℃培养24 h,无可见细菌生长即为MBC。每个试验重复3次。
1.4 抗氧化活性测试
1.4.1ABTS自由基清除能力 按照参考文献[14]的方法进行测定。在波长734 nm下测量样品的吸光度(A1),对照组(无水乙醇)的吸光度(A0),BHA作阳性对照。重复3次实验取平均值,ABTS自由基(ABTS+·)清除率(YABTS+·)按式(1)计算:
(1)
1.4.2总抗氧化能力 按照参考文献[15]的方法进行总抗氧化能力实验。在波长593 nm处测定吸光度,绘制标准曲线(FeSO4浓度为横坐标,吸光度为纵坐标),Y=0.002 4X-0.013 8(R2=0.999 5)。通过FeSO4标准曲线,得到对应的铁离子还原/抗氧化能力(FRAP)值。
1.5 抑制酪氨酸酶活性测试
将肉桂精油和肉桂醛溶于PBS,稀释成不同质量浓度溶液,根据文献[16]稍加修改,如表1所示向试管中分别加入肉桂精油或肉桂醛、PBS和酪氨酸酶溶液(100 U/mL),混合均匀,置于37 ℃水浴中反应10 min,分别迅速加入1 mLL-DOPA 溶液(1.5 mmol/L),混合均匀,置于37 ℃水浴中反应5 min,在475 nm处测定吸光度(A),各反应组吸光度分别记作A1、A2、A3和A4,熊果苷为阳性对照。按照式(2)计算酪氨酸酶的抑制率(R):
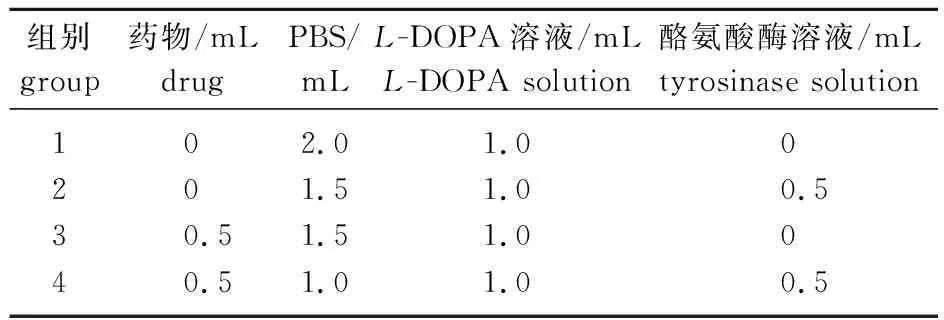
表1 各反应液组成Table 1 Composition of each reaction solution
(2)
2 结果与分析
2.1 肉桂精油GC-MS成分分析
采用GC-MS对肉桂精油化学组成进行分析,结果如表2所示,肉桂精油的主要成分为86.07%肉桂醛和6.25%的2’-甲氧基肉桂醛。

表2 肉桂精油的化学组分Table 2 Chemical groups of Cinnamon essential oil
2.2 肉桂精油和肉桂醛的抑菌活性
2.2.1麦氏比浊法测定菌液浓度 根据试剂盒说明书在430 nm处测定吸光度,绘制标准曲线,公式为y=0.085 3x-0.01,R2=0.998 7。根据吸光度配制浓度为2×108CFU/mL菌液。
2.2.2MIC和MBC测定结果 由表3可知,肉桂精油和肉桂醛对真菌和细菌表现出不同的敏感性,MIC在0.08~1.25 g/L之间。肉桂精油对白色念珠菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和绿脓杆菌的MBC值分别为0.62、 2.5、 10、 5和5 g/L,而肉桂醛对以上5种菌的MBC值分别为0.31、 5、 5、 5和2.5 g/L。可以看出,二者对真菌的抑制效果最佳,MIC分别为0.31和0.08 g/L,MBC分别为0.62 和0.31 g/L。大量研究[17-19]发现肉桂精油对真菌的抑菌作用强于细菌,与本研究的结果一致。通过对比无菌生长的肉桂醛和肉桂精油的MIC和MBC值,肉桂醛对金黄色葡萄球菌、白色念珠菌和绿脓杆菌的抑菌效果优于肉桂精油,而肉桂精油对大肠杆菌的抑菌效果更好。Joris[20]研究发现肉桂精油中的甲氧基肉桂醛对大肠杆菌有很强的抑制作用,而本研究使用的肉桂精油有6.25%的2’-甲氧基肉桂醛。因此肉桂精油对大肠杆菌的抑制作用更强。

表3 肉桂精油和肉桂醛的最小抑菌浓度1)Table 3 Minimum inhibitory concentration of cinnamon essential oil and cinnamaldehyde
2.2.3滤纸片法结果 由表4可知,肉桂精油和肉桂醛抑制白色念珠菌的效果亦是最佳,金黄色葡萄球菌次之。当质量浓度为40 g/L时,肉桂醛对白色念珠菌和金黄色葡萄球菌的抑菌圈直径为(23.25±0.12)mm和(13.42±0.28)mm,而肉桂精油对2种菌种的抑菌直径为(18.46±0.26)mm和(11.58±0.51)mm。由此可知,肉桂醛对白色念珠菌和金黄色葡萄球菌的抑菌效果优于肉桂精油。
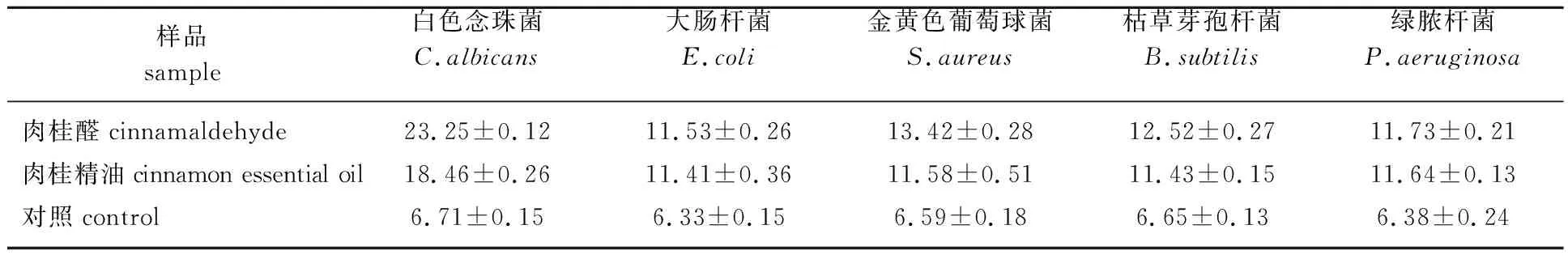
表4 肉桂精油和肉桂醛对供试菌种的抑菌圈直径Table 4 The inhibition zone diameters of cinnamon essential oil and cinnamaldehyde mm
2.3 肉桂精油和肉桂醛的抗氧化活性
2.3.1ABTS+·清除能力 图1为不同质量浓度肉桂精油、肉桂醛,以及BHA对ABTS+·的清除率变化曲线。由图1可知,肉桂醛对ABTS+·的清除率随质量浓度变化不大,在选择的质量浓度范围内清除率只保持在25%左右;而肉桂精油对ABTS+·的清除率随着质量浓度的增加而增大,具有正相关性。当质量浓度为16 g/L时,肉桂精油对ABTS+·的清除率达到94.1%,是相同质量浓度肉桂醛的3倍,与4 mg/L BHA清除效果相当。
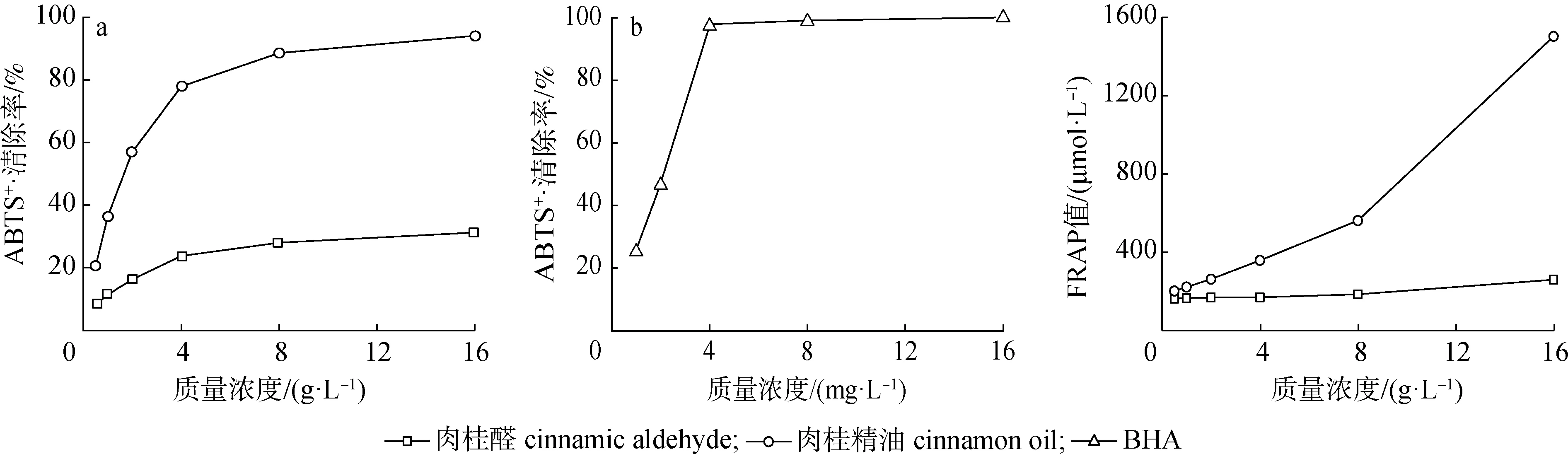
图1 肉桂精油、肉桂醛和BHA对ABTS+·的清除率 图2 肉桂精油和肉桂醛总抗氧化能力Fig.1 Scavenging rate of ABTS+of cinnamon essential oil,cinnamaldehyde and BHA Fig.2 Fe3+ reduction ability of cinnamon essential oil and cinnamaldehyde
2.3.2总抗氧化能力测定 肉桂精油和肉桂醛的总抗氧化能力测定结果见图2。由图可知,肉桂醛的总抗氧化能力随质量浓度变化不大,而肉桂精油的总抗氧化能力随着质量浓度的增加而增大。
16 g/L肉桂醛的总抗氧化能力与258.6 μmol/L FeSO4相当;16 g/L肉桂精油的总抗氧化能力与1 502 μmol/L FeSO4相当,是肉桂醛的5.8倍。由此可知,肉桂精油的抗氧化活性优于肉桂醛。这可能是由于含石竹烯的肉桂精油各抗氧化成分之间存在协同增效作用[21]。
2.4 肉桂精油和肉桂醛的抑制酪氨酸酶活性
众所周知,酪氨酸酶的活性与黑色素的生产量有关[22]。由表5可知,肉桂精油和肉桂醛对酪氨酸酶抑制率随着质量浓度的增加而提高,其中40 g/L的肉桂精油对酪氨酸酶抑制率为83.61%,而相同浓度肉桂醛对酪氨酸酶抑制率达87.34%,分别为同浓度阳性对照熊果苷的1.36和1.42倍。肉桂精油和熊果苷对酪氨酸酶的半数抑制质量浓度(IC50)为4.02 和19.80 g/L,而肉桂醛对酪氨酸酶的IC50小于1.25 g/L。由此可知,二者均对酪氨酸酶具有良好的抑制作用,而肉桂醛的抑制作用强于肉桂精油。
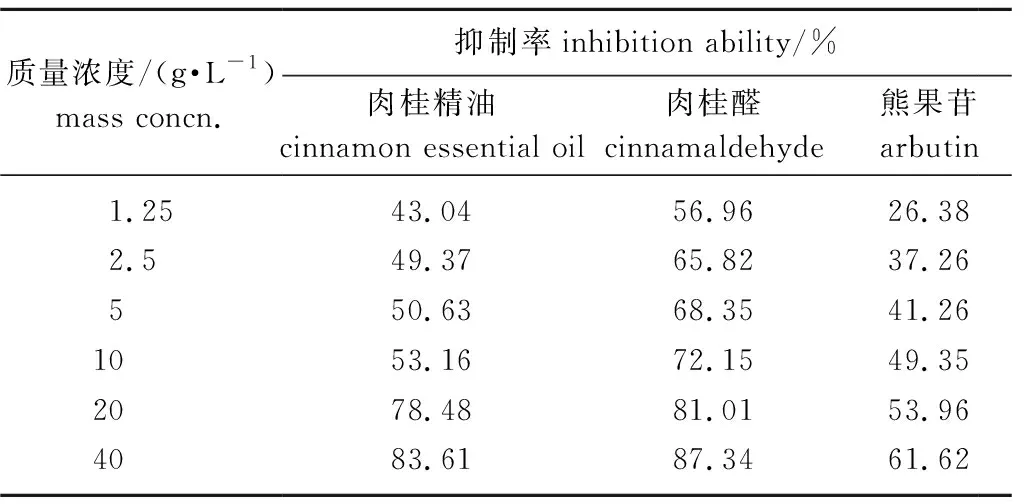
表5 肉桂精油和肉桂醛对酪氨酸酶的抑制效果Table 5 The inhibitory effect of cinnamon essential oil and cinnamaldehyde on tyrosinase
3 结 论
3.1通过滤纸片法、MIC和MBC对比肉桂精油和肉桂醛的抑菌活性,结果显示:二者对真菌的抑制效果均强于细菌;肉桂醛对金黄色葡萄球菌、白色念珠菌和绿脓杆菌的抑制效果优于肉桂精油,二者对枯草芽孢杆菌的抑制效果相近,而肉桂精油对大肠杆菌的抑菌效果优于肉桂醛。
3.2当质量浓度为16 g/L时,肉桂精油的ABTS+·清除率为94.1%,是相同浓度肉桂醛的3倍;FRAP值为1 502 μmol/L,是相同浓度肉桂醛的5.8倍。肉桂精油的抗氧化活性优于肉桂醛。
3.3肉桂精油对酪氨酸酶的半数抑制质量浓度(IC50)为4.02 g/L,而肉桂醛对酪氨酸酶的IC50小于1.25 g/L。由此可知,相对于肉桂精油,肉桂醛具有更好的酪氨酸酶抑制效果。
