有机催化不对称Mannich反应的研究进展
2022-07-05姜惠婷穆宏文许光华延边大学药学院吉林延吉3300吉林医药学院药学院吉林吉林303
姜惠婷,穆宏文,许光华*,金 瑛 (.延边大学药学院,吉林 延吉 3300;.吉林医药学院药学院,吉林 吉林 303)
不对称Mannich反应可以用于制备β-氨基酮类化合物而被广泛的应用于有机合成中[1-3]。目前,金属催化存在毒性大,耗费高等缺点,推动着人们不断寻找更加安全有效,环保经济的新方法、新试剂。有机催化具有经济性,工业化更方便等优点[4]。有机催化不对称反应正逐渐成为一种和化学及制药工业息息相关的方法[5-6],已经成为不对称合成反应研究的热门方向。实现有机催化不对称Mannich反应至关重要的是要研究并选择出高效能、高选择性的有机催化剂。为此,本文将根据催化剂的种类,从金鸡纳碱、手性硫脲、手性磷酸和其他有机催化剂等方面对近些年来有机催化不对称Mannich反应的研究进行简述。
1 金鸡纳碱类催化剂
2019年,周杨[7]小组报道了构建手性N,S-缩醛类化合物的不对称Mannich反应,得到了一系列化合物,产率为81%~90%,对映选择性为87∶13-95∶5er。该系列化合物骨架比较新颖,对之后的光学活性吡唑啉-5-酮衍生物的合成具有指导意义(图1)。
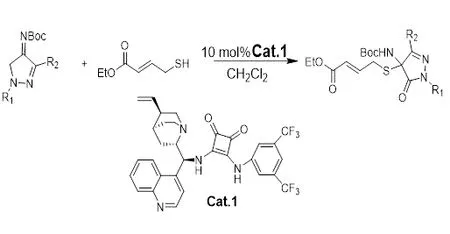
图 1 构建手性N,S-缩醛类化合物的不对称Mannich反应
2019年,Bai[8]小组报道了有机催化手性5-(取代芳基)-1,3,4-噻二唑衍生物的不对称Mannich反应,最佳催化剂体系为:10 mol% Cat.2,以甲苯为溶剂,60 ℃条件下反应60 h。所得目标产物收率为71%~90%,对映选择性为80%-99%ee。得到的1,3,4-噻二唑丙二酸酯对烟草花叶病毒有对抗作用(图2)。

图 2 有机催化合成手性5-(取代芳基)-1,3,4-噻二唑衍生物的不对称Mannich反应
2019年,Liu[9]等报道了以奎宁衍生的手性尿素催化芳胺与靛红亚胺的不对称aza-Mannich反应,产率高至99%,对映选择性高至96%ee(图3)。

图 3 靛红亚胺与芳胺的不对称Mannich反应
2019年,Zhou[10]小组报道了有机催化吡唑啉酮亚胺与β-酮酸的不对称脱羧Mannich反应,得到了一系列手性β-氨基酮-吡唑啉酮衍生物,具有优秀的收率(高达99%)和良好的对映体选择性(高达94∶6er)(图4)。

图 4 吡唑啉酮亚胺与β-酮酸的不对称脱羧Mannich反应
2020年,Wang[11]小组报道了有机催化分子内不对Mannich反应,构建了一系列4-氮杂二氢吲哚化合物。于-30 ℃中反应2 h,所得化合物产率为90%~99%,对映选择性为5%~95%ee,非对映选择性为60∶40-99∶1dr(图5)。

图 5 不对称Mannich反应构建4-氮杂二氢吲哚
2 硫脲类催化剂
2019年,Zhang[12]小组报道了靛红亚胺与三氮唑的不对称Mannich反应,构建了一系列吲哚衍生物。所得化合物产率最高为98%,对映选择性最高达97%ee。该方法可以直接制备具有N,N-缩酮骨架的3,3-二氨基-2-氧吲哚(图6)。

图 6 靛红亚胺与三氮唑的不对称Mannich反应
2019年,Ravi[13]小组报道了N-Boc-苯甲二胺与3-吲哚酮-2-羧酸盐的不对称Mannich反应,得到了一系列手性β-氨基酯化合物。结果表明,使用硫脲催化剂Cat.7,对映选择性最高达99%ee,收率最高达98%。该方法适用于多种底物,包括芳基,萘基和杂芳基环β-酮酯(图7)。

图 7 N-Boc-苯甲二胺与3-吲哚酮-2-羧酸盐的不对称Mannich反应
2019年,Soumendranath[14]小组报道了二氢-3-羰基烷氧基-2-喹诺酮和N-Boc亚胺的不对称Mannich反应,构建了一系列3,3-二取代-2-二氢喹诺酮类化合物。产率为65%~75%,对映选择性为75%~86%ee。该方法为构建具有四元中心的二氢喹诺酮类化合物提供了简单的方案,对2-喹诺酮基序新药的研制具有重要意义(图8)。

图 8 二氢-3-羰基烷氧基-2-喹诺酮和的N-Boc亚胺的不对称Mannich反应
3 手性磷酸类催化剂
2016年,Rainoldi[15]发表了靛红衍生的亚胺与三甲基硅氧呋喃的不对称Mannich反应的研究,该研究应用手性磷酸催化剂Cat.9进行催化,合成了一系列化合物。对映选择性为31%~96%ee,收率为45%~81%,该催化体系的普适性差(图9)。

图 9 靛红衍生的亚胺与三甲基硅氧呋喃的不对称Mannich反应
同年,Zhou[16]小组报道了手性磷酸参与获得β-氨基酸衍生物的研究。收率最高达99%,非对映选择性最高达99∶1,对映选择性最高达99%ee。该方法可成功地一步合成出具有邻近三级和四级立体中心的加合物,催化剂底物选择性广,对芳香和脂肪亚胺均适用(图10)。

图 10 手性磷酸催化的不对称Mannich反应
2019年,黄秋红[17]报道了手性磷酸Cat.11催化噻唑酮与靛红衍生物的研究,构建一系列含有噻唑酮手性3,3-二取代氧化吲哚化合物的不对称Mannich反应。在25 ℃时,反应5 h得到目标产物。该催化体系表现出良好的催化性能(收率为82%~95%,对映选择性为66%~99%ee)。底物加倍投料时,收率和对映选择性均没有降低,为规模化生产提供了思路(图11)。

图 11 噻唑酮与靛红衍生物的不对称Mannich反应
2019年,Ye[18]小组报道了α-叠氮基环酮与醛二胺的不对称Mannich反应,以40%~99%的收率及82%~97%ee的对映选择性获得了一系列具有α-季碳立体中心的手性叠氮化合物。该催化体系可进一步扩展到偶氮二羧酸盐的不对称胺化反应,拓宽了具有α-季碳立体中心的手性有机叠氮化合物的合成方法(图12)。

图 12 α-叠氮基环酮与醛二胺的不对称Mannich反应
4 其他有机催化剂
2018年,Viji[19]小组报道了L-脯氨酸Cat.13催化的苯并噁嗪酮类化合物的不对称Mannich反应,得了到立体选择性较高的产物(对映选择性最高为99%ee,收率最高为92%)(图13)。

图 13 L-脯氨酸催化的不对称Mannich反应
5 总结与展望
近年来,有机催化不对称Mannich反应受到越来越多的关注,并取得了很大的进步。各种高效的不对称有机催化Mannich反应被报道出来。其中金鸡纳碱类催化剂报道较多,具有高性能的手性催化剂也被不断地应用其中。目前仍然具有底物适用范围窄,手性催化剂相对有限等不足。因此,对于有机催化的不对称Mannich反应,仍需要开发新型催化剂,优化催化剂体系,拓宽底物普适性,提高反应的立体选择性。
